SREBP-‐1c, ChREBPy LXR…
21
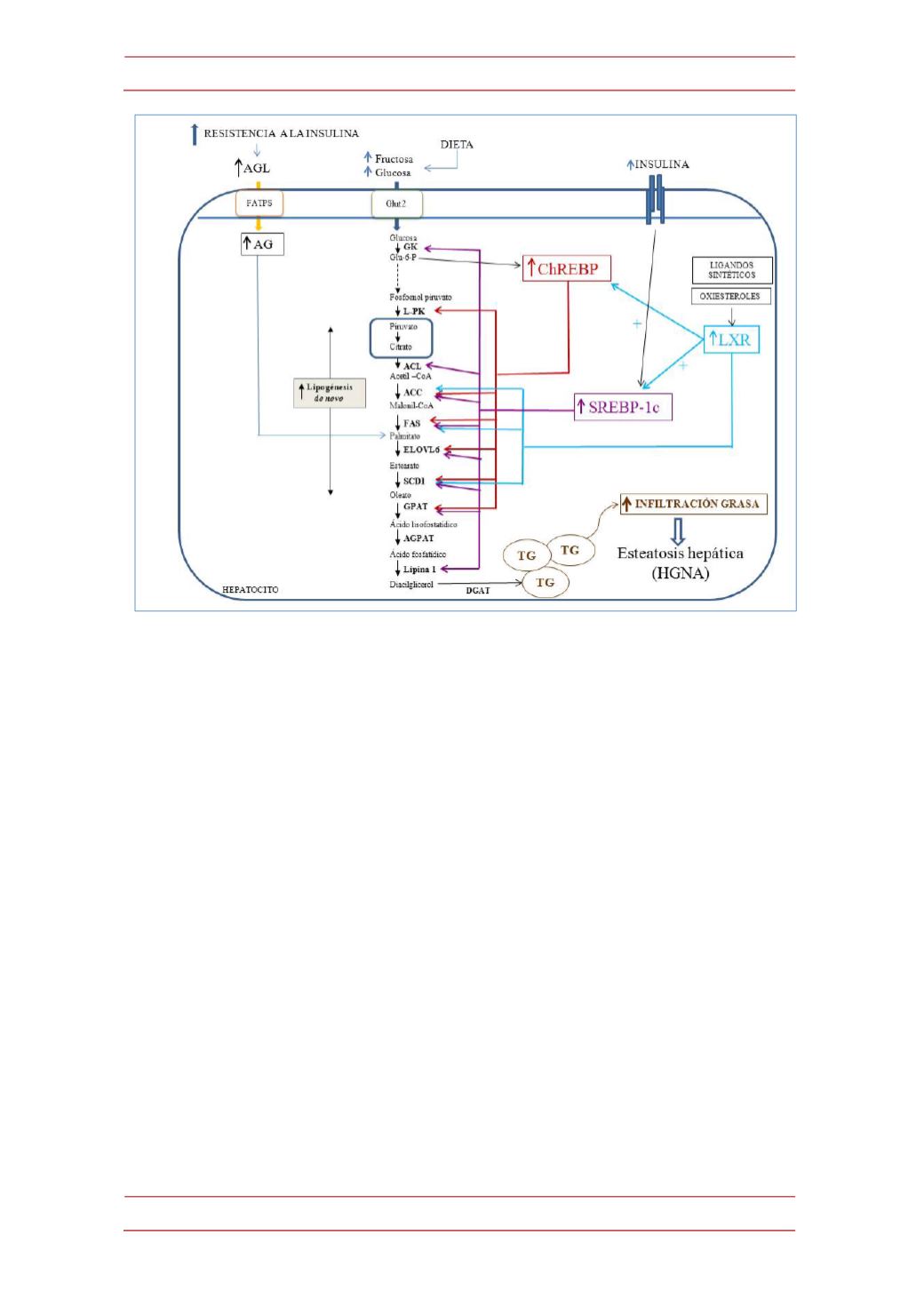
Figura2.
-‐
Interacción funcional entre los factores de transcripción SREBP-‐1c, ChREBPy LXR
en la inducciónde laesteatosishepática.
Enrespuestaaoxiesterolesyotros ligandos, el receptor
nuclear LXR, como principal regulador de la lipogénesis
de novo,
controla los genes que codifican
los factores de transcripción SREBP-‐1c y ChREBP. A su vez, SREBP-‐1c responde a los altos niveles
de insulina, mientras quemetabolitos de la glucosa (Glu-‐6-‐P, Xu 5P, etc.) que penetra en exceso en
el hepatocitomedianteel transportadorGlut-‐2, inducen laexpresióndeChREBP. Unavez activados,
SREBP-‐1c, ChREBP y LXR incrementan la expresión de genes que codifican enzimas implicadas en
la glucólisis (GK, L-‐PK), en la síntesis de los ácidos grasos (ACL, ACC, FAS, ELOVL6, SCD1) y/ode los
triglicéridos (GPAT. Lipina 1), lo que da lugar al aumento del depósito de grasa, que junto a la
procedentede losAGLcirculantes captadospor el hígado, da lugar a laesteatosis. (Véaseel texto).
Oxidaciónde losácidosgrasos
La disminución de las vías de utilización de los AG también puede generar
esteatosis hepática. Los AG son catabolizados a través de la ß-‐oxidación en las
mitocondrias y en los peroxisomas y de laω-‐oxidación en losmicrosomas, siendo
la ß-‐oxidación mitocondrial, la vía dominante de metabolización de los AG de
cadena corta,media y larga (36). Enel HGNAaparecenvarios cambios adaptativos
dirigidos a incrementar la β-‐oxidación mitocondrial para compensar la excesiva
captación y síntesis
de novo
de los AG (37). Sin embargo, si se sobrepasa esta
capacidad oxidativa, los lípidos pueden acumularse en los hepatocitos. Por
ejemplo, un incremento de malonil-‐CoA puede comprometer la β-‐oxidación y
favorecer el acúmulo de los AGpor su función inhibidora de la carnitina-‐palmitoil
transferasa (CPT-‐1), enzimaqueregula laentradade losAGen lamitocondria (38).
También unamenor actividad oxidativa en los peroxisomas induce una esteatosis
severamicrovesicular, como seha observadopor delecióndel gendel enzima acil-‐


