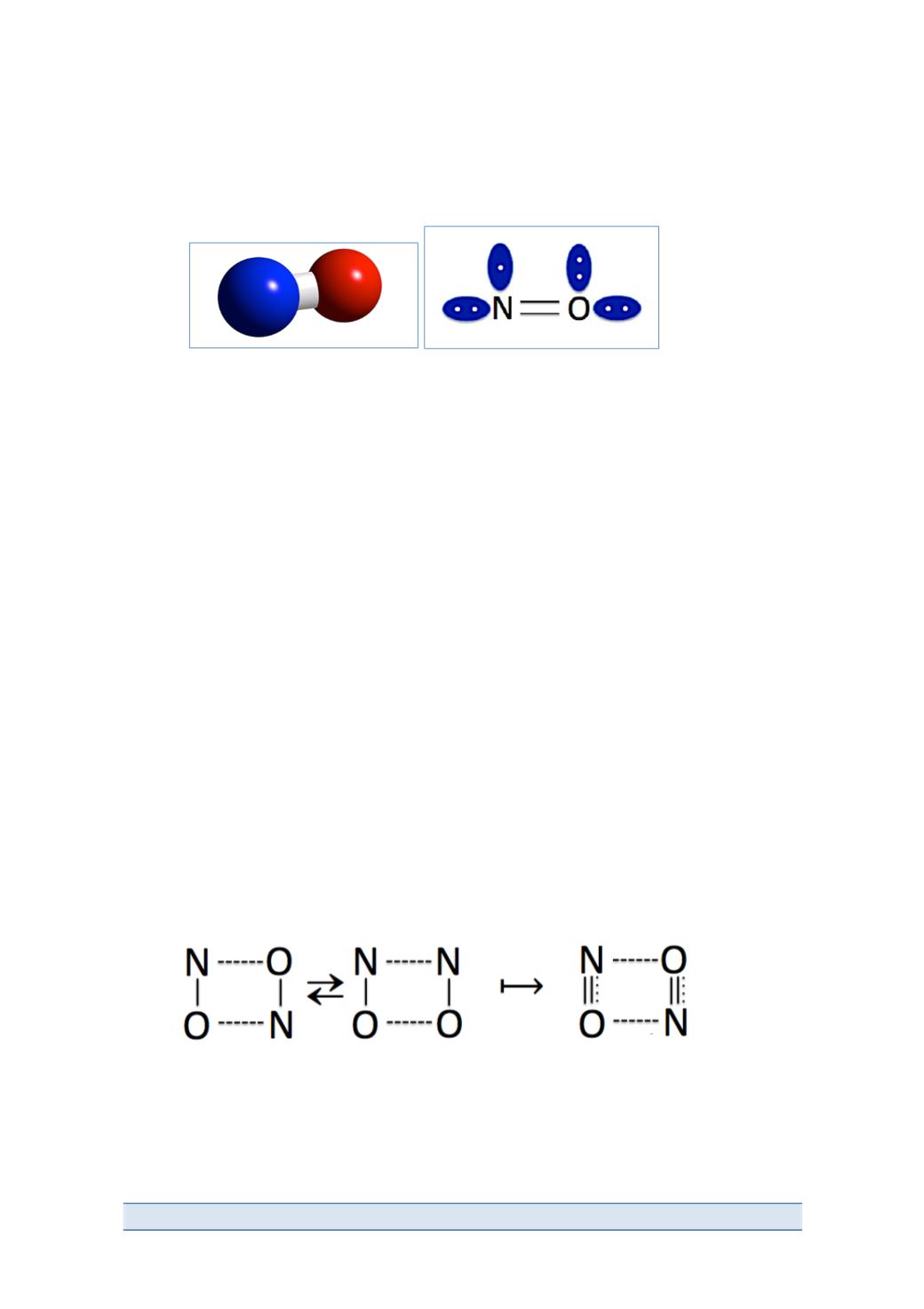
284|Antonio Doadrio
Es pues, una molécula diatómica heteronuclear, donde el nitrógeno se
encuentra en estado de oxidación +2. Su estructura se representa en la siguiente
figura (N en azul, O en rojo):
La distancia de enlace es de 1,15 Å igual a la distancia media para un enlace
doble N=O (1,15 Å). La longitud media para un enlace triple N-‐O es de 1,08 Å y
para un enlace N-‐O sencillo es de 1,36 Å.
El NO gaseoso, puede licuarse para su uso comercial (que es de color azul),
y también puede solidificarse. La forma molecular de estos (líquido y sólido), es la
de un dímero (N
2
O
2
) diamagnético.
Las distancias de enlace N-‐O en el dímero (N
2
O
2
) resultan ser dos de ellas
menores (1,12 Å) que las del monómero NO (1,15 Å) y otras dos mayores (2,4 Å).
Las primeras (1,12 Å), son más cortas que las que corresponden a un doble
enlace N=O (1,15 Å), mientras que las segundas (2,4 Å) son más largas que las de
un enlace sencillo N-‐O (1,36 Å). Esas distancias N-‐O en el dímero y su
diamagnetismo, son compatibles con la presencia de atracciones electrostáticas de
carga negativa entre los átomos de N y O y el consecuente establecimiento de
formas resonantes con electrones móviles en una estructura rectangular, que
representamos en la siguiente figura:
El óxido nítrico se produce por reacción directa de nitrógeno y oxígeno:
N
2
(g) + O
2
(g) ⇄ 2NO(g) ∆H = 173,4 kJ/mol
1,12Å
2,4Å


