Page 60 - A. Doadrio: Quimica Inorganica
P. 60
REACTIVIDAD
Los
hidruros
salinos
son
todos
ellos
termodinámicamente
estables
frente
a
la
descomposición
en
sus
elementos,
ya
que
sus
energías
libres
de
formación
son
negativas.
Por
el
contrario,
la
mayoría
de
los
hidruros
moleculares
son
inestables
frente
a
la
descomposición
en
sus
elementos.
En
general,
puede
observarse
que
los
elementos
más
pesados
dan
lugar
a
los
hidruros
menos
estables.
Esta
tendencia
general
de
la
estabilidad
es
un
reflejo
-‐principalmente-‐
de
la
disminución
de
la
fortaleza
de
los
enlaces
X–H
al
bajar
en
un
grupo.
Los
valores
de
energías
libres
de
formación
(ΔHf)
son
importantes
porque,
en
primer
lugar,
nos
indican
si
es
posible
la
síntesis
directa
del
hidruro
correspondiente
a
partir
de
sus
elementos,
lo
que
ocurre
si
la
energía
libre
es
negativa.
En
segundo
lugar,
nos
descubre
la
reactividad
termodinámica
de
las
especies
correspondientes.
Así,
por
ejemplo,
el
hidruro
de
litio
es
el
más
estable
de
los
hidruros
del
grupo
1
(mayor
valor
negativo
de
la
energía
libre,
mayor
estabilidad)
y
por
tanto,
el
menos
reactivo.
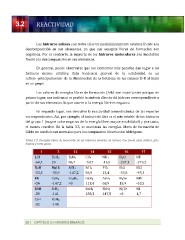
En
la
tabla
3.3,
se
muestran
las
energías
libres
de
formación
de
Gibbs
en
condiciones
normales
para
los
compuestos
binarios
del
hidrógeno.
Tabla
3.3.
Energías
libres
de
formación
de
los
hidruros
binarios
en
kJ/mol.
Con
fondo
azul:
sólidos;
gris:
líquido
y
resto
gases.
1
2
13
14
15
16
17
LiH
BeH2
B3H6
CH4
NH3
H2O
HF
-‐68,4
20
86,7
-‐50,7
-‐16,5
-‐237,1
-‐273,2
NaH
MgH2
AlH3
SiH4
PH3
H2S
HCl
-‐33,5
-‐35,9
-‐147,2
56,9
13,4
-‐33,6
-‐95,3
KH
CaH2
Ga2H6
GeH4
AsH3
H2Se
HBr
-‐36
-‐147,2
>0
113,4
68,9
15,9
-‐53,5
RbH
SrH2
SnH4
SbH3
H2Te
HI
-‐30
-‐141
188,3
147,8
>0
1,7
CsH
BaH2
-‐32
-‐140
60|
CAPÍTULO
3:
HIDRUROS
BINARIOS
Los
hidruros
salinos
son
todos
ellos
termodinámicamente
estables
frente
a
la
descomposición
en
sus
elementos,
ya
que
sus
energías
libres
de
formación
son
negativas.
Por
el
contrario,
la
mayoría
de
los
hidruros
moleculares
son
inestables
frente
a
la
descomposición
en
sus
elementos.
En
general,
puede
observarse
que
los
elementos
más
pesados
dan
lugar
a
los
hidruros
menos
estables.
Esta
tendencia
general
de
la
estabilidad
es
un
reflejo
-‐principalmente-‐
de
la
disminución
de
la
fortaleza
de
los
enlaces
X–H
al
bajar
en
un
grupo.
Los
valores
de
energías
libres
de
formación
(ΔHf)
son
importantes
porque,
en
primer
lugar,
nos
indican
si
es
posible
la
síntesis
directa
del
hidruro
correspondiente
a
partir
de
sus
elementos,
lo
que
ocurre
si
la
energía
libre
es
negativa.
En
segundo
lugar,
nos
descubre
la
reactividad
termodinámica
de
las
especies
correspondientes.
Así,
por
ejemplo,
el
hidruro
de
litio
es
el
más
estable
de
los
hidruros
del
grupo
1
(mayor
valor
negativo
de
la
energía
libre,
mayor
estabilidad)
y
por
tanto,
el
menos
reactivo.
En
la
tabla
3.3,
se
muestran
las
energías
libres
de
formación
de
Gibbs
en
condiciones
normales
para
los
compuestos
binarios
del
hidrógeno.
Tabla
3.3.
Energías
libres
de
formación
de
los
hidruros
binarios
en
kJ/mol.
Con
fondo
azul:
sólidos;
gris:
líquido
y
resto
gases.
1
2
13
14
15
16
17
LiH
BeH2
B3H6
CH4
NH3
H2O
HF
-‐68,4
20
86,7
-‐50,7
-‐16,5
-‐237,1
-‐273,2
NaH
MgH2
AlH3
SiH4
PH3
H2S
HCl
-‐33,5
-‐35,9
-‐147,2
56,9
13,4
-‐33,6
-‐95,3
KH
CaH2
Ga2H6
GeH4
AsH3
H2Se
HBr
-‐36
-‐147,2
>0
113,4
68,9
15,9
-‐53,5
RbH
SrH2
SnH4
SbH3
H2Te
HI
-‐30
-‐141
188,3
147,8
>0
1,7
CsH
BaH2
-‐32
-‐140
60|
CAPÍTULO
3:
HIDRUROS
BINARIOS