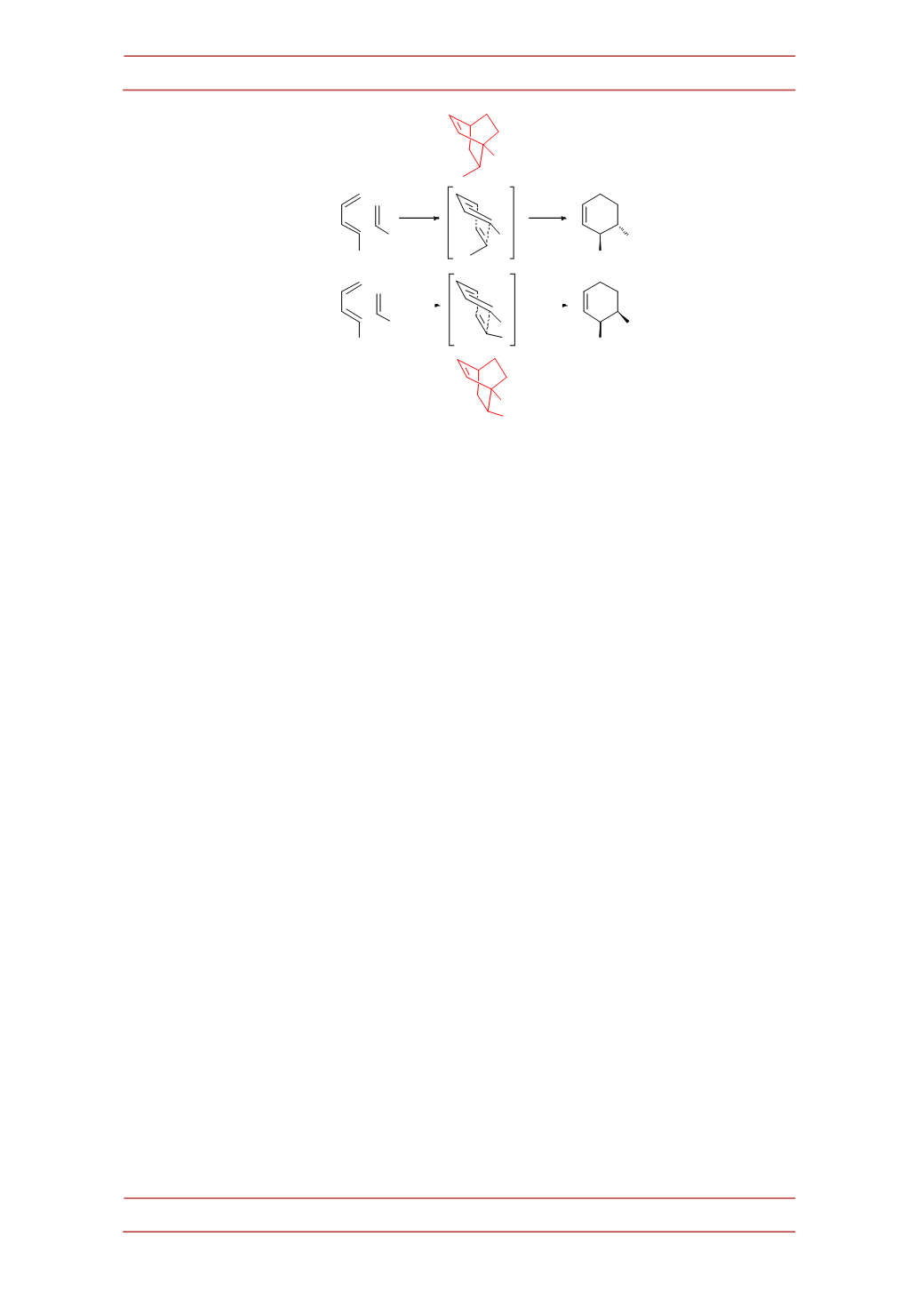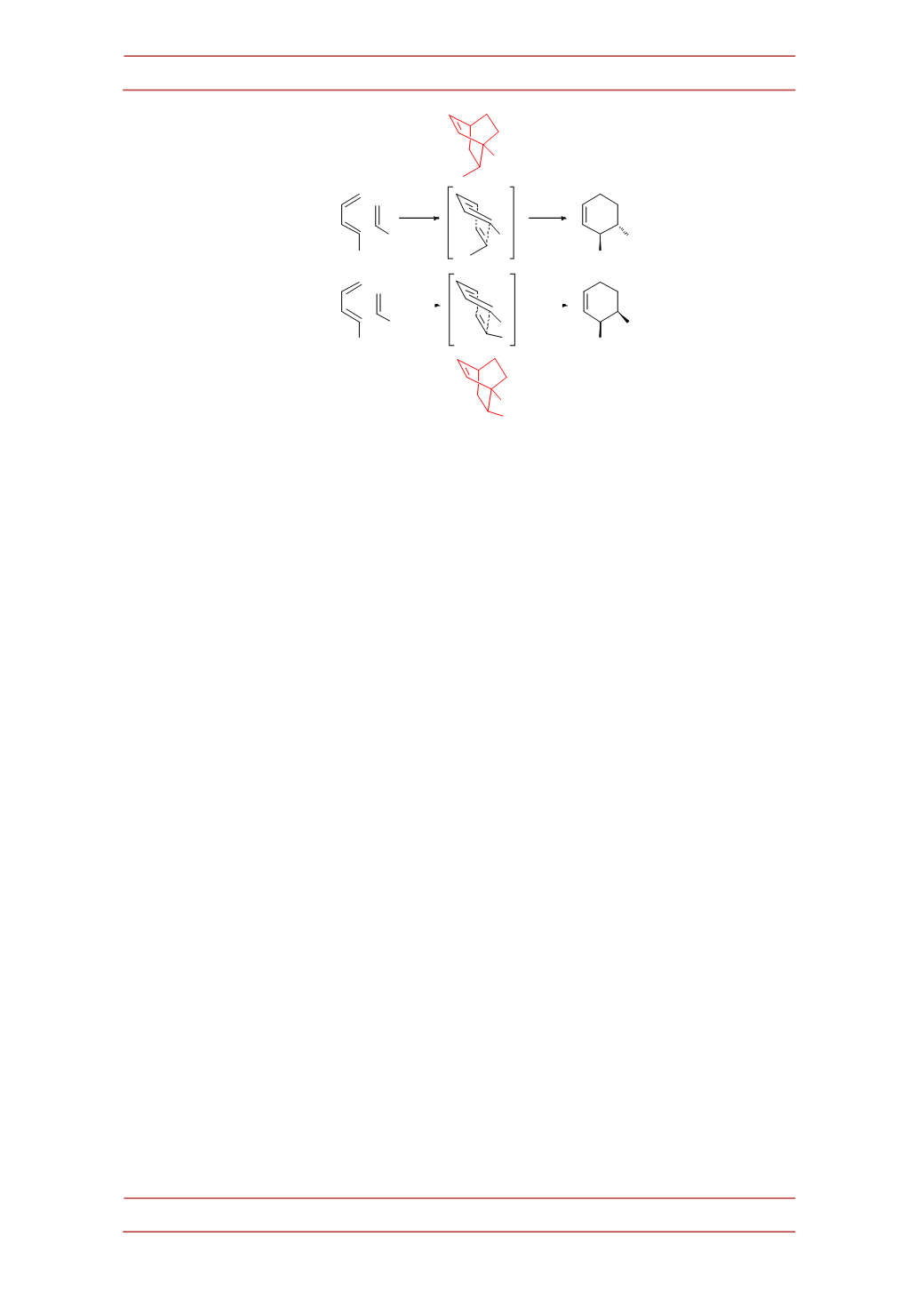
J. R. Lacadena, J. A. Esteban, B. dePascual
416
R
1
R
2
R
1
R
2
R
1
R
2
R
1
R
2
R
1
R
2
R
1
R
2
R
1
R
2
R
1
R
1
ENDO
EXO
Figura 2
.-‐Haptenos diseñados para obtener el producto "endo" y "exo" de la reacción Diels-‐Alder
por similitudconel estadode transición.
Con el finde llevar a cabo el diseño racional de los haptenos, se localizaron
los correspondientes estados de transición, para poder obtener datos
estereoelectrónicos de la reacciónque sedeseaba catalizar. Seutilizóelmétodo
ab
initio
yel nivel de cálculoRHF/3-‐21Gpara localizar los estadosde transiciónenun
sistemamodelo constituido por acrilamida y el ácido
N-‐
(1-‐butadienil) carbámico.
Previamente se realizó un estudio conformacional de los reactivos. Se localizaron
los cuatroestadosde transicióncorrespondientes a los cuatroestereo (endo/exo)-‐
y regioisómeros (orto/meta) (orto endo, orto exo, meta endo ymeta exo) y como
eradeesperarpredicenunamayorestabilidadpara losestadosde transiciónendo.
Apartirdeestos estudios sediseñóel correspondientehapteno teniendoen
cuenta que este deberíamimetizar algunas de las características importantes del
estado de transición. El anticuerpo generado mediante la administración del
haptenodiseñadohade ser capazde reconocer yestabilizar sólounode los cuatro
posibles estados de transición. Los haptenos fueron sintetizados y cristalizados y
su estructura cristalina fue comparada con la estructura calculada del estado de
transición correspondiente, observándose una similitud estructural apreciable.
(Figura3) La utilización de estos haptenos así diseñados permitió el desarrollo de los
anticuerpos capacesde catalizar esta reacciónyobtenerde forma selectivanosolo
el producto de adición favorecida, producto endo, sino también el producto
desfavorecida, productoexo(10).