Page 113 - A. Doadrio: Quimica Inorganica
P. 113
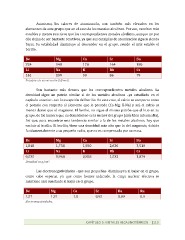
Asimismo,
los
calores
de
atomización,
son
también
más
elevados
en
los
elementos
de
este
grupo
que
en
el
caso
de
los
metales
alcalinos.
Por
eso,
resultan
más
estables
y
menos
reactivos
que
los
correspondientes
metales
alcalinos,
aunque
no
por
ello
dejan
de
ser
bastante
reactivos,
ya
que
sus
entalpías
de
atomización
siguen
siendo
bajas.
Su
estabilidad
disminuye
al
descender
en
el
grupo,
siendo
el
más
estable
el
berilio.
Be
Mg
Ca
Sr
Ba
324
148
178
164
180
Li
Na
K
Rb
Cs
161
109
90
86
79
Entalpías
de
atomización
(kJ/mol).
Son
bastante
más
densos
que
los
correspondientes
metales
alcalinos.
La
densidad
sigue
un
patrón
similar
al
de
los
metales
alcalinos
–ya
estudiado
en
el
capítulo
anterior-‐
con
la
excepción
del
berilio.
En
este
caso,
el
calcio
se
comporta
como
el
potasio
con
respecto
al
elemento
que
le
precede
(Ca-‐Mg;
K-‐Na)
y
así,
el
calcio
es
menos
denso
que
el
magnesio.
El
berilio,
no
sigue
el
mismo
patrón
que
el
litio
en
su
grupo,
de
tal
manera
que
su
densidad
no
es
la
menor
del
grupo
(más
bien
intermedia).
Así
que,
para
encontrar
una
tendencia
similar
a
la
de
los
metales
alcalinos,
hay
que
excluir
al
berilio.
El
berilio,
tiene
una
densidad
más
alta
que
la
del
magnesio,
debido
fundamentalmente
a
su
pequeño
radio,
que
no
es
compensado
por
su
masa.
Be
Mg
Ca
Sr
Ba
1,848
1,738
1,550
2,630
3,510
Li
Na
K
Rb
Cs
0,535
0,968
0,856
1,532
1,879
Densidad
en
g/cm3.
Las
electronegatividades
–que
son
pequeñas-‐
disminuyen
al
bajar
en
el
grupo,
como
cabe
esperar,
ya
que
como
hemos
indicado,
la
carga
nuclear
efectiva
se
mantiene
casi
constante
al
bajar
en
el
grupo.
Be
Mg
Ca
Sr
Ba
Ra
1,0
0,95
0,89
0,9
1,57
1,31
Electronegatividades.
CAPÍTULO
5:
METALES
ALCALINOTÉRREOS
|113
los
calores
de
atomización,
son
también
más
elevados
en
los
elementos
de
este
grupo
que
en
el
caso
de
los
metales
alcalinos.
Por
eso,
resultan
más
estables
y
menos
reactivos
que
los
correspondientes
metales
alcalinos,
aunque
no
por
ello
dejan
de
ser
bastante
reactivos,
ya
que
sus
entalpías
de
atomización
siguen
siendo
bajas.
Su
estabilidad
disminuye
al
descender
en
el
grupo,
siendo
el
más
estable
el
berilio.
Be
Mg
Ca
Sr
Ba
324
148
178
164
180
Li
Na
K
Rb
Cs
161
109
90
86
79
Entalpías
de
atomización
(kJ/mol).
Son
bastante
más
densos
que
los
correspondientes
metales
alcalinos.
La
densidad
sigue
un
patrón
similar
al
de
los
metales
alcalinos
–ya
estudiado
en
el
capítulo
anterior-‐
con
la
excepción
del
berilio.
En
este
caso,
el
calcio
se
comporta
como
el
potasio
con
respecto
al
elemento
que
le
precede
(Ca-‐Mg;
K-‐Na)
y
así,
el
calcio
es
menos
denso
que
el
magnesio.
El
berilio,
no
sigue
el
mismo
patrón
que
el
litio
en
su
grupo,
de
tal
manera
que
su
densidad
no
es
la
menor
del
grupo
(más
bien
intermedia).
Así
que,
para
encontrar
una
tendencia
similar
a
la
de
los
metales
alcalinos,
hay
que
excluir
al
berilio.
El
berilio,
tiene
una
densidad
más
alta
que
la
del
magnesio,
debido
fundamentalmente
a
su
pequeño
radio,
que
no
es
compensado
por
su
masa.
Be
Mg
Ca
Sr
Ba
1,848
1,738
1,550
2,630
3,510
Li
Na
K
Rb
Cs
0,535
0,968
0,856
1,532
1,879
Densidad
en
g/cm3.
Las
electronegatividades
–que
son
pequeñas-‐
disminuyen
al
bajar
en
el
grupo,
como
cabe
esperar,
ya
que
como
hemos
indicado,
la
carga
nuclear
efectiva
se
mantiene
casi
constante
al
bajar
en
el
grupo.
Be
Mg
Ca
Sr
Ba
Ra
1,0
0,95
0,89
0,9
1,57
1,31
Electronegatividades.
CAPÍTULO
5:
METALES
ALCALINOTÉRREOS
|113