Page 110 - A. Doadrio: Quimica Inorganica
P. 110
VARIACIÓN
DE
LAS
PROPIEDADES
PERIÓDICAS
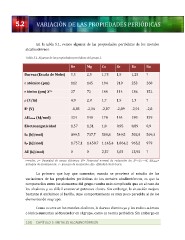
En
la
tabla
5.1,
vemos
algunas
de
las
propiedades
periódicas
de
los
metales
alcalinotérreos:
Tabla
5.1.
Algunas
de
las
propiedades
periódicas
del
grupo
2.
Be
Mg
Ca
Sr
Ba
Ra
Dureza
(Escala
de
Mohs)
5,5
2,5
1,75
1,5
1,25
?
r
atómico
(pm)
112
145
194
219
253
260
r
iónico
(pm)
X2+
27
72
100
114
136
152
ρ
(C/m)
4,9
2,8
1,7
1,5
1,3
?
Eo
(V)
-‐1,85
-‐2,36
-‐2,87
-‐2,89
-‐2,91
-‐2,8
Δ Hatom
(kJ/mol)
324
148
178
164
180
159
Electronegatividad
1,57
1,31
1,0
0,95
0,89
0,9
I1º
(kJ/mol)
899,5
737,7
589,8
549,5
502,9
509,3
I2º
(kJ/mol)
1.757,1
1.450,7
1.145,4
1.064,2
965,2
979
AE
(kJ/mol)
0
0
2,37
5,03
13,95
?
r=radio;
ρ=
Densidad
de
carga
eléctrica;
E0=
Potencial
normal
de
reducción
de:
X2++2e-‐→X;
ΔHatom=
Entalpía
de
atomización;
I=
Energía
de
ionización;
AE=
Afinidad
electrónica.
Lo
primero
que
hay
que
comentar,
cuando
se
proviene
al
estudio
de
las
variaciones
de
las
propiedades
periódicas
de
los
metales
alcalinotérreos,
es
que
la
comparación
entre
los
elementos
del
grupo
resulta
más
complicada
que
en
el
caso
de
los
alcalinos
y
es
difícil
encontrar
patrones
claros.
Sin
embargo,
la
situación
mejora
bastante
si
excluimos
al
berilio,
cuyo
comportamiento
es
muy
poco
parecido
al
de
los
elementos
de
su
grupo.
Como
ocurre
en
los
metales
alcalinos,
la
dureza
disminuye
y
los
radios
atómico
e
iónico
aumentan
al
descender
en
el
grupo,
como
es
norma
periódica.
Sin
embargo
en
110|
CAPÍTULO
5:
METALES
ALCALINOTÉRREOS
DE
LAS
PROPIEDADES
PERIÓDICAS
En
la
tabla
5.1,
vemos
algunas
de
las
propiedades
periódicas
de
los
metales
alcalinotérreos:
Tabla
5.1.
Algunas
de
las
propiedades
periódicas
del
grupo
2.
Be
Mg
Ca
Sr
Ba
Ra
Dureza
(Escala
de
Mohs)
5,5
2,5
1,75
1,5
1,25
?
r
atómico
(pm)
112
145
194
219
253
260
r
iónico
(pm)
X2+
27
72
100
114
136
152
ρ
(C/m)
4,9
2,8
1,7
1,5
1,3
?
Eo
(V)
-‐1,85
-‐2,36
-‐2,87
-‐2,89
-‐2,91
-‐2,8
Δ Hatom
(kJ/mol)
324
148
178
164
180
159
Electronegatividad
1,57
1,31
1,0
0,95
0,89
0,9
I1º
(kJ/mol)
899,5
737,7
589,8
549,5
502,9
509,3
I2º
(kJ/mol)
1.757,1
1.450,7
1.145,4
1.064,2
965,2
979
AE
(kJ/mol)
0
0
2,37
5,03
13,95
?
r=radio;
ρ=
Densidad
de
carga
eléctrica;
E0=
Potencial
normal
de
reducción
de:
X2++2e-‐→X;
ΔHatom=
Entalpía
de
atomización;
I=
Energía
de
ionización;
AE=
Afinidad
electrónica.
Lo
primero
que
hay
que
comentar,
cuando
se
proviene
al
estudio
de
las
variaciones
de
las
propiedades
periódicas
de
los
metales
alcalinotérreos,
es
que
la
comparación
entre
los
elementos
del
grupo
resulta
más
complicada
que
en
el
caso
de
los
alcalinos
y
es
difícil
encontrar
patrones
claros.
Sin
embargo,
la
situación
mejora
bastante
si
excluimos
al
berilio,
cuyo
comportamiento
es
muy
poco
parecido
al
de
los
elementos
de
su
grupo.
Como
ocurre
en
los
metales
alcalinos,
la
dureza
disminuye
y
los
radios
atómico
e
iónico
aumentan
al
descender
en
el
grupo,
como
es
norma
periódica.
Sin
embargo
en
110|
CAPÍTULO
5:
METALES
ALCALINOTÉRREOS