Page 112 - A. Doadrio: Quimica Inorganica
P. 112
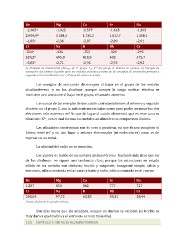
Be
Mg
Ca
Sr
Ba
-‐2,485a
-‐1.925
-‐1.577
-‐1.435
-‐1.305
2.656,6b
2.188,4
1.735,2
1.613,7
1.468,1
-‐1,85c
-‐2,36
-‐2,87
-‐2,89
-‐2,91
Li
Na
K
Rb
Cs
-‐544a
-‐436
-‐352
-‐326
-‐293
520,2b
495,8
418,8
403
375,7
-‐3,05c
-‐2,71
-‐2,92
-‐2,93
-‐2,92
a)
Entalpía
de
hidratación
(ΔHhidr)
de
X+
grupo
1
y
X2+
del
grupo
2.
Valores
en
kJ/mol.;
b)
Energía
de
ionización
del
primer
electrón
para
los
metales
alcalinos
y
suma
de
las
energías
de
ionización
primera
y
segunda
en
los
alcalinotérreos;
c)
Potencial
redox
en
voltios.
Las
energías
de
ionización
disminuyen
al
bajar
en
el
grupo
de
los
metales
alcalinotérreos
-‐y
en
los
alcalinos-‐
porque
aunque
la
carga
nuclear
efectiva
se
mantiene
casi
constante
al
bajar
en
el
grupo,
el
tamaño
aumenta.
Las
sumas
de
las
energías
de
ionización
correspondientes
al
primero
y
segundo
electrón
en
el
grupo
2,
son
lo
suficientemente
bajas
como
para
poder
arrancar
los
dos
electrones
más
externos
ns2,
lo
que
da
lugar
al
catión
elemental,
que
en
este
caso
es
divalente:
X2+,
con
el
cual
forman
los
metales
alcalinotérreos
compuestos
iónicos.
Las
afinidades
electrónicas
son
de
cero
o
positivas,
ya
que
tienen
completo
el
último
nivel
ns2
y
no
dan
lugar
a
aniones
elementales
(ni
moleculares)
como
es
de
esperar
en
un
metal.
La
afinidad
del
radio
no
es
conocida.
Los
puntos
de
fusión
de
los
metales
alcalinotérreos
–bastante
más
altos
que
los
de
los
alcalinos-‐
no
siguen
una
tendencia
clara,
porque
las
estructuras
en
estado
sólido
de
los
metales
son
distintas:
berilio
y
magnesio,
hexagonal
simple;
calcio
y
estroncio,
cúbica
centrada
en
las
caras
y
bario
y
radio,
cúbica
centrada
en
el
cuerpo.
Be
Mg
Ca
Sr
Ba
842
777
727
1.287
650
K
Rb
Cs
63,38
39,31
28,44
Li
Na
180,54
97,72
Puntos
de
fusión
en
grados
Celsius.
Son
más
duros
que
los
alcalinos,
aunque
su
dureza
es
variable
(el
berilio
es
muy
duro
y
quebradizo
y
el
estroncio
es
muy
maleable).
112|
CAPÍTULO
5:
METALES
ALCALINOTÉRREOS
Mg
Ca
Sr
Ba
-‐2,485a
-‐1.925
-‐1.577
-‐1.435
-‐1.305
2.656,6b
2.188,4
1.735,2
1.613,7
1.468,1
-‐1,85c
-‐2,36
-‐2,87
-‐2,89
-‐2,91
Li
Na
K
Rb
Cs
-‐544a
-‐436
-‐352
-‐326
-‐293
520,2b
495,8
418,8
403
375,7
-‐3,05c
-‐2,71
-‐2,92
-‐2,93
-‐2,92
a)
Entalpía
de
hidratación
(ΔHhidr)
de
X+
grupo
1
y
X2+
del
grupo
2.
Valores
en
kJ/mol.;
b)
Energía
de
ionización
del
primer
electrón
para
los
metales
alcalinos
y
suma
de
las
energías
de
ionización
primera
y
segunda
en
los
alcalinotérreos;
c)
Potencial
redox
en
voltios.
Las
energías
de
ionización
disminuyen
al
bajar
en
el
grupo
de
los
metales
alcalinotérreos
-‐y
en
los
alcalinos-‐
porque
aunque
la
carga
nuclear
efectiva
se
mantiene
casi
constante
al
bajar
en
el
grupo,
el
tamaño
aumenta.
Las
sumas
de
las
energías
de
ionización
correspondientes
al
primero
y
segundo
electrón
en
el
grupo
2,
son
lo
suficientemente
bajas
como
para
poder
arrancar
los
dos
electrones
más
externos
ns2,
lo
que
da
lugar
al
catión
elemental,
que
en
este
caso
es
divalente:
X2+,
con
el
cual
forman
los
metales
alcalinotérreos
compuestos
iónicos.
Las
afinidades
electrónicas
son
de
cero
o
positivas,
ya
que
tienen
completo
el
último
nivel
ns2
y
no
dan
lugar
a
aniones
elementales
(ni
moleculares)
como
es
de
esperar
en
un
metal.
La
afinidad
del
radio
no
es
conocida.
Los
puntos
de
fusión
de
los
metales
alcalinotérreos
–bastante
más
altos
que
los
de
los
alcalinos-‐
no
siguen
una
tendencia
clara,
porque
las
estructuras
en
estado
sólido
de
los
metales
son
distintas:
berilio
y
magnesio,
hexagonal
simple;
calcio
y
estroncio,
cúbica
centrada
en
las
caras
y
bario
y
radio,
cúbica
centrada
en
el
cuerpo.
Be
Mg
Ca
Sr
Ba
842
777
727
1.287
650
K
Rb
Cs
63,38
39,31
28,44
Li
Na
180,54
97,72
Puntos
de
fusión
en
grados
Celsius.
Son
más
duros
que
los
alcalinos,
aunque
su
dureza
es
variable
(el
berilio
es
muy
duro
y
quebradizo
y
el
estroncio
es
muy
maleable).
112|
CAPÍTULO
5:
METALES
ALCALINOTÉRREOS