Page 136 - A. Doadrio: Quimica Inorganica
P. 136
B
Al
Ga
In
Tl
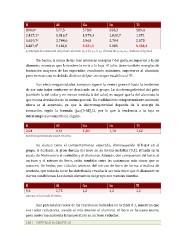
800,6a
577,5
578,8
558,3
589,4
2.427,1b
1.816,7
1.979,3
1.820,7
1.971
3.659,7c
2.744,6
2.963
2.704
2.878
6.887,4d
5.138,8
5.521,1
5.083
5.438,4
a)
Energía
de
ionización
del
primer
electrón
(I1ª);
b)
I2ª;
c)
I3ª;
d)
total
de
I1ª+I2ª+I3ª.
Valores
en
kJ/mol.
De
hecho,
la
suma
de
las
tres
primeras
energías
I
del
galio,
es
superior
a
la
del
aluminio,
mientras
que
la
tendencia
sería
a
la
baja.
El
talio,
tiene
también
energías
de
ionización
mayores
de
las
esperadas,
resultando
asimismo,
superiores
al
aluminio,
pero
en
este
caso
es
debido
al
efecto
del
par
inerte
que
estabiliza
al
Tl+.
Las
electronegatividades,
tampoco
siguen
la
norma
general
hacia
la
tendencia
de
ser
más
bajas
conforme
se
desciende
en
el
grupo.
La
electronegatividad
del
galio
(también
la
del
indio
y
en
menor
medida
la
del
talio)
es
mayor
que
la
del
aluminio,
lo
que
es
una
desviación
de
la
norma
general.
En
realidad
este
comportamiento
anómalo,
ahora
es
el
esperado,
ya
que
la
electronegatividad
depende
de
la
energía
de
ionización,
según
la
formula:
χM=(I+AE)/2,
por
lo
que
la
tendencia
a
la
baja
se
interrumpe
nuevamente
en
el
galio.
B
Al
Ga
In
Tl
1,81
1,78
1,62
2,04
1,61
Electronegatividades
según
Pauling.
La
dureza
tiene
el
comportamiento
esperado,
disminuyendo
al
bajar
en
el
grupo.
A
destacar,
la
gran
dureza
del
boro
en
su
forma
metálica
(9,3),
situada
en
la
escala
de
Mohs
entre
el
corindón
y
el
diamante.
Además,
dos
compuestos
del
boro,
el
carburo
y
el
nitruro
de
boro,
están
también
entre
las
sustancias
más
duras
que
se
conocen.
De
hecho,
por
cálculos
teóricos
del
nitruro
de
boro
de
forma
cristalina
de
wurtzita,
que
todavía
no
se
ha
sintetizado,
resultaría
ser
más
duro
que
el
diamante
en
ciertas
condiciones.
Los
demás
elementos
del
grupo
son
metales
blandos.
B
Al
Ga
In
Tl
9,3
2,75
1,5
1,2
1,2
Dureza
en
la
escala
de
Mohs.
Los
potenciales
redox
de
las
reacciones
indicadas
en
la
tabla
6.1,
muestran
que
son
todos
reductores,
siendo
el
más
intenso
el
aluminio.
El
boro
es
bastante
inerte,
pero
conforme
aumenta
la
temperatura
es
un
buen
reductor.
136|
CAPÍTULO
6:
GRUPO
13
Al
Ga
In
Tl
800,6a
577,5
578,8
558,3
589,4
2.427,1b
1.816,7
1.979,3
1.820,7
1.971
3.659,7c
2.744,6
2.963
2.704
2.878
6.887,4d
5.138,8
5.521,1
5.083
5.438,4
a)
Energía
de
ionización
del
primer
electrón
(I1ª);
b)
I2ª;
c)
I3ª;
d)
total
de
I1ª+I2ª+I3ª.
Valores
en
kJ/mol.
De
hecho,
la
suma
de
las
tres
primeras
energías
I
del
galio,
es
superior
a
la
del
aluminio,
mientras
que
la
tendencia
sería
a
la
baja.
El
talio,
tiene
también
energías
de
ionización
mayores
de
las
esperadas,
resultando
asimismo,
superiores
al
aluminio,
pero
en
este
caso
es
debido
al
efecto
del
par
inerte
que
estabiliza
al
Tl+.
Las
electronegatividades,
tampoco
siguen
la
norma
general
hacia
la
tendencia
de
ser
más
bajas
conforme
se
desciende
en
el
grupo.
La
electronegatividad
del
galio
(también
la
del
indio
y
en
menor
medida
la
del
talio)
es
mayor
que
la
del
aluminio,
lo
que
es
una
desviación
de
la
norma
general.
En
realidad
este
comportamiento
anómalo,
ahora
es
el
esperado,
ya
que
la
electronegatividad
depende
de
la
energía
de
ionización,
según
la
formula:
χM=(I+AE)/2,
por
lo
que
la
tendencia
a
la
baja
se
interrumpe
nuevamente
en
el
galio.
B
Al
Ga
In
Tl
1,81
1,78
1,62
2,04
1,61
Electronegatividades
según
Pauling.
La
dureza
tiene
el
comportamiento
esperado,
disminuyendo
al
bajar
en
el
grupo.
A
destacar,
la
gran
dureza
del
boro
en
su
forma
metálica
(9,3),
situada
en
la
escala
de
Mohs
entre
el
corindón
y
el
diamante.
Además,
dos
compuestos
del
boro,
el
carburo
y
el
nitruro
de
boro,
están
también
entre
las
sustancias
más
duras
que
se
conocen.
De
hecho,
por
cálculos
teóricos
del
nitruro
de
boro
de
forma
cristalina
de
wurtzita,
que
todavía
no
se
ha
sintetizado,
resultaría
ser
más
duro
que
el
diamante
en
ciertas
condiciones.
Los
demás
elementos
del
grupo
son
metales
blandos.
B
Al
Ga
In
Tl
9,3
2,75
1,5
1,2
1,2
Dureza
en
la
escala
de
Mohs.
Los
potenciales
redox
de
las
reacciones
indicadas
en
la
tabla
6.1,
muestran
que
son
todos
reductores,
siendo
el
más
intenso
el
aluminio.
El
boro
es
bastante
inerte,
pero
conforme
aumenta
la
temperatura
es
un
buen
reductor.
136|
CAPÍTULO
6:
GRUPO
13