Page 134 - A. Doadrio: Quimica Inorganica
P. 134
VARIACIÓN
DE
LAS
PROPIEDADES
PERIÓDICAS
En
la
tabla
6.1,
mostramos
algunos
datos
físico
químicos
de
estos
elementos.
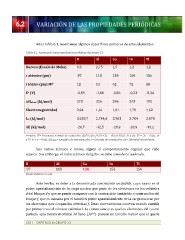
Tabla
6.1.
Algunas
de
las
propiedades
periódicas
del
grupo
13.
Ga
In
Tl
B
Al
Dureza
(Escala
de
Mohs)
9,3
2,75
1,5
1,2
1,2
r
atómico
(pm)
87
118
136
156
156
r
iónico
(pm)
M3+
12
53
62
72
88
Eo
(V)
-‐0,89
-‐1,66
-‐0,56
-‐0,23
-‐0,34
Δ Hatom
(kJ/mol)
573
326
286
243
182
Electronegatividad
2,04
1,61
1,81
1,78
1,62
I3ª
(kJ/mol)
3.659,7
2.744,6
2.963
2.704
2.878
AE
(kJ/mol)
-‐26,7
-‐42,5
-‐28,9
-‐28,9
-‐19,2
r=radio;
E0=
Potencial
normal
de
reducción:
B(OH)3(ac)+3H++3e−→B(s)+3H2O;
Al
y
Ga:
X3++
3e−→X(s);
In
y
Tl:
X++
e−→X(s);
ΔHatom=
Entalpía
de
atomización;
I=
Energía
de
ionización;
AE=
Afinidad
electrónica.
Los
radios
atómico
e
iónico,
siguen
el
comportamiento
regular
que
cabe
esperar.
Sin
embargo,
el
radio
atómico
del
galio,
se
debe
considerar
anómalo.
B
Al
Ga
In
Tl
87
118
136
156
156
Radio
atómico
en
pm.
Este
hecho,
se
debe
a
la
denominada
contracción
escándida,
cuya
causa
es
el
pobre
apantallamiento
de
la
carga
nuclear
por
parte
de
los
electrones
en
los
orbitales
d
del
bloque
d
y
que
se
puede
comparar
con
la
contracción
lantánida
o
contracción
del
bloque
f,
que
es
causada
por
el
también
pobre
apantallamiento
de
la
carga
nuclear
por
los
electrones
que
ocupan
los
orbitales
f.
Estas
contracciones
ocurren
cuando
cambia
por
primera
vez
el
número
cuántico
l.
La
consecuencia
es
que
los
elementos
del
cuarto
período
-‐que
tienen
el
orbital
3d
lleno
(3d10)-‐
poseen
un
tamaño
menor
que
el
que
le
134|
CAPÍTULO
6:
GRUPO
13
DE
LAS
PROPIEDADES
PERIÓDICAS
En
la
tabla
6.1,
mostramos
algunos
datos
físico
químicos
de
estos
elementos.
Tabla
6.1.
Algunas
de
las
propiedades
periódicas
del
grupo
13.
Ga
In
Tl
B
Al
Dureza
(Escala
de
Mohs)
9,3
2,75
1,5
1,2
1,2
r
atómico
(pm)
87
118
136
156
156
r
iónico
(pm)
M3+
12
53
62
72
88
Eo
(V)
-‐0,89
-‐1,66
-‐0,56
-‐0,23
-‐0,34
Δ Hatom
(kJ/mol)
573
326
286
243
182
Electronegatividad
2,04
1,61
1,81
1,78
1,62
I3ª
(kJ/mol)
3.659,7
2.744,6
2.963
2.704
2.878
AE
(kJ/mol)
-‐26,7
-‐42,5
-‐28,9
-‐28,9
-‐19,2
r=radio;
E0=
Potencial
normal
de
reducción:
B(OH)3(ac)+3H++3e−→B(s)+3H2O;
Al
y
Ga:
X3++
3e−→X(s);
In
y
Tl:
X++
e−→X(s);
ΔHatom=
Entalpía
de
atomización;
I=
Energía
de
ionización;
AE=
Afinidad
electrónica.
Los
radios
atómico
e
iónico,
siguen
el
comportamiento
regular
que
cabe
esperar.
Sin
embargo,
el
radio
atómico
del
galio,
se
debe
considerar
anómalo.
B
Al
Ga
In
Tl
87
118
136
156
156
Radio
atómico
en
pm.
Este
hecho,
se
debe
a
la
denominada
contracción
escándida,
cuya
causa
es
el
pobre
apantallamiento
de
la
carga
nuclear
por
parte
de
los
electrones
en
los
orbitales
d
del
bloque
d
y
que
se
puede
comparar
con
la
contracción
lantánida
o
contracción
del
bloque
f,
que
es
causada
por
el
también
pobre
apantallamiento
de
la
carga
nuclear
por
los
electrones
que
ocupan
los
orbitales
f.
Estas
contracciones
ocurren
cuando
cambia
por
primera
vez
el
número
cuántico
l.
La
consecuencia
es
que
los
elementos
del
cuarto
período
-‐que
tienen
el
orbital
3d
lleno
(3d10)-‐
poseen
un
tamaño
menor
que
el
que
le
134|
CAPÍTULO
6:
GRUPO
13