Page 23 - Anales_81_1_2015
P. 23
About the vibrational spectroscopy in the diagnosis of Alzheimer’s disease
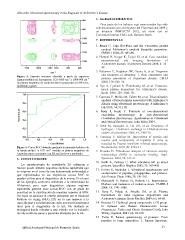
Figura 5. Espectro síncrono obtenido a partir de espectros 6. AGRADECIMIENTOS
Raman medidos en las regiones 1725-1600 cm-1 y 1000-900 cm-1
de plasma sanguíneo de controles sanos y pacientes con EA leve, Gran parte de los trabajos aquí mencionados han sido
moderada y grave. subvencionados con un proyecto del Plan Nacional 2009 y
un proyecto INNPACTO 2012, así como con un
Figura 6. Curva ROC obtenida mediante la intensidad relativa de Convenio/Contrato CSIC-Lab. Raman-Health.
la banda amida I a 1671 cm-1 medida en plasma sanguíneo de
controles sanos y pacientes con EA en fase leve y moderada. 7. REFERENCIAS
5. CONCLUSIONES
1. Haass C. Take five-Bace and the γ-secretase quartet
La espectroscopía de correlación 2D infrarroja y conduct Alzheimer’s amyloid β-peptide generation.
Raman puede detectar pequeños cambios espectrales que EMBO J 2004; 23: 483-88.
se originen en el curso de una determinada enfermedad y
que representados en sus respectivas curvas ROC se 2. Hampel H, Burger K, Teipel SJ, et al. Core candidate
puedan utilizar para el diagnóstico de la misma. Es el caso neurochemical and imaging biomarkers of
de los ejemplos anteriores referentes a la enfermedad de Alzheimer's disease. Alzheimers Dement 2008; 4: 38–
Alzheimer, para cuyo diagnóstico algunas regiones 48.
espectrales generan unas curvas ROC con un grado de
exactitud en la clasificación de muestras superior al 80%. 3. Patterson C, Feightner JW, Garcia A, et al. Diagnosis
Por tanto se satisface el criterio propuesto por el National and treatment of dementia: 1. Risk assessment and
Institute on Aging (NIA) (25) en lo que respecta a la primary prevention of Alzheimer disease. CMAJ
especificidad y sensibilidad que debe tener un biomarcador 2008; 178: 548–56.
ideal para el diagnóstico de la EA. No obstante se
proseguirá dando robustez a este método con la inclusión 4. Hye A, Lynham S, Thambisetty M, et al. Proteome-
de más controles sanos y pacientes afectados por la EA. based plasma biomarkers for Alzheimer's disease.
Brain 2006; 129: 3042–50.
5. Carmona P, Molina M, Calero M, et al. Discrimination
analysis of blood plasma associated with Alzheimer’s
disease using vibrational spectroscopy. J Alzheimer’s
Dis 2013; 34, 911-20.
6. Noda I, Ozaki Y. Principle of two-dimensional
correlation spectroscopy. In Two-dimensional
Correlation Spectroscopy. A pplications in V ibrational
and Optical Spectroscopy, John Wiley 2004.
7. Ortiz M, Sanoguel Z, Hu HT, et al. Dynamics of
hydrogen - Deuterium exchange in Chlamydomonas
centrin. Biochemistry 2005; 44, 2409-18.
8. Carmona P, Molina M. Interactions of protein and
nucleic acid components of hepatitis C virus as
revealed by Fourier transform infrared spectroscopy.
Biochemistry 2010; 49: 4724-31.
9. Pivonka D. Vibrational analysis of structure activity
relationships (SAR) in molecular binding. Appl.
Spectrosc. 2004; 58: 323-31.
10. Barth A, Zscherp C. What vibrations tell us about
proteins. Quart Rev Biophys 2002; 35: 369-430.
11. Krimm S, Bandekar J. Vibrational spectroscopy and
conformation of peptides, polypeptides, and proteins.
Adv Protein Chem 1986; 38: 181-363.
12. Montuschi P, Barnes PJ, Roberts LJ. Isoprostanes:
Markers and mediators of oxidative stress. FASEB J
2004; 18: 1791-1800.
13. Song F, Poljak A, Smythe GA, et al. Plasma
biomarkers for mild cognitive impairment and
Alzheimer’s disease. Brain Res Rev 2009; 61; 69-80.
14. Socrates G. Hydroxyl group compounds: O-H group.
In Infrared and Raman Characteristic Group
Frequencies: Tables and Charts. Socrates G (ed), John
Willey, England, 2001: pp. 94-100.
15. Tuma R. Raman spectroscopy of proteins: From
peptides to large assemblies. J. Raman Spectrosc.
@Real Academia Nacional de Farmacia. Spain 23
Figura 5. Espectro síncrono obtenido a partir de espectros 6. AGRADECIMIENTOS
Raman medidos en las regiones 1725-1600 cm-1 y 1000-900 cm-1
de plasma sanguíneo de controles sanos y pacientes con EA leve, Gran parte de los trabajos aquí mencionados han sido
moderada y grave. subvencionados con un proyecto del Plan Nacional 2009 y
un proyecto INNPACTO 2012, así como con un
Figura 6. Curva ROC obtenida mediante la intensidad relativa de Convenio/Contrato CSIC-Lab. Raman-Health.
la banda amida I a 1671 cm-1 medida en plasma sanguíneo de
controles sanos y pacientes con EA en fase leve y moderada. 7. REFERENCIAS
5. CONCLUSIONES
1. Haass C. Take five-Bace and the γ-secretase quartet
La espectroscopía de correlación 2D infrarroja y conduct Alzheimer’s amyloid β-peptide generation.
Raman puede detectar pequeños cambios espectrales que EMBO J 2004; 23: 483-88.
se originen en el curso de una determinada enfermedad y
que representados en sus respectivas curvas ROC se 2. Hampel H, Burger K, Teipel SJ, et al. Core candidate
puedan utilizar para el diagnóstico de la misma. Es el caso neurochemical and imaging biomarkers of
de los ejemplos anteriores referentes a la enfermedad de Alzheimer's disease. Alzheimers Dement 2008; 4: 38–
Alzheimer, para cuyo diagnóstico algunas regiones 48.
espectrales generan unas curvas ROC con un grado de
exactitud en la clasificación de muestras superior al 80%. 3. Patterson C, Feightner JW, Garcia A, et al. Diagnosis
Por tanto se satisface el criterio propuesto por el National and treatment of dementia: 1. Risk assessment and
Institute on Aging (NIA) (25) en lo que respecta a la primary prevention of Alzheimer disease. CMAJ
especificidad y sensibilidad que debe tener un biomarcador 2008; 178: 548–56.
ideal para el diagnóstico de la EA. No obstante se
proseguirá dando robustez a este método con la inclusión 4. Hye A, Lynham S, Thambisetty M, et al. Proteome-
de más controles sanos y pacientes afectados por la EA. based plasma biomarkers for Alzheimer's disease.
Brain 2006; 129: 3042–50.
5. Carmona P, Molina M, Calero M, et al. Discrimination
analysis of blood plasma associated with Alzheimer’s
disease using vibrational spectroscopy. J Alzheimer’s
Dis 2013; 34, 911-20.
6. Noda I, Ozaki Y. Principle of two-dimensional
correlation spectroscopy. In Two-dimensional
Correlation Spectroscopy. A pplications in V ibrational
and Optical Spectroscopy, John Wiley 2004.
7. Ortiz M, Sanoguel Z, Hu HT, et al. Dynamics of
hydrogen - Deuterium exchange in Chlamydomonas
centrin. Biochemistry 2005; 44, 2409-18.
8. Carmona P, Molina M. Interactions of protein and
nucleic acid components of hepatitis C virus as
revealed by Fourier transform infrared spectroscopy.
Biochemistry 2010; 49: 4724-31.
9. Pivonka D. Vibrational analysis of structure activity
relationships (SAR) in molecular binding. Appl.
Spectrosc. 2004; 58: 323-31.
10. Barth A, Zscherp C. What vibrations tell us about
proteins. Quart Rev Biophys 2002; 35: 369-430.
11. Krimm S, Bandekar J. Vibrational spectroscopy and
conformation of peptides, polypeptides, and proteins.
Adv Protein Chem 1986; 38: 181-363.
12. Montuschi P, Barnes PJ, Roberts LJ. Isoprostanes:
Markers and mediators of oxidative stress. FASEB J
2004; 18: 1791-1800.
13. Song F, Poljak A, Smythe GA, et al. Plasma
biomarkers for mild cognitive impairment and
Alzheimer’s disease. Brain Res Rev 2009; 61; 69-80.
14. Socrates G. Hydroxyl group compounds: O-H group.
In Infrared and Raman Characteristic Group
Frequencies: Tables and Charts. Socrates G (ed), John
Willey, England, 2001: pp. 94-100.
15. Tuma R. Raman spectroscopy of proteins: From
peptides to large assemblies. J. Raman Spectrosc.
@Real Academia Nacional de Farmacia. Spain 23