Page 13 - Anales_81_1_2015
P. 13
New concepts on the functionality of the nervous system modulación de características especiales parece ser el
Y esto ocurre también en la involución del SNC (tanto en mediatizado por factores neurotróficos que activan receptores
la senilidad fisiológica como en la patológica/enfermedad para neurotrofinas (Rft). Las vías de señalización intracelular
de Alzheimer y en todas las situaciones patológicas de para factores neurotróficos incluyen activación de genes
cualquier etiología (trauma, enfermedades tóxicas e nucleares, lo mismo que muchas vías intracelulares para
infecciosas, enfermedades neurodegenerativas no cito/quimioquinas).
Alzheimer, etc).
Simultáneamente, en estas situaciones de lesión,
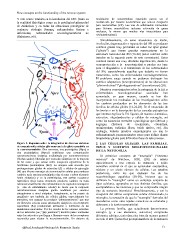
Figura 3. Esquema sobre la integración de diversos sistemas involución, degeneración o reparación del SN se producen
de comunicación celular glio-neuronal y la gliotransmisión en cambios gliales muy profundos en todos los tipos gliales
la neurotransmisión. Dos neuronas, una presináptica (Npre) y (“gliosis”) que tienen grandes repercusiones en la
otra postsináptica (Npost) establecen una comunicación estructura funcional del SN (16-22) (estos cambios serán
neurotransmisora sináptica mediatizada por neurotrnasmisores tratados en la segunda parte de este comentario). Estos
(flechas azules) liberadas por vesículas sinápticas en la mayoría cambios tienen una muy diferente significación, desde la
de las casos y que actúan sobre receptores específicos de la neuroprotección a la neurotoxicidad y pueden ser base
membrana psotsináptica (Rnt). La sinapsis está envuelta por para el diagnóstico o el tratamiento de las enfermedades
prolongaciones gliales de astrocitos (A) y células de microglia del SN, especialmente aquellas que todavía no tienen
(M) que liberan mensajes de comunicación celular que producen tratamiento, como las enfermedades neurodegenerativas.
cambios en la neurona presináptica (en el soma o sobre el propio El problema surge cuando no podemos distinguir los
botón sináptico) y en la postsinápica, tras activar receptores cambios adaptativos (neuroprotectores) de las alteraciones
específicos (Rq). Estos receptores producen cambios en estas “glioinvolutivas”/”gliodegenerativas” (neurotóxicas) (28).
neuronas al activar las vías intracelulares de segundos mensajeros
(o vías de señalamiento celular) de modo que la respuesta Nuestros conocimientos sobre la patogenia de la EA y
neurotransmisora sináptica queda modulada por cambios enfermedades neurodegenerativas asociadas han
citoquímicos a nivel sináptico. Actualmente, se ha puesto de aumentado, en gran manera, cuando se han ido
manifiesto que también las células gliales, especialmente los incorporando los resultados de las investigaciones sobre
astrocitos, son capaces de producir “gliotransmisores” que tras los cambios producidos en los elementos de las tres
ser liberados activan zonas neuronales sinápticos con receptores familias de células gliales (16-22,28). En el enunciado de
específicos (Rq) produciendo activación o inhibición de las las teorías o en la descripción de las cascadas patogénicas
membranas neuronales. Por los canales de las uniones estrechas que intentan explicar la EA figuran, de manera sistemática,
de los astrocitos (ue; “gap junctions”) también pasan moléculas astrocitos, oligodendrocitos y células de microglia, así
entre los astrocitos que llegan a liberarse cerca de los receptores como las sustancias normales o patológicas que fabrican y
neuronales para afectar la neurotransmisión. Un sistema de segregan (factores de crecimiento, citoquinas,
quimioquinas, radicales libres, óxido nítrico, etc). Sin
@Real Academia Nacional de Farmacia. Spain embargo, todavía nuestros conocimientos no son lo
suficientemente pormenorizados como para definir dianas
terapéuticas gliales para diferentes fases de este proceso.
2. LAS CÉLULAS GLIALES. LAS FAMILIAS,
TIPOS Y SUBTIPOS MORFOFUNCIONALES
DE LA NEUROGLIA
El primitivo concepto de “neuroglia” (“cemento
nervioso” de Wirchow, 1858, (29)) se refería
especialmente a una especie de sustancia o tejido
conectivo cerebral en el que se apreciaban corpúsculos,
núcleos y un cierto número de células. Los estudios
posteriores, entre los que destacan los de los
neurohistólogos españoles (30-38), hicieron que se
definiera la “neuroglia” como un complejo conjunto de
tipos celulares, agrupados en tres distintas familias, que
acompañaban a las neuronas y que no comprendía ningún
tipo de sustancia intersticial. Simultáneamente, y con la
excepción del último componente celular diferenciado, la
microglia, la sensación de que la “neuroglia” derivaba del
mesodermo como otros tejidos conectivos se esfumaba y
daba paso a la teoría neuroepitelial.
La primera familia, que actualmente denominamos
astroglia (y a sus elementos, astrocitos) comprende
diferentes subtipos, tanto descritos bien de manera general
en todo el SNC (astrocitos protoplasmáticos de la sustancia
13
Y esto ocurre también en la involución del SNC (tanto en mediatizado por factores neurotróficos que activan receptores
la senilidad fisiológica como en la patológica/enfermedad para neurotrofinas (Rft). Las vías de señalización intracelular
de Alzheimer y en todas las situaciones patológicas de para factores neurotróficos incluyen activación de genes
cualquier etiología (trauma, enfermedades tóxicas e nucleares, lo mismo que muchas vías intracelulares para
infecciosas, enfermedades neurodegenerativas no cito/quimioquinas).
Alzheimer, etc).
Simultáneamente, en estas situaciones de lesión,
Figura 3. Esquema sobre la integración de diversos sistemas involución, degeneración o reparación del SN se producen
de comunicación celular glio-neuronal y la gliotransmisión en cambios gliales muy profundos en todos los tipos gliales
la neurotransmisión. Dos neuronas, una presináptica (Npre) y (“gliosis”) que tienen grandes repercusiones en la
otra postsináptica (Npost) establecen una comunicación estructura funcional del SN (16-22) (estos cambios serán
neurotransmisora sináptica mediatizada por neurotrnasmisores tratados en la segunda parte de este comentario). Estos
(flechas azules) liberadas por vesículas sinápticas en la mayoría cambios tienen una muy diferente significación, desde la
de las casos y que actúan sobre receptores específicos de la neuroprotección a la neurotoxicidad y pueden ser base
membrana psotsináptica (Rnt). La sinapsis está envuelta por para el diagnóstico o el tratamiento de las enfermedades
prolongaciones gliales de astrocitos (A) y células de microglia del SN, especialmente aquellas que todavía no tienen
(M) que liberan mensajes de comunicación celular que producen tratamiento, como las enfermedades neurodegenerativas.
cambios en la neurona presináptica (en el soma o sobre el propio El problema surge cuando no podemos distinguir los
botón sináptico) y en la postsinápica, tras activar receptores cambios adaptativos (neuroprotectores) de las alteraciones
específicos (Rq). Estos receptores producen cambios en estas “glioinvolutivas”/”gliodegenerativas” (neurotóxicas) (28).
neuronas al activar las vías intracelulares de segundos mensajeros
(o vías de señalamiento celular) de modo que la respuesta Nuestros conocimientos sobre la patogenia de la EA y
neurotransmisora sináptica queda modulada por cambios enfermedades neurodegenerativas asociadas han
citoquímicos a nivel sináptico. Actualmente, se ha puesto de aumentado, en gran manera, cuando se han ido
manifiesto que también las células gliales, especialmente los incorporando los resultados de las investigaciones sobre
astrocitos, son capaces de producir “gliotransmisores” que tras los cambios producidos en los elementos de las tres
ser liberados activan zonas neuronales sinápticos con receptores familias de células gliales (16-22,28). En el enunciado de
específicos (Rq) produciendo activación o inhibición de las las teorías o en la descripción de las cascadas patogénicas
membranas neuronales. Por los canales de las uniones estrechas que intentan explicar la EA figuran, de manera sistemática,
de los astrocitos (ue; “gap junctions”) también pasan moléculas astrocitos, oligodendrocitos y células de microglia, así
entre los astrocitos que llegan a liberarse cerca de los receptores como las sustancias normales o patológicas que fabrican y
neuronales para afectar la neurotransmisión. Un sistema de segregan (factores de crecimiento, citoquinas,
quimioquinas, radicales libres, óxido nítrico, etc). Sin
@Real Academia Nacional de Farmacia. Spain embargo, todavía nuestros conocimientos no son lo
suficientemente pormenorizados como para definir dianas
terapéuticas gliales para diferentes fases de este proceso.
2. LAS CÉLULAS GLIALES. LAS FAMILIAS,
TIPOS Y SUBTIPOS MORFOFUNCIONALES
DE LA NEUROGLIA
El primitivo concepto de “neuroglia” (“cemento
nervioso” de Wirchow, 1858, (29)) se refería
especialmente a una especie de sustancia o tejido
conectivo cerebral en el que se apreciaban corpúsculos,
núcleos y un cierto número de células. Los estudios
posteriores, entre los que destacan los de los
neurohistólogos españoles (30-38), hicieron que se
definiera la “neuroglia” como un complejo conjunto de
tipos celulares, agrupados en tres distintas familias, que
acompañaban a las neuronas y que no comprendía ningún
tipo de sustancia intersticial. Simultáneamente, y con la
excepción del último componente celular diferenciado, la
microglia, la sensación de que la “neuroglia” derivaba del
mesodermo como otros tejidos conectivos se esfumaba y
daba paso a la teoría neuroepitelial.
La primera familia, que actualmente denominamos
astroglia (y a sus elementos, astrocitos) comprende
diferentes subtipos, tanto descritos bien de manera general
en todo el SNC (astrocitos protoplasmáticos de la sustancia
13