Page 78 - A. Doadrio: Quimica Inorganica
P. 78
VARIACIÓN
DE
LAS
PROPIEDADES
PERIÓDICAS
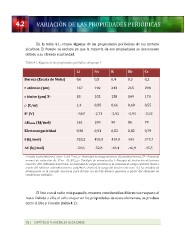
En
la
tabla
4.1,
vemos
algunas
de
las
propiedades
periódicas
de
los
metales
alcalinos.
El
francio
se
excluye
ya
que
la
mayoría
de
sus
propiedades
se
desconocen
debido
a
su
elevada
reactividad.
Tabla
4.1.
Algunas
de
las
propiedades
periódicas
del
grupo
1.
Li
Na
K
Rb
Cs
Dureza
(Escala
de
Mohs)
0,6
0,5
0,4
0,3
0,2
r
atómico
(pm)
167
190
243
265
298
r
iónico
(pm)
X+
58
102
138
149
170
ρ
(C/m)
1,4
0,88
0,66
0,60
0,55
Eo
(V)
-‐3,05
-‐2,71
-‐2,92
-‐2,93
-‐2,92
Δ Hatom
(kJ/mol)
161
109
90
86
79
Electronegatividad
0,98
0,93
0,82
0,82
0,79
I
(kJ/mol)
520,2
495,8
418,8
403
375,7
AE
(kJ/mol)
-‐59,6
-‐52,8
-‐48,4
-‐46,9
-‐45,5
r=radio
en
picómetros
(1
pm=
1x10-‐12
m);
ρ=
Densidad
de
carga
eléctrica
(Culombio/metro);
E0=
Potencial
normal
de
reducción
de:
X++e-‐→X;
ΔHatom=
Entalpía
de
atomización;
I=Energía
de
ionización
del
primer
electrón;
AE=
Afinidad
electrónica.
La
densidad
de
carga
eléctrica
es
la
cantidad
de
carga
eléctrica
lineal
a
través
del
radio
en
culombios/metro.
ρ=Q/4πr3,
siendo
Q
la
carga
del
ion
(en
este
caso
+1).
La
entalpía
de
atomización
es
la
energía
necesaria
para
formar
un
mol
de
átomos
gaseosos
a
partir
del
elemento
en
condiciones
estándar.
El
litio
con
el
radio
más
pequeño,
muestra
considerables
diferencias
respecto
al
resto.
Debido
a
ello,
el
salto
mayor
en
las
propiedades
de
estos
elementos,
se
produce
entre
el
litio
y
el
sodio
(tabla
4.1).
78|
CAPÍTULO
4:
METALES
ALCALINOS
DE
LAS
PROPIEDADES
PERIÓDICAS
En
la
tabla
4.1,
vemos
algunas
de
las
propiedades
periódicas
de
los
metales
alcalinos.
El
francio
se
excluye
ya
que
la
mayoría
de
sus
propiedades
se
desconocen
debido
a
su
elevada
reactividad.
Tabla
4.1.
Algunas
de
las
propiedades
periódicas
del
grupo
1.
Li
Na
K
Rb
Cs
Dureza
(Escala
de
Mohs)
0,6
0,5
0,4
0,3
0,2
r
atómico
(pm)
167
190
243
265
298
r
iónico
(pm)
X+
58
102
138
149
170
ρ
(C/m)
1,4
0,88
0,66
0,60
0,55
Eo
(V)
-‐3,05
-‐2,71
-‐2,92
-‐2,93
-‐2,92
Δ Hatom
(kJ/mol)
161
109
90
86
79
Electronegatividad
0,98
0,93
0,82
0,82
0,79
I
(kJ/mol)
520,2
495,8
418,8
403
375,7
AE
(kJ/mol)
-‐59,6
-‐52,8
-‐48,4
-‐46,9
-‐45,5
r=radio
en
picómetros
(1
pm=
1x10-‐12
m);
ρ=
Densidad
de
carga
eléctrica
(Culombio/metro);
E0=
Potencial
normal
de
reducción
de:
X++e-‐→X;
ΔHatom=
Entalpía
de
atomización;
I=Energía
de
ionización
del
primer
electrón;
AE=
Afinidad
electrónica.
La
densidad
de
carga
eléctrica
es
la
cantidad
de
carga
eléctrica
lineal
a
través
del
radio
en
culombios/metro.
ρ=Q/4πr3,
siendo
Q
la
carga
del
ion
(en
este
caso
+1).
La
entalpía
de
atomización
es
la
energía
necesaria
para
formar
un
mol
de
átomos
gaseosos
a
partir
del
elemento
en
condiciones
estándar.
El
litio
con
el
radio
más
pequeño,
muestra
considerables
diferencias
respecto
al
resto.
Debido
a
ello,
el
salto
mayor
en
las
propiedades
de
estos
elementos,
se
produce
entre
el
litio
y
el
sodio
(tabla
4.1).
78|
CAPÍTULO
4:
METALES
ALCALINOS