Page 165 - A. Doadrio: Quimica Inorganica
P. 165
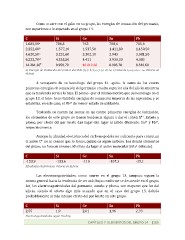
Como
ocurre
con
el
galio
en
su
grupo,
las
energías
de
ionización
del
germanio,
son
superiores
a
lo
esperado
en
el
grupo
14.
C
Si
Ge
Sn
Pb
1.085,50a
786,5
762
708,6
715,6
2.352,60b
1.577,10
1.537,50
1.411,80
1.450,50
4.620,50c
3.231,60
3.302,10
2.943
3.081,50
6.222,70d
4.355,50
4.411
3.930,30
4.083
14.281,30e
9.950,70
10.012,60
8.993,70
9.330,60
a)
Energía
de
ionización
del
primer
electrón
(I1ª);
b)
I2ª;
c)
I3ª;
d)
I4ª;
e)
total
de
I1ª+I2ª+I3ª
+
I4ª.
Valores
en
kJ/mol.
A
semejanza
de
su
homólogo
del
grupo
13
–galio-‐
la
suma
de
las
cuatro
primeras
energías
de
ionización
del
germanio
resulta
superior
a
la
del
silicio,
mientras
que
la
tendencia
sería
a
la
baja.
El
plomo
–por
el
mismo
motivo
que
su
homólogo
en
el
grupo
13,
el
talio-‐
tiene
también
energías
de
ionización
mayores
de
las
esperadas,
y
se
estabiliza,
en
este
caso,
el
Pb2+
de
menor
estado
de
oxidación.
Teniendo
en
cuenta
las
sumas
de
las
cuatro
primeras
energías
de
ionización,
los
elementos
de
este
grupo
no
tienen
tendencia
alguna
a
dar
el
catión
X4+.
Estaño
y
plomo,
por
efecto
del
par
inerte
dan
lugar
dan
lugar
al
catión
divalente:
Sn2+
y
Pb2+,
respectivamente.
Aunque
la
afinidad
electrónica
del
carbono
podría
ser
suficiente
para
constituir
el
anión
C4-‐
no
se
conoce
que
lo
forme,
quizás
en
algún
carburo.
Los
demás
elementos
del
grupo,
no
forman
aniones.
El
silicio
da
lugar
al
anión
molecular
SiO42-‐
(silicato).
C
Si
Ge
Sn
Pb
-‐119
-‐107,3
-‐35,1
-‐153,9
-‐133,6
Afinidades
electrónicas.
Valores
en
kJ/mol.
Las
electronegatividades,
como
ocurre
en
el
grupo
13,
tampoco
siguen
la
norma
general
hacia
la
tendencia
de
ser
más
bajas
conforme
se
desciende
en
el
grupo.
Así,
las
electronegatividades
del
germanio,
estaño
y
plomo,
son
mayores
que
las
del
silicio,
siendo
el
efecto
algo
más
acusado
que
en
el
caso
del
grupo
13,
debido
probablemente
al
más
intenso
efecto
del
par
inerte
en
este
grupo.
C
Si
Ge
Sn
Pb
2,01
1,96
2,33
2,55
1,9
Electronegatividades
según
Pauling.
CAPÍTULO
7:
ELEMENTOS
DEL
GRUPO
14
|165
ocurre
con
el
galio
en
su
grupo,
las
energías
de
ionización
del
germanio,
son
superiores
a
lo
esperado
en
el
grupo
14.
C
Si
Ge
Sn
Pb
1.085,50a
786,5
762
708,6
715,6
2.352,60b
1.577,10
1.537,50
1.411,80
1.450,50
4.620,50c
3.231,60
3.302,10
2.943
3.081,50
6.222,70d
4.355,50
4.411
3.930,30
4.083
14.281,30e
9.950,70
10.012,60
8.993,70
9.330,60
a)
Energía
de
ionización
del
primer
electrón
(I1ª);
b)
I2ª;
c)
I3ª;
d)
I4ª;
e)
total
de
I1ª+I2ª+I3ª
+
I4ª.
Valores
en
kJ/mol.
A
semejanza
de
su
homólogo
del
grupo
13
–galio-‐
la
suma
de
las
cuatro
primeras
energías
de
ionización
del
germanio
resulta
superior
a
la
del
silicio,
mientras
que
la
tendencia
sería
a
la
baja.
El
plomo
–por
el
mismo
motivo
que
su
homólogo
en
el
grupo
13,
el
talio-‐
tiene
también
energías
de
ionización
mayores
de
las
esperadas,
y
se
estabiliza,
en
este
caso,
el
Pb2+
de
menor
estado
de
oxidación.
Teniendo
en
cuenta
las
sumas
de
las
cuatro
primeras
energías
de
ionización,
los
elementos
de
este
grupo
no
tienen
tendencia
alguna
a
dar
el
catión
X4+.
Estaño
y
plomo,
por
efecto
del
par
inerte
dan
lugar
dan
lugar
al
catión
divalente:
Sn2+
y
Pb2+,
respectivamente.
Aunque
la
afinidad
electrónica
del
carbono
podría
ser
suficiente
para
constituir
el
anión
C4-‐
no
se
conoce
que
lo
forme,
quizás
en
algún
carburo.
Los
demás
elementos
del
grupo,
no
forman
aniones.
El
silicio
da
lugar
al
anión
molecular
SiO42-‐
(silicato).
C
Si
Ge
Sn
Pb
-‐119
-‐107,3
-‐35,1
-‐153,9
-‐133,6
Afinidades
electrónicas.
Valores
en
kJ/mol.
Las
electronegatividades,
como
ocurre
en
el
grupo
13,
tampoco
siguen
la
norma
general
hacia
la
tendencia
de
ser
más
bajas
conforme
se
desciende
en
el
grupo.
Así,
las
electronegatividades
del
germanio,
estaño
y
plomo,
son
mayores
que
las
del
silicio,
siendo
el
efecto
algo
más
acusado
que
en
el
caso
del
grupo
13,
debido
probablemente
al
más
intenso
efecto
del
par
inerte
en
este
grupo.
C
Si
Ge
Sn
Pb
2,01
1,96
2,33
2,55
1,9
Electronegatividades
según
Pauling.
CAPÍTULO
7:
ELEMENTOS
DEL
GRUPO
14
|165