Page 164 - A. Doadrio: Quimica Inorganica
P. 164
VARIACIÓN
DE
LAS
PROPIEDADES
PERIÓDICAS
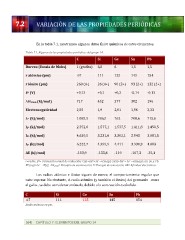
En
la
tabla
7.1,
mostramos
algunos
datos
físico
químicos
de
estos
elementos.
Tabla
7.1.
Algunas
de
las
propiedades
periódicas
del
grupo
14.
Ge
Sn
Pb
6
1,5
1,5
C
Si
Dureza
(Escala
de
Mohs)
1
(grafito)
6,5
r
atómico
(pm)
67
111
125
145
154
r
iónico
(pm)
260
(4-‐)
26
(4+)
90
(2+)
93
(2+)
132
(2+)
Eo
(V)
+0,13
+0,1
+0,2
-‐0,14
-‐0,13
Δ Hatom
(kJ/mol)
717
452
377
302
196
Electronegatividad
2,55
1,9
2,01
1,96
2,33
I1ª
(kJ/mol)
1.085,5
786,5
762
708,6
715,6
I2ª
(kJ/mol)
2.352,6
I3ª
(kJ/mol)
4.620,5
1.577,1
1.537,5
1.411,8
1.450,5
I4ª
(kJ/mol)
6.222,7
AE
(kJ/mol)
-‐153,9
3.231,6
3.302,1
2.943
3.081,5
4.355,5
4.411
3.930,3
4.083
-‐133,6
-‐119
-‐107,3
-‐35,1
r=radio;
E0=
Potencial
normal
de
reducción:
C(s)+4H++4e−→CH4(g);
Si(s)+4H++
4e−→SiH4(g);
Ge,
Sn
y
Pb:
X2+(aq)+2e−→X(s);
ΔHatom=
Entalpía
de
atomización;
I=
Energía
de
ionización;
AE=
Afinidad
electrónica.
Los
radios
atómico
e
iónico
siguen
de
nuevo,
el
comportamiento
regular
que
cabe
esperar.
No
obstante,
el
radio
atómico
(y
también
el
iónico)
del
germanio
–como
el
galio-‐,
se
debe
considerar
anómalo,
debido
a
la
contracción
escándida.
C
Si
Ge
Sn
Pb
67
111
125
145
154
Radio
atómico
en
pm.
164|
CAPÍTULO
7:
ELEMENTOS
DEL
GRUPO
14
DE
LAS
PROPIEDADES
PERIÓDICAS
En
la
tabla
7.1,
mostramos
algunos
datos
físico
químicos
de
estos
elementos.
Tabla
7.1.
Algunas
de
las
propiedades
periódicas
del
grupo
14.
Ge
Sn
Pb
6
1,5
1,5
C
Si
Dureza
(Escala
de
Mohs)
1
(grafito)
6,5
r
atómico
(pm)
67
111
125
145
154
r
iónico
(pm)
260
(4-‐)
26
(4+)
90
(2+)
93
(2+)
132
(2+)
Eo
(V)
+0,13
+0,1
+0,2
-‐0,14
-‐0,13
Δ Hatom
(kJ/mol)
717
452
377
302
196
Electronegatividad
2,55
1,9
2,01
1,96
2,33
I1ª
(kJ/mol)
1.085,5
786,5
762
708,6
715,6
I2ª
(kJ/mol)
2.352,6
I3ª
(kJ/mol)
4.620,5
1.577,1
1.537,5
1.411,8
1.450,5
I4ª
(kJ/mol)
6.222,7
AE
(kJ/mol)
-‐153,9
3.231,6
3.302,1
2.943
3.081,5
4.355,5
4.411
3.930,3
4.083
-‐133,6
-‐119
-‐107,3
-‐35,1
r=radio;
E0=
Potencial
normal
de
reducción:
C(s)+4H++4e−→CH4(g);
Si(s)+4H++
4e−→SiH4(g);
Ge,
Sn
y
Pb:
X2+(aq)+2e−→X(s);
ΔHatom=
Entalpía
de
atomización;
I=
Energía
de
ionización;
AE=
Afinidad
electrónica.
Los
radios
atómico
e
iónico
siguen
de
nuevo,
el
comportamiento
regular
que
cabe
esperar.
No
obstante,
el
radio
atómico
(y
también
el
iónico)
del
germanio
–como
el
galio-‐,
se
debe
considerar
anómalo,
debido
a
la
contracción
escándida.
C
Si
Ge
Sn
Pb
67
111
125
145
154
Radio
atómico
en
pm.
164|
CAPÍTULO
7:
ELEMENTOS
DEL
GRUPO
14