Page 29 - A. Doadrio: Quimica Inorganica
P. 29
CARACTERÍSTICAS
GENERALES
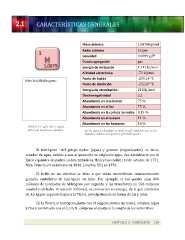
Masa
atómica
1,00794
g/mol
Radio
atómico
53
pm
00orbital:hidrogeno
Densidad
0,0899
g/l*
Orbital
1s1:
giro
del
e-‐
según
Bohr
y
la
mecánica
cuántica
Estado
agregación
gas
Energía
de
ionización
1.312
kJ/mol
Afinidad
electrónica
-‐73
kJ/mol
Punto
de
fusión
-‐259,14
°C
Punto
de
ebullición
-‐252,87
°C
Energía
de
atomización
218
kJ/mol
Electronegatividad
2,2
Abundancia
en
el
universo
75
%
Abundancia
en
el
Sol
75
%
Abundancia
en
la
corteza
terrestre
0,15
%
Abundancia
en
el
océano
11
%
Abundancia
en
los
humanos
10
%
En
los
gases
la
densidad
se
mide
en
g/l,
mientras
que
en
los
líquidos
y
sólidos
es
en
g/cm3.
1
g/l=
0,001
g/cm3.
El
hidrógeno
–del
griego
hydor
(agua)
y
gennao
(engendrador),
es
decir,
creador
de
agua,
debido
a
que
al
quemarlo
se
originaba
agua-‐
fue
descubierto
por
el
físico
y
químico
de
padres
nobles
británicos,
Henry
Cavendish
(10
de
octubre
de
1731,
Niza,
Francia-‐24
de
febrero
de
1810,
Londres,
UK)
en
1776.
El
brillo
de
las
estrellas
se
debe
a
que
están
convirtiendo
constantemente
grandes
cantidades
de
hidrógeno
en
helio.
Por
ejemplo,
el
Sol
quema
unas
600
millones
de
toneladas
de
hidrógeno
por
segundo
y
las
transforma
en
596
millones
toneladas
de
helio.
El
resto
(4
millones),
se
convierten
en
energía,
de
la
que
alrededor
de
1,5
kg
por
segundo
llegan
a
la
Tierra,
principalmente
en
forma
de
luz
y
calor.
En
la
Tierra,
el
hidrógeno,
junto
con
el
oxígeno,
forma
las
nubes,
océanos,
lagos
y
ríos
y
combinado
con
el
C,
O
y
N,
compone
el
cuerpo
y
la
sangre
de
los
seres
vivos.
CAPÍTULO
2:
HIDRÓGENO
|29
GENERALES
Masa
atómica
1,00794
g/mol
Radio
atómico
53
pm
00orbital:hidrogeno
Densidad
0,0899
g/l*
Orbital
1s1:
giro
del
e-‐
según
Bohr
y
la
mecánica
cuántica
Estado
agregación
gas
Energía
de
ionización
1.312
kJ/mol
Afinidad
electrónica
-‐73
kJ/mol
Punto
de
fusión
-‐259,14
°C
Punto
de
ebullición
-‐252,87
°C
Energía
de
atomización
218
kJ/mol
Electronegatividad
2,2
Abundancia
en
el
universo
75
%
Abundancia
en
el
Sol
75
%
Abundancia
en
la
corteza
terrestre
0,15
%
Abundancia
en
el
océano
11
%
Abundancia
en
los
humanos
10
%
En
los
gases
la
densidad
se
mide
en
g/l,
mientras
que
en
los
líquidos
y
sólidos
es
en
g/cm3.
1
g/l=
0,001
g/cm3.
El
hidrógeno
–del
griego
hydor
(agua)
y
gennao
(engendrador),
es
decir,
creador
de
agua,
debido
a
que
al
quemarlo
se
originaba
agua-‐
fue
descubierto
por
el
físico
y
químico
de
padres
nobles
británicos,
Henry
Cavendish
(10
de
octubre
de
1731,
Niza,
Francia-‐24
de
febrero
de
1810,
Londres,
UK)
en
1776.
El
brillo
de
las
estrellas
se
debe
a
que
están
convirtiendo
constantemente
grandes
cantidades
de
hidrógeno
en
helio.
Por
ejemplo,
el
Sol
quema
unas
600
millones
de
toneladas
de
hidrógeno
por
segundo
y
las
transforma
en
596
millones
toneladas
de
helio.
El
resto
(4
millones),
se
convierten
en
energía,
de
la
que
alrededor
de
1,5
kg
por
segundo
llegan
a
la
Tierra,
principalmente
en
forma
de
luz
y
calor.
En
la
Tierra,
el
hidrógeno,
junto
con
el
oxígeno,
forma
las
nubes,
océanos,
lagos
y
ríos
y
combinado
con
el
C,
O
y
N,
compone
el
cuerpo
y
la
sangre
de
los
seres
vivos.
CAPÍTULO
2:
HIDRÓGENO
|29