REVISIÓN |
Nanoterapias oncológicas: aplicaciones actuales y perspectivas futuras
In Memoriam - Profesor José Luis Vila Jato
Giovanna Lollo, Gustavo Rivera-Rodriguez, Dolores Torres, Maria José Alonso
Departamento de Farmacia y Tecnología Farmacéutica, Facultad de Farmacia, Campus Vida, Universidade de Santiago de Compostela.
Recibido el 12 de noviembre de 2011.
e-mail:mariaj.alonso@usc.es
RESUMEN
La aplicación de la nanotecnología en la terapia del cáncer ha despertado gran interés en los últimos aĖos. Ello se debe a que la nanotecnología aporta soluciones encaminadas en general a mejorar la eficacia y reducir la toxicidad de los tratamientos oncológicos. En este artículo, se resumen los avances más significativos en el diseĖo y desarrollo de nanomedicamentos oncológicos en sus diversas presentaciones, como son los liposomas, las nanopartículas, las micelas poliméricas y los conjugados. Además, se destacan algunas de las nuevas estrategias adoptadas en el tratamiento del cáncer tales como la terapia génica, la terapia fotodinámica y el llamado teranóstico. |
Palabras clave: Nanotecnología; Cáncer; Nanomedicina; Teranóstico; Targeting Activo; Nanopartículas.
ABSTRACT
Oncologic nanotherapies: current applications and future perspectives
The application of nanotechnology in cancer therapy has received considerable attention in recent years. This is because nanotechnology offers interesting opportunities to improve the efficacy and reduce the toxicity of cancer treatments. This review summarizes the most advanced achievements in the design and development of oncologic nanomedicines presented in a variety of nanocarriers such as liposomes, polymer micelles, nanoparticles and conjugates. Furthermore, it highlights some novel strategies for the treatment of cancer, such as gene therapy, photodynamic therapy and theranostics. |
Keywords: Nanotechnology; Cancer; Nanomedicine; Theranostic; Targeting; Nanoparticles.
1. CÁNCER Y NANOMEDICAMENTOS: EL AUGE DE LAS NANOTERAPIAS ONCOLÓGICAS
El término cáncer se utiliza para identificar y agrupar a un conjunto de más de cien enfermedades, todas ellas caracterizadas por un crecimiento celular acelerado e indiscriminado, que con el tiempo provocan la invasión y el daĖo a tejidos y órganos mediante la diseminación de éstas células a través del sistema sanguíneo y/o el sistema linfático. Dado que el cáncer es una enfermedad multifactorial que involucra múltiples mecanismos biológicos celulares, tales como la seĖalización y la apoptosis, las enfermedades enmarcadas con este nombre difieren significativamente unas de otras (1).
A pesar de los avances logrados en los últimos aĖos, esta enfermedad sigue siendo una de las causas de muerte más devastadoras a nivel mundial, apareciendo más de 10 millones de nuevos casos por aĖo y produciendo la muerte de alrededor de 86 millones de personas en el mismo intervalo de tiempo, principalmente, debido a la falta de un tratamiento eficaz y lo suficientemente accesible para combatir la enfermedad (2).
En la actualidad, la terapia contra el cáncer se encuentra mayoritariamente limitada a la radiación y quimioterapia, técnicas altamente invasivas e incómodas para el paciente y que en muchos casos conducen a la alteración de su salud integral. Los obstáculos más importantes frente a la consecución de una terapia oncológica eficaz se cifran en: (a) la distribución no especifica dentro del organismo de los fármacos antitumorales administrados, b) la incapacidad de alcanzar concentraciones lo suficientemente elevadas en el sitio del tumor y c) la resistencia desarrollada por las células cancerosas a diferentes tipos de quimioterapia. En este sentido, una de las herramientas principales con las que cuenta la medicina hoy en día es el uso de nanomedicamentos, entendiendo como tales a aquéllos sistemas terapéuticos que presentan un tamaĖo nanométrico (entre 1 y 1000 nm) que llevan asociado un principio activo en su estructura (3). Se espera que en los próximos aĖos los avances en nanociencia y nanotecnología permitan desarrollar medicamentos, multifuncionales, y con una orientación selectiva a tejidos enfermos, capaces de atravesar barreras biológicas para liberar uno o múltiples agentes terapéuticos a nivel local, permitiendo que se alcancen altas concentraciones de los mismos en tiempos apropiados y en condiciones fisiológicas específicas del área tumoral.
El objetivo de este artículo de revisión es el de presentar las diferentes estrategias terapéuticas desarrolladas hasta el momento basadas en la biodistribución selectiva también llamada orientación selectiva o “targeting”. Estas estrategias se presentarán desde la perspectiva conceptual y del análisis crítico de los avances clínicos logrados hasta el momento.
2. LA ORIENTACIÓN SELECTIVA O TARGETING DE LOS NANOMEDICAMENTOS
2.1. El “targeting” pasivo
Las estrategias adoptadas hasta el momento para conseguir la orientación y acumulación de los nanomedicamentos en las células tumorales se han basado en dos mecanismos diferenciados: el denominado “targeting” (direccionamiento o vehiculización) pasivo y el “targeting” activo.
El targeting pasivo consiste en el transporte de nanosistemas por simple convección a través de espacios intracelulares hacia el intersticio tumoral y su posterior acumulación en estos tejidos. El llamado efecto de permeabilidad y retención incrementados (Enhanced Permeability and Rentention (EPR) en inglés) explica este fenómeno (Figura 1). Este efecto, descrito inicialmente por Maeda (4), se fundamenta en la fisiología característica del endotelio de los capilares del tumor, cuyas células se encuentran frecuentemente separadas por espacios de entre 200 y 600 nm, permitiendo así el paso de nanoestructuras a través de ellas. Además, la acumulación de las mismas en el tejido tumoral se ve favorecido por la pobre circulación linfática en este ambiente y la capacidad endocítica de las células tumorales hacia las citadas nanoestructuras (5, 6).
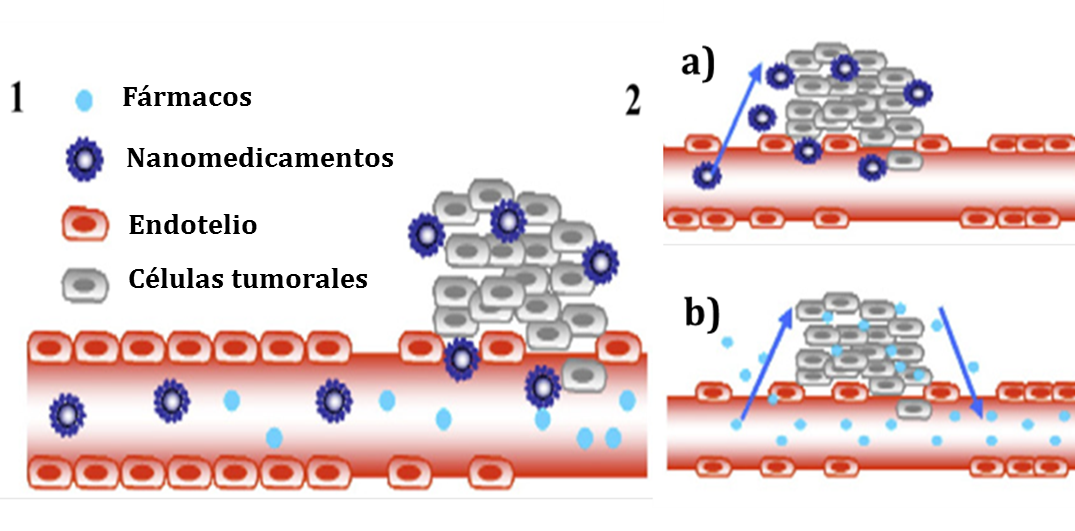
Figura 1.- Targeting pasivo. Representación esquemática del mecanismo de biodistribución selectiva por el efecto de permeabilidad y retención incrementado. En éste tipo de biodistribución selectiva los nanomedicamentos (nanosistema con fármaco asociado) y también los fármacos atraviesan fácilmente el endotelio de los vasos sanguíneos que irrigan el tumor debido a la existencia de grandes espacios en los mismos (1), los nanomedicamentos son retenidos debido a la pobre irrigación linfática (2a), mientras que los fármacos vuelven a la circulación (2b), (Adaptado de (7), con permiso)
Además, se han identificado una serie de parámetros que influyen en el acceso de las nanoestructuras al tejido tumoral. Por ejemplo, se sabe que para que ocurra una extravasación eficiente a través de las fenestras del tejido tumoral los nanomedicamentos deben presentar un tamaĖo inferior a los 400 nm, no obstante, para evitar la filtración renal necesitan ser mayores a 10 nm y para que sean específicamente capturados por el hígado deben de presentar un tamaĖo menor a los 100 nm (7).
La carga superficial de las partículas, juega también un papel fundamental a la hora de conseguir nanomedicamentos de larga permanencia en el organismo después de su administración intravenosa o intramuscular. Dicha carga debe de ser preferentemente neutra o aniónica para evitar la interacción de la nanoestructura con las opsoninas y, en general, con las células sanguíneas (8). La composición química y la hidrofilia de la superficie de los nanomedicamentos son otros dos factores de gran importancia a la hora de evitar el proceso de eliminación por el Sistema Fagocítico Mononuclear (Mononuclear Phagocitic System, MPS). Así, se sabe que las partículas con superficies hidrofílicas son generalmente “invisibles” para las células del MPS por lo que presentan un mayor tiempo de circulación, lo que aumenta las probabilidades de que accedan al tejido tumoral.
Para otorgar estas propiedades a los diferentes sistemas desarrollados y, por lo tanto, mayores tiempos de permanencia en el organismo de los mismos, una de las herramientas más utilizadas es la modificación de la superficie de los nanovehículos mediante el uso de polímeros hidrofílicos (9). La técnica más utilizada ha sido la denominada pegilación (10), ya sea por el simple recubrimiento de los nanomedicamentos con PEG o modificando químicamente los componentes de los nanosistemas para que las cadenas del PEG queden expuestas en la superficie de los sistemas. Hasta la fecha se ha reportado la pegilación de una gran variedad de nanosistemas con resultados bastante prometedores, en la mayoría de los casos aumentando considerablemente sus tiempos de vida media (11).
2.2. El “targeting” activo
El targeting activo hace referencia a la orientación activa del nanomedicamento, y no sólo una simple acumulación en los tejidos tumorales, motivada por su marcada especificidad hacia las células diana. Ésta especificidad se ha conseguido a través de procesos de reconocimiento celular aprovechando la sobreexpresión de varios tipos de receptores en la superficie de las células tumorales (12). La acumulación de nanomedicamentos en el tumor ha demostrado incrementar significativamente la efectividad terapéutica de los fármacos asociados, reduciendo a su vez la aparición de daĖos colaterales (13).
Varias son las técnicas empleadas en el desarrollo de nanomedicamentos dotados de una orientación específica, todas ellas relacionadas específicamente con características bioquímicas y fisiológicas particulares del tumor y con la sobreexpresión de receptores, condiciones del medio tumoral,etc. Todas ellas se han basado en la modificación de la superficie de los nanosistemas con diferentes tipos de moléculas o ligandos que van desde sencillas moléculas de bajo peso molecular a las más complejas macromoléculas. Un ejemplo de esto se muestra en la Figura 2, donde se esquematiza el uso de nanomedicamentos funcionalizados con orientación a receptores superficiales en células tumorales (14).
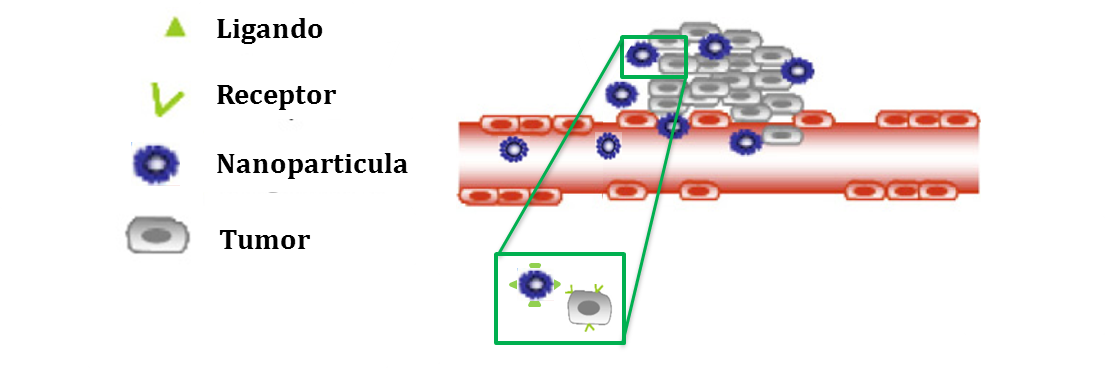
Figura 2.- Biodistribución activa. Representación esquemática del mecanismo de targeting activo, mediante el cual el nanomedicamento puede liberar el fármaco selectivamente en el tejido tumoral. La figura muestra la funcionalización del nanomedicamento con ligandos específicos a receptores sobreexpresados en las células tumorales (Adaptado de (7), con permiso)
El ejemplo más frecuente de moléculas de bajo peso molecular es el ácido fólico, sustrato principal del receptor folato, sobre-expresado en una gran cantidad de células tumorales como en el caso del cáncer ovárico (15). Asimismo, un ejemplo de macromolécula es el ácido hialurónico (AH), sustrato principal del receptor CD44 (16), sobre-expresado en una gran variedad de células tumorales, como en el ovárico, de estómago, de colon y varios tipos de leucemias (17). Además de brindar propiedades de “targeting”, el AH aporta propiedades escudo a los sistemas en que se ha empleado, lo que lo convierte en una interesante herramienta para conseguir los dos tipos de targeting en un mismo medicamento.
Otros receptores diana encontrados en células cancerosas son por ejemplo, el receptor del factor de crecimiento endotelial vascular (VEGFR por sus siglas en ingles) sobre-expresado en células cancerosas en procesos de angiogénesis, los receptores de transferrinas, los receptores de tirosin-quinasas, los receptores de crecimiento epidérmico humanos, y con mayor especificidad dependiendo del tipo de cáncer, diversos receptores de reciente descubrimiento como los CD44, HER-2, el receptor para la hormona liberadora de hormona luteinizante (LHRH) y los receptores de guanilil ciclasa C solo por mencionar algunos (13). El acceso hacia estos receptores puede conseguirse mediante la funcionalización de los nanosistemas con los sustratos específicos.
Otra estrategia ampliamente difundida para conseguir una orientación activa es la funcionalización superficial de los nanosistemas con el uso de anticuerpos monoclonales (18). El uso de este tipo de sistemas permite aumentar la especificidad del tratamiento a nivel celular. Actualmente, ésta estrategia se centra en algunas dianas como lo son las integrinas, annexinas, nucleolinas, VEGF, fosfatidilserinas, etc. (19).
3. AVANCES CLINICOS EN EL ÁMBITO DE LOS NANOMEDICAMENTOS ONCOLÓGICOS
En la actualidad, el desarrollo de la nanomedicina ha llevado a que una gran variedad de nanomedicamentos se encuentren en un avanzado estado de desarrollo para su aplicación en la terapia del cáncer. Estos nanomedicamentos se presentan en diversas formas tales como liposomas, conjugados poliméricos, micelas poliméricas y nanopartículas. A continuación, se describen los nanomedicamentos ya comercializados o en avanzados estudios en fase clínica (Tabla 1).
3.1. Nanomedicamentos en forma de liposomas
Los liposomas son vesículas artificiales constituidas, en su forma más simple, por una bicapa lipídica circundando una cavidad acuosa central (Figura 3) (20). En una manera más compleja, los liposomas pueden contener una o múltiples bicapas alrededor de un núcleo y, dependiendo de la técnica de obtención empleada, su tamaĖo puede comprender decenas o centenares de nanómetros. Su tamaĖo y características fisicoquímicas les permiten circular, penetrar y difundirse con resultados más óptimos a los obtenidos mediante un producto libre o una formulación farmacológica tradicional (21). Las características que hacen de estos sistemas herramientas prometedoras en la vehiculización de fármacos son principalmente su carácter inerte, su elevada biocompatibilidad y sus aceptables perfiles de toxicidad y antigenicidad.
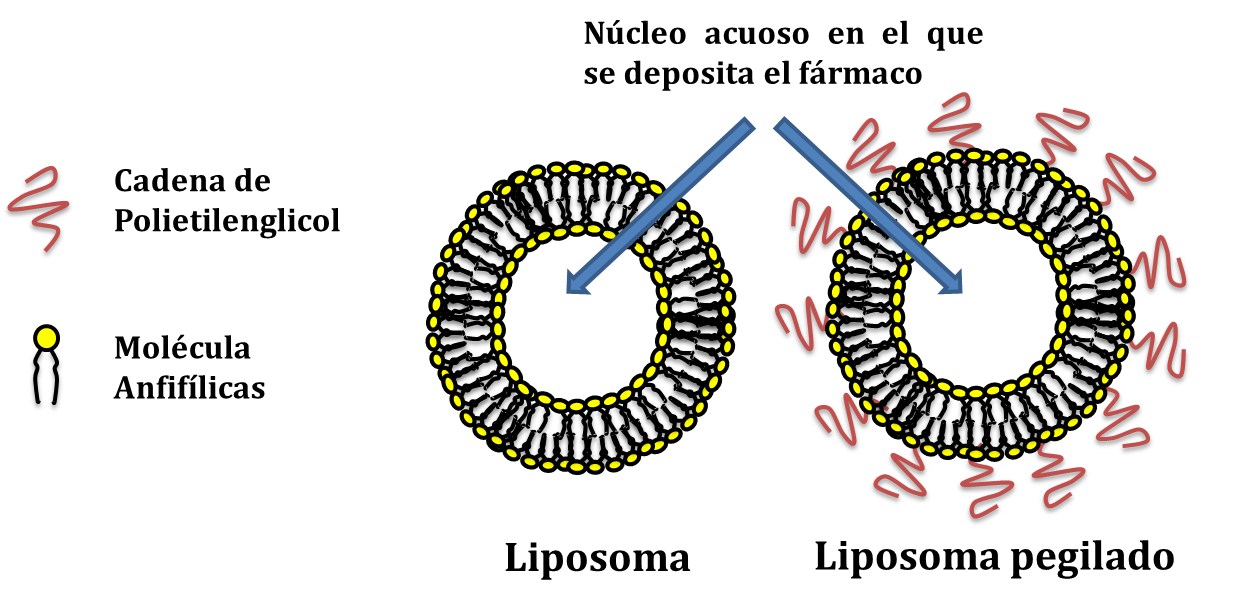
Figura 3.- Tipos de liposomas. Representación esquemática de dos diferentes presentaciones de liposomas, la forma más sencilla de los mismos a base de moléculas anfifílicas y a la derecha los liposomas modificados en su superficie con cadenas de PEG.
Las formulaciones liposomales son los primeros nanomedicamentos aprobados para su uso en humanos en el tratamiento de cáncer. Actualmente existen cuatro formulaciones diferentes comercializadas e indicadas para diferentes tipos de tumor (Tabla 1), dichos sistemas se diseĖaron con el objetivo principal de encapsular fármacos antitumorales para aumentar su tiempo de vida media y disminuir los efectos adversos de los mismos.
Dos de estos sistemas se han desarrollado con el interés particular de encapsular la antraciclina doxorubicina, el Doxil® y el Myocet®. El Doxil® se encuentra desde inicios del 2005 aprobado para su uso clínico en los Estados Unidos y el resto del mundo, y actualmente está indicado para el tratamiento del cáncer de ovario y en el sarcoma de Kaposi como monoterapia y, en asociación con el bortezomib, en el mieloma múltiple. Por otra parte, el Myocet® se encuentra indicado en asociación con ciclofosfamida en el tratamiento de cáncer de mama metastático y en el cáncer de ovario en Canadá y Europa, y en los Estados Unidos se encuentra en estudios clínicos avanzados. A pesar de que ambas formulaciones poseen características y naturaleza similares, la principal y gran diferencia entre Doxil® y Myocet® radica en la pegilación de la superficie del primer sistema. Con esta estrategia, descrita previamente, se ha conseguido incrementar el tiempo de circulación plasmática de la doxorubicina en más de 40 h con respecto a lo obtenido por el sistema sin pegilar (22).
Por otra parte, el Daunoxome®, aprobado desde 1996 por la FDA como medicamento de primera línea en el tratamiento del Sarcoma de Kaposi, es un sistema liposomal no pegilado que encapsula daunorobicina y que ha conseguido mejorar considerablemente la farmacocinética del fármaco y aumentar la esperanza de vida de los pacientes tratados. Finalmente, el Onco-TCS® (Marqibo®) es otra formulación liposomal no pegilada diseĖada para la vehiculización de la vincristina. El Onco-TCS®, ha demostrado reducir la neurotoxicidad de la vincristina y está indicado en el tratamiento del linfoma no-Hodgkin en asociación con otros citostáticos (23).
Además de las formulaciones aprobadas y comercializadas, en la actualidad se encuentran en progreso 512 estudios clínicos en los Estados Unidos y 17 en Europa (http://www.clinicaltrials.gov, Octubre, 2011) que comprenden sistemas liposomales para aplicaciones en el tratamiento del cáncer, lo que representa un futuro más que prometedor para este tipo de medicamentos.
3.2. Los nanomedicamentos en forma de nanopartículas
Las nanopartículas son sistemas matriciales elaborados a partir de una gran variedad de materiales de origen natural, semisintético o sintético, en su mayoría polímeros. Dentro de los polímeros naturales investigados, encontramos algunas proteínas como la albumina, polisacáridos como el quitosano o el ácido hialurónico o polipéptidos y poliaminoácidos. Por otra parte, los materiales de origen sintético más empleados para el desarrollo de nanopartículas son los poliésteres y poliacrilatos. El material empleado afecta de manera importante a las propiedades y estructura de las partículas y condiciona de manera determinante sus posibles aplicaciones clínicas, empezando por la vía de administración (24).
Tabla 1.- Formulaciones liposomales actualmente comercializados o en fasse de evaluación clínica.
LIPOSOMAS |
|||
Nombre comercial |
Fármaco |
Indicación |
Status (aĖo) |
Doxil® |
Doxorubicina |
Cáncer de ovario, mama y sarcoma de Kaposi |
Aprobado (2005) |
Myocet® |
Doxorubicina |
Cáncer de mama metastático en mujeres adultas |
Aprobado* (1995) |
DaunoXome® |
Doxorubicina |
Sarcoma de Kaposi |
Aprobado (1996) |
Onco-TCS® (Marqibo®) |
Vincristina |
Varios tipos de linfoma, leucemia y melanoma |
Aprobado (2004) |
Thermodox® |
Doxorubicina |
Cáncer de mama y de pulmón. |
Fase III |
*Aprobado por la EMA
Tabla 2.- Formulaciones de nanopartículas actualmente en fase de evaluación clínica.
NANOPARTÍCULAS |
||||
Nombre comercial |
Fármaco |
Composición |
Indicación |
Status (aĖo) |
Abraxane ® |
Paclitaxel |
Albumina |
Cáncer de mama |
Aprobado (2005) |
Livatag® (Transdrug®) |
Doxorubicina |
Polialquil-cianoacrilatos |
Hepatocarcinoma |
Fase I/II |
NBTXR3 |
- |
Cristales de óxido de hafnio |
Sarcoma de tejido blando |
Fase I |
Panzem® |
Metoxi-estradiol |
Dispersión nanocristalina de 2-metoxiestradiol |
Cáncer ovárico y glioblastoma multiforme |
Fase III |
Existe una formulación de nanopartículas aprobada para su uso en humanos y otras en avanzados estudios de fase clínicos tanto en Estados Unidos, Europa y Asía (Tabla 2). La formulación comercializada Abraxane® es un sistema a base de nanopartículas de albúmina, diseĖado para la vehiculización del paclitaxel. Actualmente se encuentra aprobado por la FDA y la EMA para su uso en humanos y está indicado para el tratamiento del cáncer de mama metastático. Este sistema ha demostrado una mayor eficacia comparado con el medicamento tradicional para esta terapia, el Taxol®. Esta eficacia se asocia a la posibilidad de administrar mayores dosis de paclitaxel evitando los efectos secundarios causados por los excipientes de los tratamientos actuales, por ejemplo el Cremophor®, aceite de ricino pegilado, en el Taxol® (25). Por otro lado, algunos estudios han demostrado que la albúmina también juega un papel agonista en la efectividad del paclitaxel, debido a su interacción con dos proteínas en circulación sanguínea. Una de las proteínas es la gp60, localizada en la superficie del endotelio vascular, la cual facilita la acumulación de las nanopartículas en el fluido intersticial del tumor (26). La segunda es la osteonectina o SPARC (siglas en inglés de proteína secretada, ácida y rica en cisteína) que se encuentra en la superficie de una gran variedad de células tumorales e interacciona con la albúmina provocando la acumulación de las nanopartículas en las células tumorales (27).
Otro de los grandes avances en la clínica de las nanopartículas lo representa el Livatag® (tecnología Transdrug®), un sistema nanopartículado a base de poli-isocianoacrilatos diseĖado para la vehiculización de doxorubicina (7). Este sistema, actualmente en ensayos clínicos fase II, ha mostrado la capacidad de aumentar significativamente la supervivencia en pacientes con carcinoma hepatocelular, en comparación a la conseguida con el tratamiento clásico de quimioembolización (28).
Cabe aclarar que dentro del arsenal de sistemas conocidos como nanopartículas existen otro tipo de sistemas no poliméricos, como pueden ser las nanopartículas metálicas, magnéticas o cristalinas. Así por ejemplo, actualmente, existe una formulación, el Panzem®, 2-methoxyestradiol en forma de una dispersión nanocristalina en ensayos clínicos fase III para el tratamiento de cáncer ovárico y en glioblastoma multiforme. Cabe seĖalar que esta formulación en forma de nanoscristales de fármaco se administra por vía oral. Otro ejemplo lo constituyen las nanopartículas metálicas de óxido de hafnio, propuestas como potenciadoras del efecto de la radioterapia, que se encuentran en ensayos clínicos fase I.
3.3. Los nanomedicamentos en forma de conjugados poliméricos
El término conjugado se refiere a nanoestructuras híbridas consistentes en polímeros enlazados covalentemente a un agente terapéutico (29). Dentro de los conjugados poliméricos se distinguen dos grupos: conjugados polímero-proteína y conjugados polímero-fármaco. La posible estructura de estos conjugados se describe en la Figura 4. El objetivo perseguido con estos conjugados va desde mejorar la estabilidad del fármaco y reducir su inmunogenicidad hasta conseguir una biodistribución más adecuada (30).
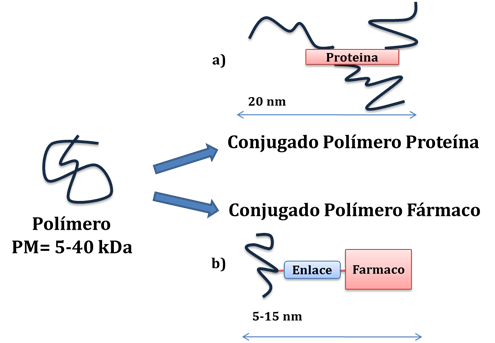
Figura 4.- Diferentes tipos de conjugados poliméricos. Se muestran los dos tipos de conjugados poliméricos que se encuentran en estudio clínico: aa) Conjugado polímero-proteína, en éste caso el ingrediente activo terapéutico es una proteína, pudiendo ser un enzima o un anticuerpo, b) Conjugado polímero-fármaco, en cuyo caso el ingrediente activo es una molécula terapéutica.
A continuación se describen las formulaciones basadas en esta estrategia que se encuentran comercializadas o en fase de evaluación clínica, cuyo conjunto se recoge en la Tabla 3. Se omite la presentación de conjugados que se encuentran en forma de micelas por ser éstos abordados en otra sección.
3.3.1 Conjugados polímero-proteína
En 1990, se comercializó el primer conjugado polimérico bajo el nombre de Zinostatin stimalamer®, sistema también conocido por las siglas SMANCS. Este sistema es un conjugado de estireno-anhidrido maléico (SAM) y la proteína con actividad antitumoral neocarzinostatina (NCS) indicado para el tratamiento de carcinoma hepatocelular. Este sistema consiguió aumentar considerablemente la lipofilia de la proteína y, de este modo, su asociación al agente de contraste Lipiodol®, permitiendo la visualización del tumor a la vez que un aumento del tiempo de vida media de la proteína.
Una de las estrategias de conjugación que merece ser destacada por su importancia es la pegilación. El primer conjugado polímero-proteína, el Oncaspar®, comercializado en 1994, consiste en la unión covalente del enzima L-asparaginasa a una cadena de PEG. El Oncaspar® está indicado como tratamiento de primera línea en pacientes con leucemia linfoblástica. Mediante la conjugación del enzima se consiguió aumentar su tiempo de vida media pasando de horas a días, disminuyendo así la frecuencia de la administración. Además, la pegilación permitió disminuir las reacciones de hipersensibilidad de la L-asparaginasa (31).
Otras dos formulaciones que se encuentran actualmente en estudios clínicos fase II para el tratamiento de melanoma y carcinoma renal son el PEG-Asys® y el PEG-Intron™, ambos consistentes en interferones alfa pegilados. El primero interferón alfa 2-a y el segundo alfa 2-b.
3.3.2. Conjugados polímero-fármaco
El Opaxio®, también conocido como Xyotax®, fue el primer conjugado polímero-fármaco en alcanzar la fase clínica III. Se trata de un conjugado del ácido poliglutámico, y el paclitaxel, que está siendo estudiado para su indicación clínica en el tratamiento del cáncer de esófago, colorectal, mama, ovario y pulmón (32). Esta formulación ha sido desarrollada para incrementar la solubilidad del fármaco y así evitar los efectos indeseables asociados al uso de disolventes lipídicos como el Cremophor®. Además, el paclitaxel así formulado ha conseguido aumentar su efectividad antitumoral.
El Prolindac® es otro conjugado polimérico construido a base de (hidroxipropil)metaacrilamida (HPMA) para la vehiculización un análogo del platino, el oxaliplatino. De esta forma se ha conseguido aumentar la eficacia del fármaco, que actualmente se encuentra en estudios de fase clínica II para el tratamiento de cáncer de ovario (33, 34).
El polímero HPMA ha sido también utilizado para formar conjugados con la doxorubicina, estando dos formulaciones denominadas PK1 y PK2 en ensayos clínicos fase II. La primera de ellas, la PK1, se está ensayando para el tratamiento del cáncer de colon, mama y pulmón, habiendo conseguido una reducción considerable de la toxicidad sistémica de la doxorubicina (35). La segunda de las formulaciones, la PK2, presenta la particularidad de poseer residuos de galactosamina que favorecen la acumulación hepática del complejo (30).
La pegilación también ha dado buenos resultados en términos clínicos en la formación de conjugados polímero-fármaco, estando algunas formulaciones de éste tipo en avanzadas fases de estudios clínicos. Así, el sistema NKTR-102 (28), es un conjugado entre el fármaco irinotecan y el PEG que actualmente se encuentra en estudios de fase II con la indicación para el tratamiento de cáncer de colon, mama y ovario. Esta formulación ha permitido aumentar su eficacia antitumoral en virtud de una mayor concentración de irinotecan en el tumor.
Otra formulación basada en la pegilación , es la denominada Prothecan®, la cual a pesar de encontrarse actualmente descontinuada, sirve de base para explicar una interesante estrategia. Se trata de la camptotecina pegilada con una doble finalidad: aumentar el tiempo de vida media del fármaco, y conservar la conformación de la lactona activa de la camptotecina. Los estudios clínicos en fase II demostraron una mejora considerable de la efectividad antitumoral del fármaco aunque similar a la conseguida con otros fármacos de la misma familia tales como el topotecan y el exatecan. Actualmente se está desarrollando una nueva formulación con un derivado de la campotecina, SN38, basada en esta estrategia (36). Finalmente el CRLX101, es una formulación de nanopartículas a base de un polímero de cadena lineal de ciclodextrinas que conjugan al fármaco camptotecina. Esta formulación está siendo ensayada en estudios clínicos fase II para el tratamiento del cáncer de pulmón no microcítico, obteniéndose un aumento considerable de la residencia del fármaco dentro del tejido tumoral (37).
Tabla 3.- Formulaciones a base de conjugados poliméricos actualmente en fase de evaluación clínica.
CONJUGADOS |
||||||||
Conjugados polímero-proteína |
||||||||
Nombre comercial |
Proteína |
Polímero |
Indicación |
Status (aĖo) |
||||
Zinostatin Stimalmer® |
SMANCS |
Estireno-anhídrido maléico |
Carcinoma hepatocelular |
Aprobado (1990) |
||||
Oncaspar® |
L-asparaginasa |
PEG |
Leucemias |
Aprobado (1994) |
||||
PEG-Asys® |
Interferon α-2a |
PEG |
Melanoma y carcinoma renal |
Fase I-II |
||||
PEG-Intron™ |
Interferon α-2b |
PEG |
Melanoma y carcinoma renal |
Fase I-II |
||||
Conjugados polímero-fármaco |
||||||||
Nombre comercial |
Fármaco |
Polímero |
Indicación |
Status |
||||
Opaxio® (Xyotax®) |
Paclitaxel |
Poliglutamato |
Cáncer de mama y de ovario |
Fase II-III |
||||
Prolindac (AP5346) |
Platino-DACH |
Hidroxipropil-metaacrilamida (HPMA) |
Cáncer de ovario |
Fase II |
||||
PK1 |
Doxorubicina |
HPMA |
Cáncer de mama, de pulmón y de colon |
Fase II |
||||
PK2 |
Doxorubicina |
HPMA - Galactosamina |
Carcinoma hepatocelular |
Fase II |
||||
NKTR-102 |
Irinotecan |
PEG |
Cáncer de mama Cáncer colorectal, de pulmón y de ovario |
Fase III Fase II |
||||
Prothecan® |
Camptotecina |
PEG |
Cáncer gástrico y de esófago |
Fase II |
||||
CRLX101 |
Camptotecina |
Ciclodextrinas |
Cáncer de pulmón no microcítico |
Fase II |
||||
3.4. Los nanomedicamentos en forma de micelas
Las micelas, son nanoestructuras originadas a partir del auto-ensamblaje de moléculas anfifílicas, generalmente tensoactivos, proteínas o polímeros sintéticos o naturales, de tamaĖo comprendido entre los 10 y los 100 nm. Estos sistemas presentan una estructura tipo reservorio con un núcleo generalmente hidrofóbico en el que comúnmente se deposita al fármaco y una superficie hidrofílica (Figura 5) (38). Por su sencillez y versatilidad en cuanto a preparación y componentes empleados, las micelas son consideradas hoy en día como los nanomedicamentos con mayor potencial en clínica a corto plazo. En la Tabla 4 se resumen los sistemas más avanzados hasta la fecha.
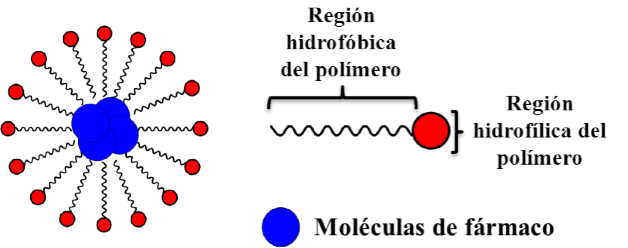
Figura 5.- Micelas. Esquema de una micela polimérica mostrando los componentes de la misma.
En la actualidad existen cinco formulaciones que se encuentran en avanzados estudios clínicos en la terapia de diferentes tipos de cáncer, todas ellas con resultados prometedores. Los taxanos, como el docetaxel y el paclitaxel, debido a su naturaleza hidrofóbica y a su muy baja solubilidad en agua son algunos de los candidatos ideales para ser formulados mediante esta herramienta. Así, el Genexol® PM es una formulación consistente en micelas poliméricas, construidas por un polímero de tipo dibloque de ácido poliláctico-PEG (PLA-PEG) encapsulando al paclitaxel. Los sistemas obtenidos presentan un rango de tamaĖos de los 20 a los 50 nm (39). Estas micelas se encuentran en estudios clínicos de fase III en su indicación para cáncer de mama, de pulmón no microcítico y páncreas.
Otra formulación de paclitaxel, es el denominado NK105 (40), constituida por micelas de PEG-Poliaspartato con un tamaĖo medio de 80 nm. Esta formulación se encuentra en estudios clínicos de fase II en su indicación para el cáncer de estómago (41). Finalmente, en lo referente a la vehiculización de paclitaxel en sistemas micelares, se encuentra el Paclical®, micelas a partir de vitamina A (en la plataforma denominada XR-17) que se encuentran en fase III para el tratamiento de carcinoma ovárico (30). Este sistema presenta como principales ventajas la eliminación de la necesidad de premedicación y la eliminación de los efectos adversos causados por los principales excipientes de la formulación comercial de paclitaxel.
Tabla 4.- Formulaciones de micelas actualmente en fase de evaluación clínica.
MICELAS |
||||
Nombre comercial |
Fármaco |
Composición |
Indicación |
Status (aĖo) |
Genexol- PM® |
Paclitaxel |
Ácido poliláctico - PEG |
Cáncer de mama y de ovario |
Fase II |
Cáncer de ovario |
Fase I-II1 |
|||
Cáncer de pulmón no microcítico |
Fase II1 |
|||
Cáncer pancreático |
Fase III2 |
|||
NK105 |
Paclitaxel |
PEG-Poliaspartato |
Cáncer de estomago |
Fase II |
Paclical® |
Paclitaxel |
Derivado de Vitamina A |
Cáncer de ovario |
Fase III |
NK012 |
SN 38 |
PEG-poliglutamato |
Cáncer de mama |
Fase II |
Nanoxel-PM® |
Docetaxel |
PEG-ácido-poli-D-l-láctico |
Cáncer de mama |
Fase I |
NC-6004/ Nanoplatin™ |
Cisplatino |
Ácido poliglutámico-PEG |
Cáncer pancreático |
Fase I |
SP1049C |
Doxorubicina |
Pluronics |
Cáncer de esófago y de estómago |
Fase III |
1 En terapia combinada con la administración de carboplatino
2 En terapia combinada con la administración de gemcitabina
Otra formulación actualmente en evaluación clínica fase II para el tratamiento de cáncer de mama es el NK012, constituida por micelas de PEG-poliglutamato que contienen un análogo de camptotecina, metabolito del irinotecan, el SN38. En esta formulación el principio activo se encuentra unido covalentemente a los residuos hidrofóbicos del copolímero, lo que permite una lenta liberación del mismo a partir de la degradación del propio sistema (42).
El cisplatino, incorporado en micelas de otro copolímero, el ácido poliglutámico-PEG, denominado NC-6004 (Nanoplatin™) (43) es otro sistema micelar indicado para el tratamiento del cáncer de páncreas en asociación con la gemcitabina, que se encuentra en fase II. Los resultados iniciales sugieren una reducción significativa de los efectos colaterales de neurotoxicidad y nefrotoxicidad asociados al cisplatino (44).
El docetaxel, un taxano, formulado en micelas de PEG-ácido poli-D-L-láctico(45), se encuentra en estudios clínicos fase I, en su indicación para el tratamiento del cáncer de mama bajo el nombre de Nanoxel-PM®. Ésta formulación ha conseguido una reducción significativa de los efectos adversos del Taxotere®.
Finalmente, el SP1049C, un sistema de micelas construidas a partir de una mezcla de copolímeros, Pluronic L61 y Pluronic F127, para la vehiculización de la doxorubicina se encuentra actualmente en fase clínica III, indicado para el tratamiento de adenocarcinomas y de cáncer de estómago (24). Esta formulación presenta un perfil de toxicidad mucho más favorable que el del fármaco solo, además de tener actividad frente a tumores generalmente resistentes a la doxorubicina sola.
4. ÁREAS emergentes de la nanomedicina oncológica
Dentro de las áreas emergentes en nanomedicina oncológica destacan las terapias basadas en la aplicación de fuentes de energía externa (terapia fotodinámica), la terapia génica o el desarrollo de vacunas específicas contra la enfermedad.
4.1. Terapia fotodinámica basada en el uso de nanomedicamentos
La terapia fotodinámica es una técnica que se fundamenta en el uso de energía luminosa. El mecanismo de acción de ésta terapia conlleva el uso de compuestos denominados fotosensibles, los cuales al ser irradiados por una fuente laser y en presencia de oxígeno, conducen a la formación de especies citotóxicas (46).
A pesar del éxito previsible de esta terapia, dentro de sus limitaciones cabe destacar la escasa estabilidad, el carácter hidrofóbico y la biodistribución indiscriminada de los agentes empleados. Por tanto, el uso de estrategias nanotecnológicas ofrece un panorama alentador al brindar la posibilidad de mejorar la estabilidad y solubilidad de los compuestos fotosensibles, a la vez que propiciar la orientación de dichos agentes en el organismo, consiguiendo una mayor especificidad de la terapia.
Al ser una estrategia relativamente nueva, no existen actualmente estudios clínicos de su aplicación en la terapia del cáncer, sin embargo, existen varios sistemas candidatos en desarrollo preclínico. Así por ejemplo, algunas formulaciones liposomales como el Foslip® o su análogo pegilado, FosPEG®, actualmente se encuentran en estudios preclínicos para el tratamiento del cáncer de mama encapsulando el agente fotosensible mTHPC (43, 44). También han sido desarrollados con este propósito nanopartículas de cerámica o metálicas modificadas en su superficie a fin de lograr su orientación especifica (39, 40). Dentro de ellas destaca la formulación denominada Pc4SN consistente en nanopartículas de silicio que asocian el agente fotosensible PC4 y cuyo uso está previsto para el tratamiento de melanomas (42, 45).
Además del uso de la luz como fuente de energía para la excitación de compuestos en la terapia contra el cáncer, en la actualidad se están estudiando otro tipo de fuentes energéticas tales como energías térmicas, magnéticas o de captura de neutrones (47). No obstante, y a pesar de la escasa toxicidad de estas terapias, una de las limitaciones asociadas al desarrollo clínico de las mismas reside en la incomodidad que representan para el paciente, por lo que su utilización que ha de venir compensada por un incremento significativo de su eficacia.
4.2. Terapia basada en el uso de nanopartículas magnéticas
El desarrollo de la ciencia de los materiales y la evolución de las técnicas para la consecución de nanopartículas a base de hierro, níquel o cobalto que exhiben propiedades magnéticas, llamadas nanopartículas magnéticas, ha permitido avanzar significativamente en cuanto a su potencial como terapias oncológicas. Una de las ventajas asociadas a esta terapia reside en su orientación selectiva mediada por el uso de fuerzas magnéticas (48).
El targeting por esta vía se lleva a cabo mediante el uso de un campo magnético externo, generalmente generado por magnetos de tierras raras o de campos y gradientes muy altos como aquellos compuestos por neodimio, hierro y boro (Nd-Fe-B) (49). El principio básico del targeting guiado mediante campos magnéticos es colocar un magneto dentro del tejido diana, por ejemplo dentro del tumor, para conseguir una acumulación de las nanopartículas orientadas sobre el mismo, si es que éstas están asociadas a algún tipo de fármaco, o bien, para ocasionar mediante el mismo procedimiento la acumulación de las nanopartículas en los vasos sanguíneos circundantes al tumor con la finalidad de obstruirlos y aislar al tumor de los nutrientes necesarios. Ésta última técnica ha sido diseĖada y desarrollada desde inicios de 1970, sin embargo, problemas de biocompatibilidad e inestabilidad impidieron entonces mayores avances en esta área. Finalmente, otra estrategia ampliamente investigada en el uso de nanopartículas magnéticas es el de la hipertermia; ésta técnica se fundamenta en la producción de calor por parte de las nanopartículas magnéticas al ser expuestas a ciertos tipos de campos magnéticos por corriente alterna (AC), esto ocasiona el calentamiento de las mismas a más de 45ľC lo que produce daĖos considerables a las células cancerosas (50).
El uso de nanopartículas magnéticas en la terapia del cáncer no solo se limita a su aplicación terapéutica, algunos estudios han demostrado que mediante el uso de estos sistemas es posible llevar a cabo el diagnóstico mediante técnicas de contraste. Actualmente, las nanopartículas magnéticas están siendo investigadas para la visualización de metástasis en los nodos linfáticos, algo que con las técnicas actuales es imposible de conseguir (51).
4.3. Terapias génicas
La posibilidad de inducir la expresión de una proteína terapéutica (insertando un gen funcional) o en el caso contrario de suprimir la expresión aberrante de una proteína (inhibiendo la expresión de un gen defectuoso) cuando ésta sea el origen de una determinada enfermedad, abre innumerables posibilidades para revolucionar la práctica clínica (52). Como en otros casos, la nanotecnología ofrece interesantes oportunidades para proteger al material genético frente a su degradación y, sobre todo, para conseguir su liberación selectiva a nivel intracelular.
Hasta el momento se han desarrollado dos tipos de sistemas para la transferencia de material genético, los virales y no virales o de naturaleza sintética (53). Los sistemas sintéticos son los que aborda principalmente la nanotecnología en virtud de la combinación adecuada de biomateriales que pueden ser a su vez de origen natural o sintético. De la gran variedad de vehículos sintéticos desarrollados hasta el momento (54), cabe destacar la formulación liposomal denominada Allovectina 7®, la cual contiene una secuencia de ADN plasmídico que codifica la cadena pesada HLA-B7 y la microglobulina a2, ambos constituyentes del antígeno MHC-1(55). El plásmido se combina con lípidos catiónicos y se inyecta intratumoralmente. Actualmente se encuentra en estudios clínicos en fase II indicado para el tratamiento del melanoma metastático y para el cáncer de cabeza y cuello (56).
Otra formulación liposomal de este tipo, y que actualmente se encuentra iniciando estudios clínicos en fase I (57), es la Atu-027, construido a partir de lípidos catiónicos pegilados, indicado para el tratamiento de tumores sólidos. La molécula de siRNA en este caso está diseĖada para la inhibición de la proteína quinasa N3 (PKN-3), la inhibición del mecanismo de ésta proteína está asociado con varios mecanismos antiangiogénicos (58).
Por último, existe una formulación de nanopartículas, a base de un polímero linear de ciclodextrinas, funcionalizadas con transferrina, denominada CALAA-01, que se encuentra actualmente en estudios de fase clínica I para el tratamiento de tumores sólidos. El ingrediente activo es una molécula de ARN interferente pequeĖo (siRNA) capaz de reducir la expresión de la subunidad M2 de la ribonucleotido reductasa (R2), una enzima esencial requerida para la biogénesis del ADN (59) sobreexpresada en una gran variedad de cánceres gástricos asociada a la quimioresistencia, y cuya inhibición se ha descubierto como una interesante estrategia terapéutica, especialmente para las líneas tumorales MKN-1, MKN-7, and SNU-719 (60).
4.4. Nanovacunas contra el cáncer
La aplicación de la nanotecnología al desarrollo de vacunas ofrece interesantes posibilidades al permitir diseĖar nanosistemas que promueven la captación del antígeno por las células presentadoras de antígeno (CPA) (61). Además, los nanosistemas permiten la incorporación de agentes adyuvantes auxiliares que al liberarse conjuntamente con el antígeno permiten aumentar su potencia, o bien para modular la respuesta inmune y dar lugar a respuestas celulares (62). Las vacunas contra el cáncer ofrecen múltiples ventajas con respecto a las terapias tradicionales, principalmente debido a una especificidad incrementada, toxicidad reducida y el efecto a largo plazo producido por la memoria inmunológica. Dichas vacunas pueden desarrollarse como una estrategia profiláctica o terapéutica siendo en ambos casos el objetivo la biodistribución selectiva hacia las células dendríticas (63).
Algunas formulaciones de liposomas y nanopartículas se encuentran actualmente en investigación, resaltando la L-BLP25 (o Stimuvax®), una formulación desarrollada en 1998, que consiste en un sistema liposomal, a base de colesterol, dimiristoil fosfatidilglicerol y dipalmitoil fosfatidilcolina, que encapsula al péptido sintético BLP25 y al adyuvante MPLA. Ésta se encuentra actualmente en fase clínica III para el tratamiento de cáncer de pulmón no microcítico en Asia y ha mostrado un aumento considerable en la supervivencia de los grupos tratados (64).
5. Tendencias futuras en nanoterapias oncológicas: el nanoteranóstico
El desarrollo exponencial experimentado por la biología y la medicina molecular en las últimas décadas ha permitido dilucidar numerosos mecanismos celulares y moleculares involucrados en la aparición y evolución del cáncer lo que puede ser aprovechado por la nanotecnología para el diseĖo de terapias más eficaces, seguras y cómodas para el paciente, además para la detección cada vez más temprana de la enfermedad y la monitorización de la misma a través del tratamiento.
En este sentido, en los últimos aĖos se ha ido forjando una nueva herramienta dentro de la nanomedicina contra el cáncer denominada “teranóstico”, la cual precisamente consiste en la suma de las estrategias de diagnóstico, tratamiento y evaluación de la enfermedad en un mismo dispositivo nanométrico aprovechando los avances en el targeting y las técnicas de contraste actuales (Figura 6) (65).
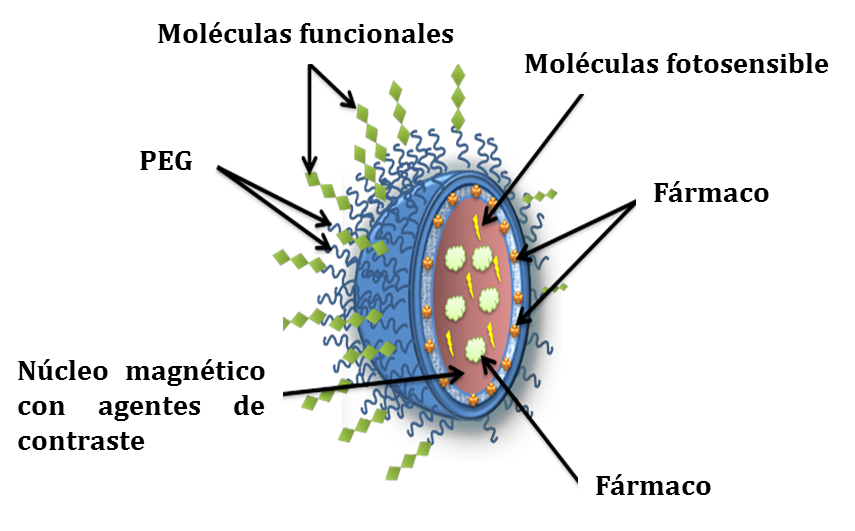
Figura 6.- Modelo de un sistema teranóstico. El nanosistema incluye además de un fármaco, un agente fotosensible, un agente magnético y agentes de contraste para permitir tanto la orientación selectiva como el diagnostico y la monitorización de la terapia.
Dentro de las ventajas y soluciones que ofrece el teranóstico se encuentran entre otras, 1) la posibilidad de monitorizar en tiempo real la biodistribución ya sea del fármaco administrado o del nanomedicamento en su conjunto, esto último siempre de la mano de la asociación entre un agente terapéutico y un agente de contraste en el sistema. 2) Analizar la distribución y acumulación del fármaco o nanomedicamento en el sitio de acción a través de técnicas de imagen o de contraste, utilizando técnicas como el PET o RMN. 3) Monitorizar los diferentes mecanismos de liberación de fármacos desde los nanomedicamentos. 4) Provocar o controlar la liberación de los fármacos desde el nanomedicamento a través del uso de energías externas que provoquen cierta reacción en la estructura del nanomedicamento. 5) Ayudar a la elección de una terapia determinada en el tratamiento, o en su caso ayudar a predecir la respuesta terapéutica de un nanomedicamento, esto por medio de la monitorización del nanomedicamento en el organismo, sabiendo dónde se distribuye y dónde se localiza el mismo, podemos saber si dicha terapia es efectiva para determinado tipo de tumor, por ejemplo en los casos de tumores que presentan el efecto EPR (66).
Y finalmente, el objetivo principal del teranóstico radica en 8) combinar el diagnóstico y el tratamiento de la enfermedad en una misma terapia. Por medio del uso de agentes de contraste, moléculas funcionales, sistemas nanométricos y el fármaco adecuado, es posible que los sistemas empleados en el nanoteranóstico permitan el desarrollo de sistemas capaces de diagnosticar o identificar el cáncer desde sus estados más tempranos, permitiendo la visualización de las células anormales y su consecuente tratamiento farmacológico (67).
6. Conclusiones y perspectivas
Muchas son las estrategias utilizadas en el desarrollo de nanomedicamentos oncológicos, brindando la gran mayoría resultados prometedores en el tratamiento de diferentes tipos de cáncer. Es previsible, por tanto, que cada vez más frecuencia nos encontremos con sistemas de éste tipo como tratamientos de primera línea en la terapia del cáncer.
Además, la nanomedicina podría aportar un cambio sin precedentes en los paradigmas actuales referentes a la comprensión de la interacción de los fármacos y dispositivos terapéuticos con las células tumorales, en tiempo real y en una escala celular e incluso molecular. Éste conocimiento podría resultar en nuevas estrategias para el diagnóstico y la prevención de la enfermedad, ya que previsiblemente los nanomedicamentos permitirán la detección y el seguimiento de la enfermedad desde los primeros indicios de su aparición.
El objetivo a largo plazo de lo que podríamos denominar nano-oncología consiste en consolidar una medicina personalizada que pueda tratar el cáncer aún antes de que este se manifieste como una amenaza a la vida del paciente, mediante técnicas de reconocimiento especifico de células cancerosas o a parámetros genéticos que determinen la enfermedad. Además, los nanomedicamentos permitirán tratar la enfermedad a la vez que, por medio de técnicas de imagen podrá realizar una monitorización en tiempo real de la evolución del mismo.
7. Agradecimientos
Este trabajo ha sido financiado por el Ministerio de Ciencia e Innovación (MICINN, Programa Consolider Ingenio, Ref. CSD2006-00012) y la Xunta de Galicia (Grupos de Referencia Competitiva-Fondos FEDER y PGIDIT 08CSA045209PR)
8. REFERENCIAS
1. Diccionario del Cáncer. National Cancer Institute. (2011). http://www.cancer.gov/diccionario/.
11. Molineux, G. (2002). Pegylation: engineering improved pharmaceuticals for enhanced therapy. Cancer Treatment Reviews, 28, Supplement 1, 13-16.
22. Martin, F. (2011). Comparison of Liposomal Doxorubicin Products: Myocet Vs. DOXIL. Apples to Apples? http://www.fda.gov/ohrms/dockets/ac/01/slides/3763s2_08_martin/sld001.htm.
40. NK105 Paclitaxel Micelle. (2011). (cited 2011 17-10-2011); Available from: http://www.nanocarrier.co.jp/en/research/pipeline/01.html.
53. Rochlitz, C.F. (2001). Gene therapy of cancer. SWISS MED WKLY, 131, 4-9.
57. Study With Atu027 in Patients With Advanced Solid Cancer. (2011)
http://clinicaltrials.gov/ct2/show/NCT00938574?term=atu+027&rank=1.
61. O'Hagan, D.T., & al. (2006). Novel approaches to pediatric vaccine delivery. Advanced Drug Delivery Reviews, 58(1), 29-51.
67. Lammers, T., & al. (2010). Nanotheranostics & Image-Guided Drug Delivery: Current Concepts & Future Directions. Molecular Pharmaceutics, 7(6), 1899-1912.