
Superoxide Dismutase: a therapeutic candidate for oxidative stress
Title in Spanish: Superóxido Dismutasa: un candidato terapéutico para el estrés oxidativo
Mario Riera Romo1
1Facultad de Biología, Universidad de la Habana, calle 25, entre I y J, # 455. CP. 10400, Vedado, Plaza de la Revolución, La Habana, Cuba
*Corresponding Author: mayito265@gmail.com An Real Acad Farm Vol. 81, Nľ 1 (2015), pp. 25-36
Received: February 13, 2015 Accepted: April 5, 2015 Language of Manuscript: Spanish
![]()
1. INTRODUCCIÓN
La Superóxido Dismutasa humana (hSOD) es una metaloenzima que presenta tres isoformas: hSOD1, hSOD2 y hSOD3. La hSOD1 pertenece a la familia de las Superóxido Dismutasas Cu/Zn (1), contiene 155 aminoácidos y actúa en forma de homodímero (Figura 1) que se mantiene estabilizado por entrecruzamientos del triptófano 33, residuo de dimerización (2). Posee dos átomos de cobre en su centro activo, los cuales forman enlaces de coordinación con las histidinas 47, 49, 64 y 121 de cada subunidad, funcionando como aceptores de electrones que le permiten a la enzima catalizar la dismutación de los aniones superóxido producidos como resultado del metabolismo oxidativo celular (3) mediante la siguiente reacción: O2•- + O2•- + 2H+ → H2O2 + O2. Contiene también iones zinc en su estructura, a nivel de las histidinas 72 y 81, y del aspártico 84, los cuales aportan estabilidad estructural y favorecen la dimerización (4).
Se encuentra principalmente localizada en citoplasma y núcleo donde protege al material genético y a la mayoría de los orgánulos subcelulares, del estrés oxidativo (5). En estas localizaciones puede sufrir modificaciones postraduccionales que regulan su actividad y vida media, tales como la poliubiquitinación, que media su degradación proteosómica, así como la dimerización por entrecruzamiento de triptófano que impide la dimerización por puente disulfuro, la cual regula negativamente a la enzima. Ésta también puede ser palmitoilada, lo cual promueve la residencia en núcleo pero disminuye la actividad, y succinilada en residuos adyacentes al centro catalítico rico en cobre, lo que igualmente disminuye la actividad. La succinilación es reversible y puede ser eliminada por la proteína SIRT5 (6).
Entre las principales funciones en las que esta isoforma participa se encuentran la activación de la vía de seĖalización de las MAP Quinasas, el trasporte axónico, la fragmentación del DNA apoptótico, la organización celular estereociliada de los receptores auditivos, la coagulación sanguínea, el envejecimiento celular, el metabolismo del hierro, la contracción del músculo cardíaco, el procesamiento del glutatión, la homeostasis neuronal y muscular, la respuesta celular a múltiples drogas, la diferenciación de los linfocitos T en el timo, el desarrollo folicular del ovario, el desarrollo embrionario y de la placenta, entre otras (7, 8).
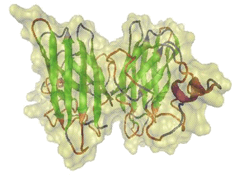
Figura 1. Estructura dímérica de la Superóxido Dismutasa 1 humana (hSOD1) obtenida mediante modelación por comparación. Se representa en verde la estructura en hoja β, en púrpura los motivos en hélice α, en rojo los giros, en azul los lazos y en amarillo la superficie total del dímero.
La hSOD2 pertenece a la familia de las Superóxido Dismutasas Fe/Mn y cataliza la misma reacción de dismutación que la hSOD1 (9). Posee 244 aminoácidos y actúa en forma de homotetrámero (Figura 2), que presenta un átomo de manganeso por subunidad, el cual es responsable de la dismutación y se encuentra coordinado en las histidinas 50, 98 y 187 y el aspártico 183 (10). La enzima se localiza fundamentalmente en la matriz mitocondrial, asociada a la dismutación inmediata de los aniones superóxido que allí se producen, la protección del propio organelo y el DNA mitocondrial contra la peroxidación, y la regulación de la apoptosis vía mitocondria y citocromo C (11).
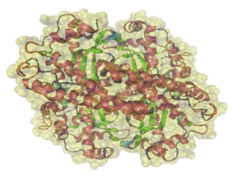
Figura 2. Estructura tetramérica de la Superóxido Dismutasa 2 humana (hSOD2) obtenida mediante modelación por comparación. Se representa en verde la estructura en hoja β, en púrpura los motivos en hélice α, en cian las hélices Ļ, en rojo los giros, en azul los lazos y en amarillo la superficie total del tetrámero.
Su expresión es inducida por la proteína KRIT1 (12) y entre las principales modificaciones postraduccionales que experimenta, se encuentran, la nitración de la tirosina 58, lo que regula negativamente la actividad (13), la acetilación de las lisinas 68, 122 y 202, lo que disminuye la actividad enzimática. Dicha modificación puede ser revertida por la desacetilasa SIRT3 (11). Esta isoforma mitocondrial de la hSOD, está involucrada en la respuesta a múltiples drogas, la hematopoyesis, la diferenciación celular, la homeostasia del O2, las vías de seĖalización de la apoptosis, el desarrollo del sistema renal, el mecanismo de la locomoción, la regulación de la presión sanguínea, entre otras múltiples funciones (14).
La tercera isoforma, hSOD3, pertenece a la familia de las Dismutasas Cu/Zn, y posee 240 aminoácidos (15). Actúa como homotetrámero (Figura 3), que contiene dos puentes disulfuro, entre la cisteína 63 y la 208 y entre la 125 y la 207, un ion cobre por subunidad, coordinado en las histidinas 114, 116, 131 y 181, y un ion zinc a nivel de las histidinas 139 y 142, y del aspártico 145 (16). La principal modificación postraduccional de la enzima es la glicosilación de la asparagina 107 y las lisinas 229 y 230 (17).
Las funciones en las que esta isoforma participa aún no están del todo claras, pero se sabe que es secretada al líquido intersticial y se une con alta afinidad a heparina y heparán sulfato, expuestos en los tejidos, por lo que debe estar involucrada en la protección contra el estrés oxidativo en estas localizaciones.
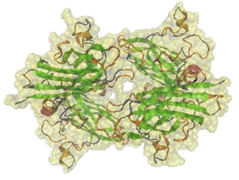
Figura 3. Estructura tetramérica de la Superóxido Dismutasa 3 humana (hSOD3) obtenida mediante modelación por comparación. Se representa en verde la estructura en hoja β, en púrpura los motivos en hélice α, en naranja las hélices 3-Ļ, en rojo los giros, en azul los lazos y en amarillo la superficie total del tetrámero.
1.1. Actividad SOD en la diabetes mellitus tipo I
Entre las causas no autoinmunes encontradas para la Diabetes Mellitus tipo I se ha propuesto el desbalance oxidativo y la peroxidación causada por ERO, la cual provoca la destrucción de las células β del páncreas y la consecuente disminución de los niveles de insulina, asociados a este trastorno metabólico. Esta hipótesis explica la patología y algunas de sus principales complicaciones mediante un déficit en los mecanismos protectores contra el estrés oxidativo, tales como la actividad SOD (18).
La inactivación por glucosa de la SOD1 extracelular, el desbalance de la relación NADH/NAD+ (pseudohipoxia hiperglicémica) (19) y la desregulación del metabolismo de los cofactores requeridos por la hSOD1, 2 y 3 (Cu2+, Zn2+ y Mn2+) parecen ser las principales causas (20, 21).
Experimentos en modelos murinos para la enfermedad han demostrado una disminución de la actividad SOD en páncreas, hígado, riĖón, cerebro, músculo y bazo (19), así como un decremento de la actividad SOD1 en eritrocitos y de la SOD2 en mitocondrias hepáticas de rata (20).
1.2. Papel de la SOD en el cáncer
La célula tumoral en su proceso de transformación maligna, inhibe y evade numerosos mecanismos de control, como la inducción de la apoptosis, el arresto de algunas fases del ciclo celular o el acortamiento de los telómeros, mientras sobreexpresa moléculas y activa mecanismos que le permiten la autosuficiencia para factores de crecimiento, la proliferación descontrolada y la supervivencia celular, tales como el receptor del EGF, el factor de transcripción NF-κB o la propia enzima hSOD, que protege a la célula cancerígena de la peroxidación causada por su propio metabolismo incrementado y no regulado (22).
Estudios realizados in vitro, en líneas tumorales de fibroblastos de pulmón humano, revelan incrementos en la actividad hSOD1 y 2 respecto a células normales (23). Por otra parte, investigaciones en hepatomas y tumores ascíticos de Ehrlich demostraron elevada actividad SOD2, comparando con tejido hepático sano (24), al igual que las mediciones de la actividad SOD en la leucemia linfocítica, monocítica y mielocítica, las cuales corroboran niveles mayores de esta actividad enzimática respecto a células sanguíneas maduras sanas, del mismo tipo (25).
De forma contradictoria, estudios realizados en Adenocarcinoma Pancreático encontraron una disminución de los niveles de expresión y la actividad hSOD2, y asocian este hecho al papel mutagénico atribuído a las ERO (26).
Algunos hallazgos más recientes evidencian el incremento de la actividad hSOD1 en células de cáncer de pulmón humano y la relacionan con la proteína pleiotrópica COMMD1, demostrando que células “ knockdown” para esta proteína exhiben mayores niveles de la actividad antioxidante (27).
1.3. SOD y los desórdenes neurodegenerativos
Las llamadas Enfermedades o Trastornos Neurodegenerativos se caracterizan por apoptosis no regulada y muerte neuronal masiva en determinadas áreas del cerebro, por la influencia de múltiples factores cuyo papel no está del todo claro, lo que conduce a una pérdida de funciones neuromotoras y psíquicas comprendidas dentro de un conjunto de patologías como la Enfermedad de Alzheimer (EA), el Parkinson (P), la Esclerosis Lateral Amiotrófica (ELA), la Enfermedad de Huntington (EH) y otras. Dentro de estos factores causales se ha considerado la apoptosis por peroxidación lipídica y proteica y la apoptosis vía citocromo C, como algunas de las más probables, lo que implicaría una afectación en la actividad hSOD1 y 2 (28).
Estudios in vitro, en neuronas en cultivo, han demostrado que la inducción de la expresión de hSOD1 derivada de eritrocitos, impide o retarda la apoptosis causada por depleción del factor de crecimiento del nervio (NGF) (29), así como también experimentos realizados con muestras de pacientes y en algunos modelos murinos, correlacionan bajos niveles de SOD2 con pérdida de neuronas y muerte de células linfoblastoides, lo que provoca Ataxia Espinocerebelar tipo 3. La patología se caracteriza por mutaciones en el gen ATXN3, que conllevan a la pérdida de afinidad por el factor de transcripción FOXO4, afectándose el mecanismo de inducción de SOD2 ante estrés oxidativo (30).
Adicionalmente, se ha demostrado la relación entre la SOD1 y la ELA en modelos murinos (31). La patología se origina por apoptosis motoneuronal y se ha identificado como uno de los factores causales se ha debida a la activación de la quinasa MST1 por ERO, lo que resulta en un incremento en la actividad de p38 y una inducción de autofagia mitogénica dependiente de quinasas en las neuronas motoras (31).
2. ESTUDIOS DE ESTRUCTURA-FUNCIÓN DE LA SOD
Las variadas patologías en las que la enzima está involucrada la convierten en objeto de estudio de numerosas investigaciones, con el objetivo de comprender las causas y complicaciones de algunas enfermedades multisistémicas asociadas al estrés oxidativo, así como mejorar racionalmente la estabilidad y actividad de la enzima con vistas a emplearla como producto terapéutico recombinante, de administración exógena. En el presente trabajo se realiza una revisión de las principales técnicas de ingeniería de proteínas aplicadas al análisis estructura-función y a la optimización funcional de la SOD.
2.1. Mutagénesis dirigida
Una de las líneas de investigación relacionada con experimentos de mutagénesis dirigida en la SOD, está basada en la obtención de mutantes para determinados residuos clave o la introducción de secuencias completas de otras variantes enzimáticas como la SOD extracelular (SOD3), para dilucidar elementos del mecanismo de acción de la enzima en condiciones fisiológicas.
Dentro de esta línea se encuentra el trabajo de Castellano I. et al. en 2009 (32), que expresa en E.coli, la SOD2 mitocondrial de rata, que posee un 93 % de identidad con la hSOD, y evalúa el comportamiento de cinco mutantes. En dos de ellos, Y34F-Q y Y34F-H, se reemplazó la tirosina 34 por fenilalanina y sólo diferían en la posición 143, ocupada por glutamina e histidina, respectivamente. Otros dos mutantes, S82A-Q y S82A-H, contenían alanina en la posición 82 en lugar de serina, e igualmente diferían en la posición 143, con glutamina e histidina, respectivamente. El quinto mutante, H143, sólo presentaba una histidina en lugar de la glutamina 143.
La variante salvaje, que contiene glutamina en la posición 143, y los mutantes, no presentaron diferencias en sus patrones electroforéticos, sus perfiles cromatográficos en condiciones desnaturalizantes, ni en los análisis realizados por espectrometría de masas.
Sin embargo, la actividad específica fue mayor para la enzima nativa, mientras el mutante H143 tuvo la menor actividad, que representó el 16 % de la determinada para la variante salvaje. Los mutantes simples Y34F-Q y S82A-Q retuvieron un 67 y un 81 % de la actividad y los dobles mutantes Y34F-H y S82A-H, presentaron un nivel de actividad específica similar a H143. Estos resultados sugieren que este residuo de glutamina es importante para la catálisis, al parecer para la fijación o estabilización de algún intermediario formado, pues no participa directamente en el mecanismo sino que influye en el microambiente del centro activo. Los residuos tirosina 34 y serina 82 no tienen un papel decisivo en este proceso.
También fue evaluada la resistencia a la temperatura de todas las especies enzimáticas, obteniendo la curva de inactivación y calculando el factor entrópico y entálpico de cada variante. En todos los casos la inactivación siguió una cinética de primer orden, con una temperatura de inactivación media de 80 0C, que no varió significativamente para los mutantes (79 0C, 81 0C), lo que evidencia que dichas sustituciones no afectan la alta resistencia a la temperatura de la enzima nativa, aunque H143 presentó el menor valor de factor entálpico y la menor temperatura de inactivación media que fue de 77 0C. De este experimento puede concluirse que la glutamina 143 también influye en la alta resistencia de la enzima a la inactivación por calor, al parecer por la estabilización de la conformación. Una tirosina en esa posición aumenta ligeramente la inactivación y una serina la disminuye, pues parece influir de forma positiva, en el establecimiento de una nueva conformación resistente a la temperatura (32).
Igualmente se verificó la influencia de estos residuos en la fosforilación de la enzima, principal mecanismo de regulación de la misma. Por reacción con quinasas in vitro, se identificó la serina 82 como blanco de esta modificación, pues no se detectan especies fosforiladas del mutante S82A-Q, sólo de la enzima nativa. Esta modificación de la serina 82 podría constituir un blanco de regulación importante, debido al grado de conservación que posee en otras SOD (32).
Otro aporte importante y reciente en este campo es realizado por Candas D. et al. en 2013 (33), quienes obtienen un mutante de la SOD2 denominado S106A, en el cual remplazan la serina 106 por alanina para evaluar el papel de dicho residuo en el reconocimiento por el complejo CyclinB1/Cdk1. Esta investigación toma como antecedentes algunos estudios de caracterización de la Cdk1, donde se han identificado determinados residuos de serina que constituyen sitios de fosforilación dentro de una secuencia consenso, en numerosas proteínas citosólicas que Cdk1 reconoce a nivel de dicha secuencia, mediante la cual ejerce su regulación por fosforilación, implicacada en múltiples procesos celulares (34, 35).
Análisis de estructura-función del mutante S106A, muestran como principales resultados la reducción de la actividad SOD2 en células murinas de músculo esquelético y cardíaco, extraídas de animales irradiados y transfectadas con S106A, respecto células control de los propios animales sometidos al mismo tratamiento, pero que expresan la SOD2 nativa, en las cuales la actividad representó el doble. También logran correlacionar dicha disminución con la inhibición de la fosforilación, mediante ensayos de detección de SOD2 fosforilada, por Western Blott, los cuales revelaron una disminución de la especie fosforilada de la enzima en las células transfectadas. Estos hallazgos en su conjunto, sugieren que la sustitución de la serina 106 por alanina en la SOD2 afecta el reconocimiento y la fosforilación por Cdk1, lo que disminuye la actividad enzimática, debido a que este residuo es requerido para la activación por modificación covalente de la SOD2 mediada por el complejo CyclinB1/Cdk1 (33).
Igualmente se han realizado investigaciones basadas en la obtención de quimeras entre isoformas de la SOD (36), que han permitido evaluar su función y dilucidar elementos estructurales de la SOD3 o SOD extracelular, entre los que se encuentran la demostración de la forma tetramérica activa para la SOD3 y su afinidad por heparina y heparán sulfato.
Estos investigadores logran expresar y purificar con un alto rendimiento, un mutante de la hSOD1 y la quimera hSOD1/3 (PseudoEC-SOD). El doble mutante monomérico de hSOD1, F50E/G51E, presenta una reducción de la actividad específica en un 90 % respecto a la enzima nativa, lo que demuestra la importancia de la fenilalanina 50 y la glicina 51 para la actividad de la hSOD1, las cuales a diferencia de las histidinas, no están directamente involucradas en el mecanismo catalítico sino que se encuentran expuestas en la interfaz de contacto entre monómeros de hSOD1.
Este experimento permite también determinar que el dímero está estabilizado por fuerzas hidrofóbicas y de van der Waals, pues la introducción de ácido glutámico, que es polar y cargado, en la interfaz de dimerización (en el doble mutante) reduce la actividad específica.
Dicho resultado se repite para la quimera triple mutante de PseudoEC-SOD, V24D/F50E/G51E, con la cual se confirma el papel de los residuos de fenilalanina y glicina en este caso para la heterodimerización, y además se comprueba que la sustitución de un aminoácido apolar alifático como la valina por uno polar con carga negativa como el ácido aspártico, reduce drásticamente la actividad catalítica, pues afecta la heterodimerización requerida para la dismutación de aniones superóxido (36).
También se ha estudiado el plegamiento específico del monómero de la enzima, el grado de exposición de ciertos residuos y cómo influyen sobre los mismos diferentes factores, empleando una técnica novedosa basada en la introducción de aminoácidos fluorescentes obtenidos por síntesis química, como la dansilalanina [ácido 2-amino-3 (5 (dimetilamino) naftaleno-1 sulfonamida) propanoico].
Dicha técnica se empleó con éxito para marcar la hSOD1 (37), para lo cual se transformaron por mutagénesis dirigida, los codones para la glutamina 16 y el triptófano 33 en codones de alanina, para luego incorporar en esas posiciones la dansilalanina y poder estudiar la conformación del plegamiento y la orientación de dichos residuos en el mismo.
Sin embargo la incorporación de un amino ácido no natural a una proteína es un procedimiento complejo, que requirió en este caso, del empleo de un RNA de transferencia y su Aminoacil-tRNA Sintetasa, (tRNALeu5/LeuRS) provenientes de una cepa de E. coli, supresora de tRNA/ leucil-tRNA, para expresarlos en levadura, donde constituyen proteínas ortogonales que no reaccionan con las Aminoacil-tRNA Sintetasas ni con los tRNA endógenos. Luego fue necesario generar una biblioteca de mutantes para Leucil-tRNA Sintetasa, en residuos del centro activo y del sitio editor, con el objetivo de modificar la especificidad de esta enzima por la leucina y lograr que incorporara la dansilalanina.
Una vez ingenierizado este sistema de incorporación, los investigadores introdujeron la secuencia de la hSOD1 con cada mutación (Q16A y W33A) en la cadena SCY4 de levadura, y pudieron obtener proteínas fluorescentes con un alto rendimiento. El estudio de desplegamiento y renaturalización las hSOD mutantes a diferentes concentraciones de cloruro de guanidinio, permitió determinar que los residuos 16 y 33 se encuentran ocluidos en el interior de la enzima nativa, interactuando con el núcleo de hoja β y que el triptófano 33 es altamente afectado por algunos factores desnaturalizantes, como la presencia de un agente caotrópico, por lo que constituye un residuo implicado en la estabilidad del monómero (37).
Otros aspectos de interés, como la capacidad de dimerización y el rol del triptófano 33 en este proceso, no pudieron ser evaluados por el empleo del agente caotrópico, sin embargo sería relevante estudiar la conformación del dímero empleando esta técnica de fluorescencia, pero en condiciones no desnaturalizantes.
Una segunda línea de investigación sobre mutagénesis dirigida aplicada a la SOD, se ha encaminado a obtener mutantes típicos que se relacionan con determinadas patologías, para evaluar en modelos animales de estas enfermedades el papel de la SOD en la génesis y agravamiento de las mismas.
En este sentido, son de gran importancia los resultados obtenidos por Gurney M. et al. en 1994 (38) y Banci L. et al. en 2008 (39), quienes demuestran la expresión de los mutantes de hSOD1, G93A y G94A, en la ELA. Estos resultados confirman la presencia de agregados fibrilares y no funcionales de hSOD1, lo que evidencia la relación entre la introducción de glicina en las posiciones 93 y 94, y la tendencia a la agregación, en la cual los puentes de hidrógeno juegan un papel decisivo.
Sobre esta temática, algunas investigaciones más recientes correlacionan la expresión del mutante SOD1-G93A en modelos murinos, con la activación de la quinasa MST1 por especies reactivas del óxigeno, que se acumulan debido la deficiencia de la actividad SOD1 provocada por la agregación fibrilar (31). Los resultados obtenidos muestran una elevada actividad MST1 en motoneuronas en cultivo y en modelos de ratón y rata, en los que se ha inducido la expresión de la SOD1 mutante.
También permiten caracterizar el mecanismo de inducción de la apotosis por MST1, el cual se identifica como una autofagia mitogénica que depende de la activación de la proteína p38, la vía de las MAP Quinasas y las Caspasas (31).
Por otra parte, lo planteado por Seijffers R. et al. en el 2013 (40), sugiere que el factor de transcripción ATF3 tiene un efecto neuroprotector y antiapoptótico en modelos murinos para SOD1-G93A, lo que está mediado por regeneración axónica y muscular, que contribuye a minimizar los efectos de peroxidación y pérdida de estructuras celulares, causados por la afectación en la actividad SOD1. Estos estudios aportan conocimientos de vital importancia en el establecimiento de una terapia para la ELA.
2.2. Modificaciones químicas
Aunque los estudios de mutagénesis dirigida han tenido el protagonismo en los análisis de estructura-función de la hSOD, la modificación química de residuos ha contribuido a la comprensión del funcionamiento de la enzima en determinadas condiciones fisiológicas, así como la evaluación de la influencia de las modificaciones naturales que ésta puede sufrir, sobre su funcionamiento.
Weisiger R. y Fridovich I. en 1973 (41), realizaron varias modificaciones que contribuyeron a la caracterización de las dos principales isoformas de la SOD aislada de hígado de pollo, y muchos de sus hallazgos han sido demostrados para las isoformas de la hSOD. Estas modificaciones comprenden el tratamiento con cianuro, β-mercaptoetanol, dimetilsulfóxido, p-cloromercurifenil sulfonato, la hidrólisis ácida total con HCl a una concentración de 6 M y la oxidación con ácido perfórmico.
El cianuro inhibe la trasferencia de electrones a nivel de los átomos de cobre del centro activo en la SOD1, pero no tiene efecto sobre la SOD2 debido que el sitio activo presenta manganeso. Este tratamiento químico permitió diferenciar las dos isoformas, citosólica y mitocondrial, de la SOD y confirmar la composición de cobre y manganeso de cada enzima, que ya había sido encontrada en otras SOD de bacterias y de plantas. Por su parte, el β-mercaptoetanol, un agente reductor fuerte, fue de gran utilidad en el estudio de las subunidades de la enzima, junto con el detergente aniónico Dodecil Sulfato de Sodio (SDS, por sus siglas en inglés), siendo este trabajo uno de los primeros en plantear la estructura dimérica para SOD1 y la tetramérica para SOD2. También evidenció que la dimerización de SOD1 y SOD2 no ocurría por puentes disulfuro, sólo en condiciones muy oxidantes del medio y conllevaban a agregados multienzimáticos no activos, aunque en SOD2 si se formaban puentes disulfuro intracatenarios (41).
La hidrólisis total con HCl fue empleada para el análisis de la composición aminoacídica de la SOD1 y la SOD2, donde además se empleó para la SOD1, el tratamiento con dimetilsulfóxido y la oxidación con ácido perfórmico, para identificar las cisteínas presentes en dicha isoforma. La identificación de grupos sulfidrilos por subunidad, fue realizada con p-cloromercurifenil sulfonato y arrojó como resultado 1,2 grupos por subunidad, lo que se reducía a 0,3 grupos en la enzima autoxidada y mantenida en una solución de fosfato de potasio a 0,05 M y EDTA, pH=7,8 por 2 semanas. Este resultado indica que la autoxidación de la SOD1 disminuye su reactividad, en términos de grupos sulfidrilos accesibles a un modificador químico (41).
Por otra parte, han sido evaluados algunos factores que influyen sobre la catálisis de la SOD1 de eritrocitos bovinos, tales como la oxidación (42). La inhibición de la SOD1 por su producto, H2O2, fue examinada en términos de la oxidación de la histidina 118, ubicada en el centro catalítico, lo que redujo significativamente la actividad. El residuo oxidado en forma de 2-oxo-histidina, pudo ser detectado por hidrólisis ácida y análisis de la composición aminoacídica de la SOD1 por RP-HPLC, que después se identificó en la posición 118 por mapeo tríptico y análisis peptídico por RP-HPLC. El estudio de modificación selectiva de histidina con H2O2, demostró la importancia de este residuo en el mecanismo catalítico de la enzima y su implicación en la inactivación por producto.
Una de las mayores aplicaciones de la modificación química en la SOD, constituye el mejoramiento de la enzima para su uso terapéutico, que se propone extender el tiempo de vida media en sangre, minimizar la inactivación y mejorar la estabilidad en condiciones fisiológicas.
Sobre este tema tratan los trabajos de Veronese F. et al. en 1985 (43), que describen un método factible para la obtención de conjugados de monometoxi-polietilen glicol con proteínas y péptidos, empleando derivados fenilcarbonados de polietilen glicol (PEG). Estos derivados altamente reactivos, pueden lograrse mediante reacción con 2,4,5-tricloro-fenilcloroformiato o p-nitrofenilcloroformiato.
Empleando dicho procedimiento, obtienen un derivado SOD1-PEG que posee mayor tiempo de retención en sangre en ratas a las cuales les fue administrado por vía endovenosa, respecto a la SOD1 nativa, la cual es aclarada rápidamente por los riĖones y detectada en la orina de los animales. La conjugación con polímeros aumenta el radio de la molécula, lo que disminuye su aclaramiento por filtración en el glomérulo renal y además preserva frente a la acción de proteasas (43).
La enzima modificada es menos inmunogénica y es reconocida con baja afinidad por anticuerpos específicos, debido a que el PEG modifica múltiples grupos amino en la proteína, por lo que logra bloquear epítopos que afectan el reconocimiento. Esto puede constituir una ventaja si se desea administrar enzimas no humanizadas o en forma quimérica directamente en la sangre, con poco rechazo inmunológico. También se evaluó la actividad del derivado, la cual no varió significativamente del control no modificado, evidenciando que la conjugación no afecta los residuos del centro activo ni la conformación nativa (43).
La modificación con PEG o pegilación como herramienta para mejorar las propiedades de las isoformas de la SOD, ha sido también aplicada en la optimización de una terapia experimental en modelos de rata para la Isquemia Cerebral (44). La inyección intravenosa de 10,000 U/kg de PEG-SOD disminuye el volumen de infarto a 139 +/- 9 mm3, respecto a un control tratado con placebo, en el cual fue de 182 +/- 8 mm3, resultados que fueron determinados para un total de 38 individuos.
Estos resultados confirman el efecto protector y de estabilidad conferido al PEG, y constituyen más hallazgos que relacionan la SOD con enfermedades inflamatorias y lesiones tisulares.
Un enfoque interesante sobre la misma aplicación, es planteado por Fujita T. et al. en 1992 (45), donde exponen cómo es posible mejorar la estabilidad en plasma de la SOD humana recombinante (hSODr) y dirigir su acción a tejidos específicos, empleando la conjugación con polisacáridos y monosacáridos. Mediante la síntesis de cuatro derivados diferentes, hSOD-carboximetil dextrano, hSOD-dietilaminoetil dextrano, hSOD galactosilada y hSOD manosilada, evaluaron el tiempo de vida en plasma y la distribución de los productos modificados por farmacocinética en modelo de ratón, así como la actividad de los conjugados.
Los derivados obtenidos retuvieron de un 50 a un 80 % de la actividad enzimática original y fueron estables en una incubación con suero de ratón, manteniendo un 80 % de la actividad por 3 horas, lo que indica que la modificación no afecta la actividad y los conjugados no son neutralizados por anticuerpos murinos. La administración por vía intravenosa de la hSODr nativa conllevó a una rápida eliminación por vía renal, siendo detectada en alta concentración en la orina, mientras la hSOD-carboximetil dextrano presentó un elevado tiempo de vida media en plasma, debido a la no filtración glomerular y a la interacción con los tejidos. Las formas galactosilada y manosilada de la hSOD fueron incorporadas en poco tiempo a las células parenquimatosas y no parenquimatosas del hígado, por endocitosis mediada por receptor. La cinética de este aclaramiento hepático presentó un comportamiento no lineal, disminuyendo con incrementos en la dosis, con un valor máximo a la dosis mínima de 0.1 mg/kg (45).
Por otra parte, la hSOD-dietilaminoetil dextrano se acumuló rápidamente en hígado, pero esta retención fue de tipo electróstático y constituye un mecanismo de captación menos específico (45).
En conjunto, estos resultados validan la modificación con compuestos mono y polisacarídicos, no sólo en el mejoramiento de la estabilidad y el tiempo de vida media en plasma de la hSODr, sino en su biodistribución. Esta aplicación aporta ventajas claras para las terapias basadas en la administración exógena de hSOD, la cual requiere la acción selectiva de la enzima en las lesiones tisulares y zonas localizadas de inflamación.
En este campo también se ha probado la modificación de la SOD con otros polímeros, como el copolímero de éter divinilo y anhídrido maleico (DIVEMA, por sus siglas en inglés), lo que produce conjugados con buena retención de la actividad, que mostraron mayor tiempo de vida media y una captación incrementada en el hígado, en modelo de rata para edema pulmonar con reperfusión bronquial. Dichos conjugados fueron capaces de reducir los procesos inflamatorios intrahepáticos, proteger contra el edema bronquial y evitar la infiltración leucocitaria en los vasos sanguíneos, lo que fue evaluado por microscopía electrónica (46).
De igual forma la conjugación de la SOD con la sal sódica del ácido hialurónico se ha logrado con éxito, empleando la modificación por enlaces amida entre los grupos amino de la proteína y los grupos carboxilo del ácido hialurónico, con el uso de la 1-etil-3-(3-dimetil aminopropil) carbodiimida. (47). Los derivados resultantes retuvieron un 70 % de la actividad enzimática original y manifestaron un elevado efecto antiinflamatorio y no inmunogénico, en modelo de rata para edema de la pata inducido por la carragenina y para artritis adyuvante.
Otras estrategias, basadas en la conjugación de la hSOD1 a proteínas séricas por modificación de residuos, también han ofrecido buenos resultados, en términos del aumento del radio de la enzima y por tanto la reducción del aclaramiento renal y la eliminación en la orina (48). El conjugado entre la hSOD1 y la albúmina sérica se forma espontáneamente en sangre al suminstrar la hSOD1 modificada en sus residuos de lisina con AMS [poli-(ácido maléico-co-estireno) butil éster].
La modificación química fue evaluada in vitro, por cromatografía de afinidad con una matriz de albúmina-sefarosa, que demostró retención específica de la AMS-hSOD1, mientras la hSOD1 nativa fue eluída en la fracción no fijada. La evaluación in vivo en modelos animales, reveló un incremento en el tiempo de vida media en plasma de la AMS-hSOD1, que fue de 6 horas, respecto a la enzima no modificada que fue eliminada por la orina en menos de 4 minutos. Adicionalmente, la medición de radicales libres plasma evidenció una disminución, respecto a los animales tratados con la hSOD1 nativa, lo que valida este producto modificado para la reducción de radicales libres circulantes (48).
Algunas investigaciones más recientes, demuestran la eficacia de la modificación de la SOD con polisacáridos iónicos tales como la carboximetil quitina, el manano (49) y la carboximetil celulosa (CMC) (50), siendo esta última modificación factible de realizar, por alquilación reductiva con el derivado polialdehídico de la CMC o con la carbodiimida como agente acoplante. Estos derivados polisacarídicos de SOD retuvieron una actividad mayor del 50 % y presentaron óptimos resultados farmacocinéticos en modelos de ratón y rata.
2.3. Inmovilización covalente
Debido a que la SOD cataliza una reacción muy específica, en la que el anión superóxido no puede ser remplazado por un sustrato sintético con vistas a obtener un producto para uso industrial o de interés biomédico, no ha existido un desarrollo marcado en el área de la biocatálisis y los bioprocesos, vinculado a esta enzima. Más bien la alta especificidad de la proteína y la generación de un producto (H2O2), detectable y cuantificable por técnicas espectrofotométricas, quimioluminiscentes y otras, ha propiciado que la principal aplicación de la inmovilización covalente de esta enzima, haya sido la obtención de biosensores para medir el estrés oxidativo y los radicales libres en sistemas biológicos.
Debido a esto, las principales propuestas de inmovilización de la SOD para aplicaciones concretas, han estado basadas en la fijación covalente, mediante reactivos bifuncionales tales como el glutaraldehído, a micropelículas formadas por ácidos orgánicos, polisacáridos, polímeros industriales u orgánicos, recubriendo superficies metálicas de electrodos de oro o platino, así como nanopartículas con diversas propiedades que constituyen la base de estos biosensores (Figura 4).
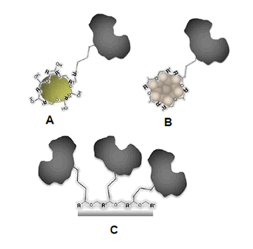
Figura 4. Principales configuraciones de inmovilización covalente, que se han empleado en el trabajo con la SOD. A) Sobre nanopartículas de oro recubiertas de polisacáridos o ácidos orgánicos. B) Sobre nanopartículas de óxidos metálicos modificadas con polímeros orgánicos. C) Sobre micropelículas poliméricas que recubren electrodos metálicos.
En 2001, Ge B. et al. (51), desarrollan un biosensor, inmovilizando la SOD1 de eritocitos bovinos en un electrodo de oro modificado con ácido 3-mercaptopropiónico (AMP) a partir de la 2-mercaptoetilamina (MEA) fijada al electrodo con un tratamiento extremo a base de ácido sulfúrico. El oro modificado puede incorporar la enzima, por reacción con 1-Etil-3(3-dimetil aminopropil) carbodiimida (EDC). Se obtuvo una repuesta electroquímica pronunciada y sostenida por parte de la SOD1 inmovilizada, con un potencial de 56 +/- 9 mV, en tampón de baja fuerza iónica y libre de proteínas, a pH 7,5. Este resultado indica una transformación redox cuasirreversible, por parte de la enzima sobre la superficie de oro.
Aunque se constató cierta pérdida de actividad por parte de la proteína, se mantiene la sensibilidad necesaria para la función del biosensor. El empleo de un modificador de mayor longitud podría solucionar esta deficiencia, al permitir una mayor interacción proteína-electrodo (51).
Un acercamiento similar a esta aplicación es descrito por Endo K. et al. en 2002 (52), con la obtención de un biosensor a partir de SOD2 inmovilizada en un electrodo de platino con el empleo de glutaraldehído y un mediador para el transporte de electrones, compuesto por ferrocen-carboxaldehído, cianamida y albúmina bovina. El sistema completo fue recubierto con poliuretano como protección adicional.
Este biosensor se empleó para cuantificar aniones superóxido en solución, generados por la Xantina Oxidasa en presencia de xantina, mediante una corriente eléctrica, acoplando el electrodo a un sistema de detección. En las soluciones evaluadas la seĖal del sensor creció linealmente, de forma proporcional a las cantidades de xantina aĖadida, lo que evidencia la precisión de las mediciones. También se determinó la capacidad de detección del sensor a partir de tejido cardíaco de ratas inyectadas con endotoxina, resultando en una medición estable con valores elevados, en concordancia con la situación de estrés oxidativo generada (52).
En otras investigaciones se ha combinado la mutagénesis dirigida y la inmovilización, para lograr métodos factibles y eficientes de fijación covalente de la SOD1 a superficies de oro, con aplicación en la construcción de biosensores (53). En este trabajo se obtienen 6 mutantes monoméricos en los que se han introducido una o dos cisteínas adicionales, lo que permite inmovilizar la enzima mediante grupos sulfidrilos en una superficie de oro, sin necesidad de recubrimiento orgánico ni otros modificadores. Un biosensor obtenido por este principio fue evaluado en la determinación de radicales superóxido, mostrando una mayor sensibilidad que los electrodos de Citocromo C clásicos (53), sin interferencias, pero sin alcanzar la sensibilidad del sensor de oro modificado con AMP a partir del dímero de SOD1 inmovilizado.
La otra aplicación fundamental, de carácter más reciente en el campo de la inmovilización de la SOD, es la fijación a nanopartículas metálicas (Figura 4, A y B).
En este sentido destaca el trabajo de Villalonga R. et al. en 2005 (54), con la obtención de nanopartículas de oro pertioladas y recubiertas de β-ciclodextrina, que permiten la inmovilización supramolecular de la SOD1 con alta retención de la actividad. Este dispositivo tiene potencialidades para ser empleado en futuras terapias contra el estrés oxidativo.
También se han obtenido biosensores para radicales a partir de la SOD inmovilizada en nanopartículas de óxido de níquel, que a su vez se retienen por electrodeposición con voltametría cíclica en un electrodo de fibra de carbono modificado (55). El sensor obtenido por este método, mantiene un proceso redox bien definido con un potencial de −0,03 V en pH 7,4. La SOD inmovilizada presentó un recubrimiento superficial (I) y una constante de transferencia electrónica heterogénea (ks) de 1,75 × 10−11 mol/ cm2 y 7,5 Ī 0,5 s−1, respectivamente. En general, el biosensor exhibió una respuesta amperométrica muy rápida (3 s) en un rango de concentraciones de anión superóxido de 10 μM a 0,25 mM, una alta sensibilidad (12,40 nA μM−1 cm−2) y un límite de detección de 2,66 μM. Este dispositivo muestra elevada estabilidad, reproducibilidad y tiempo de vida (54), lo que valida las nanopartículas de óxidos metálicos como portadores eficientes de SOD inmovilizada, para determinaciones amperométricas de radicales sin interferencias.
Otra aplicación importante de la SOD en el campo de la nanotecnología, fue aportada por Song C. et al. en 2012 (55), que inmovilizan por medio de glutaraldehído, la SOD2 termoestable aislada del organismo Thermus thermophilus, en nanopartículas supermagnéticas de óxido de hierro y silicio modificadas con polímeros orgánicos.
Las partículas con la enzima incorporada fueron caracterizadas por difracción de rayos X, microscopía electrónica de transmisión y análisis magnetométrico. Se registró un diámetro de 40 Ī 5 nm y un valor de saturación de magnetización de 27,9 emu/g, sin remanencia o coersitividad. En comparación con la enzima libre, la SOD2 inmovilizada presentó mayor resistencia a la temperatura, pH, iones metálicos, inhibidores enzimáticos y detergentes (55). Otros resultados mostraron que la enzima puede ser reutilizada 10 veces sin pérdida significativa en la actividad, lo que evidencia la factibilidad de este método de inmovilización y la estabilidad que brinda el anclaje químico a nanopartículas (55). Estos nanodispositivos ofrecen ventajas en la biomedicina y otras aplicaciones industriales basadas en la SOD2.
2.4. Atrapamiento y microencapsulación
La encapsulación en estructuras poliméricas y liposomas, así como el atrapamiento en geles y polímeros proteicos (Figura 5), también han encontrado su aplicación en el trabajo con la SOD, siendo empleados tanto para la obtención de biosensores como para el mejoramiento terapéutico y la liberación controlada de la enzima.
En algunos experimentos se ha realizado el atrapamiento de SOD y Xantina Oxidasa en matrices de gelatina entrecruzada con glutaraldehído (56), creando sistemas estables de porosidad controlada (Figura 5A) que permiten la difusión de sustratos y constituyen modelos para la generación y evaluación de radicales libres.
Campanella L. et al. en 1999 (57) obtuvieron un biosensor a partir de la SOD atrapada en geles de κ-carrageno sobre electrodos indicadores, probando con electrodos de Clark y con electrodos amperométricos clásicos para H2O2, resultando estos últimos, más efectivos. El biosensor fue evaluado in vitro con el sistema xantina/Xantina Oxidasa y permitió la caracterización de otras proteínas antioxidantes en cuanto a su efecto sobre el anión superóxido.
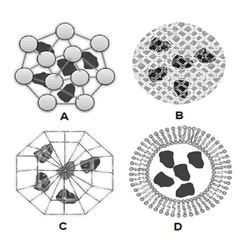
Figura 5. Representación esquemática de cuatro formas de inmovilización mediada por atrapamiento que se han empleado en la caracterización y optimización de la SOD. A) Atrapamiento en una red proteica entrecruzada con glutaraldehído. B) Atrapamiento en gel. C) Microencapsulación en cristal de sílica porosa. D) Encapsulación en liposomas.
Un acercamiento más actual a esta aplicación es descrito por Emregul E. en 2005 (58), quien logra un biosensor para aniones radicales, atrapando la SOD en gelatina reforzada por entrecruzamiento con glutaraldehído sobre la superficie de un electrodo de platino. El sensor fue evaluado en varias condiciones de pH y fuerza iónica, manteniendo una medición estable, proporcional a la concentración de O2-, con un límite de detección de 0,01 mmol L−1 y una relación seĖal/ruido de 3. El dispositivo retuvo de un 80 a un 60 % de su sensibilidad tras el uso por 4 semanas, demostrando que la gelatina brinda un microambiente estable y biocompatible con la SOD, que mantiene la actividad enzimática de forma eficiente (58). Algunas aplicaciones directas en las que este biosensor pudo ser probado, fueron la evaluación de la capacidad antioxidante de drogas derivadas de ácido acetilsalicílico y la determinación del estrés oxidativo en tejido cerebral tumoral y sano (58).
La microencapsulación ofrece también ventajas atractivas para el estudio de la SOD en microambientes controlados y para posibles aplicaciones terapéuticas. Un ejemplo lo constituye el atrapamiento de la SOD1 en microcápsulas de cristal de sílica porosa (Figura 5C), obtenido por el método sol-gel (59). Estas microcápsulas se logran con condiciones poco drásticas, lo que permite el mantenimiento de una elevada actividad enzimática en su interior. Además son porosas lo que permite el intercambio de sustancias pero impide la pérdida de la enzima, y son transparentes, lo que facilita el seguimiento de las propiedades ópticas de las proteínas encapsuladas.
Por otra parte la encapsulación de la SOD en liposomas (Figura 5D) ha logrado mejorar la biodistribución y preservar la estabilidad, siendo efectiva como estrategia terapéutica. La SOD1 recombinante encapsulada en liposomas fue utilizada en el tratamiento de heridas por quemaduras (60), demostrando una reducción de las lesiones tisulares, el edema y la necrosis local, así como un incremento en la reepitelialización y la cicatrización en pacientes tratados, respecto a pacientes control que recibieron placebo.
Igualmente se ha constatado la efectividad de liposomas recubiertos de PEG como sistemas portadores de SOD1, que permiten su liberación controlada en sitios artríticos inflamados, en pacientes y modelos murinos de artritis reumatoide, mediando una disminución de la inflamación y del depósito de inmunocomplejos (61).
Otra aplicación referida a la encapsulación de la SOD en liposomas, es descrita por Pluta J. y Karolewicz B. en 2003 (62), que encapsulan la enzima en liposomas obtenidos a partir de lecitina de soya, estearilamina, fosfatidilglicerol y colesterol, recubiertos de quitosano, un polisacárido biocompatible de uso industrial y biomédico. Este recubrimiento funciona como mucoadhesivo por su alta hidratación, permitiendo al liposoma depositarse y liberar su contenido en las mucosas (62). Estos preparados han mostrado alta retención de la actividad SOD y ofrecen propiedades útiles, desde el punto de vista terapéutico para el tratamiento de inflamación y lesiones mucosales, así como para algunas hipersensibilidades que ocurren a nivel de las mucosas (62).
Una aplicación similar es lograda por Domínguez A. et al. en el 2004 (63), quienes logran un sistema de liberación controlada de la SOD, atrapándola en hidrogeles de CMC. Éste constituye uno de los primeros intentos de inmovilización por atrapamiento de la SOD en hidrogeles, para uso biomédico. Dicho sistema se logró por adición estequiométrica de 2-cloro-1-metilpiridin ioduro (CMP-I) a la solución de la enzima con CMC. El preparado retuvo la actividad enzimática de forma eficiente y mejoró las propiedades farmacológicas respecto a la enzima nativa (63). La cinética de liberación fue determinada, presentando una liberación de un 50 % a las 72 horas. Este sistema basado en hidrogeles de entrecruzamiento intermedio (54 %), promueve además la proliferación de fibroblastos humanos en cultivo, pues su estructura porosa y esponjosa provee un ambiente adecuado que actúa como soporte para las células adherentes, que no es muy reticulado o compacto, lo que permite el crecimiento (63).
Los resultados expuestos reafirman los sistemas de liberación controlada de SOD basados en hidrogeles, como herramientas útiles en la farmacología y la terapia, que disminuyen el estrés oxidativo y promueven la proliferación de fibroblastos y la reparación tisular.
3. PERSPECTIVAS TERAPÉUTICAS
Como se ha abordado en esta revisión, las principales técnicas de ingeniería de proteínas encaminadas al trabajo con las isoformas de la SOD, han permitido su caracterización, el análisis estructura-función y el desarrollo de algunas aplicaciones terapéuticas para afecciones relacionadas al estrés oxidativo. Se han evaluado las tres isoformas de esta proteína y se ha establecido, tanto su función biológica, como su implicación en determinadas patologías, por lo que las perspectivas de investigación actuales relacionadas con la SOD, están dirigidas al mejoramiento de la enzima para implementar terapias basadas en la administración exógena.
Las principales deficiencias de estas estrategias terapéuticas, radican en la baja estabilidad de la enzima, la imposibilidad de dirigirla a un blanco específico, la susceptibilidad a la inactivación y la proteólisis, y la rápida excreción por vía renal, que limita el tiempo de vida media en sangre. Algunas de las técnicas de modificación con polisacáridos, PEG y otros polímeros orgánicos, así como la microencapsulación y el atrapamiento, parecen resolver algunos de estos inconvenientes y en general elevan la permanencia en plasma y protegen contra la inactivación, la proteólisis y la neutralización por anticuerpos. Sin embargo la terapia basada en administración de SOD aún afronta retos, como el mejoramiento de la biodistribución y un mayor tiempo de vida media, que permita minimizar las dosis y emplear esta enzima como adyuvante para múltiples terapias combinadas, o como producto de uso tópico y sistémico, para variados trastornos isquémicos, vasculares, neurodegenerativos, autoinmunes e incluso el cáncer.
La combinación de sistemas de liberación controlada y modificación con sustancias biocompatibles, junto con las tecnologías de acoplamiento de anticuerpos o nanopartículas, ofrecen opciones atractivas y promisorias en cuanto a la ingenierización de esta proteína y la búsqueda de un producto antioxidante eficiente para uso clínico.
4. REFERENCIAS
1. Roberts, BR, Tainer, JA, Getzoff, ED, Malencik, DA, Anderson, SR, Bomben, VC. Structural characterization of zinc-deficient human superoxide dismutase and implications for ALS. J Mol Biol 2007; 373: 877-890.
2. Medinas, DB, Gozzo, FC, Santos, LF, Iglesias, AH, Augusto, O. A ditryptophan cross-link is responsible for the covalent dimerization of human superoxide dismutase 1 during its bicarbonate-dependent peroxidase activity. Free Radic Biol Med 2010; 49: 1046-1053.
3. Enayat, ZE, Orrell, RW, Claus, A, Ludolph, A, Bachus, R, Brockmueller, J. Two novel mutations in the gene for copper zinc superoxide dismutase in UK families with amyotrophic lateral sclerosis. Hum Mol Genet 1995; 4: 1239-1240.
4. Banci, L, Benedetto, M, Bertini, I, del Conte, R, Piccioli, M, Viezzoli, MS. Solution structure of reduced monomeric Q133M2 copper, zinc superoxide dismutase (SOD). Why is SOD a dimeric enzyme? Biochemistry 1998; 37: 11780-11791.
5. Marin, EP, Derakhshan, B, Lam, TT, Davalos, A, Sessa, WC. Endothelial cell palmitoylproteomic identifies novel lipid-modified targets and potential substrates for protein acyl transferases. Circ Res 2012; 110: 1336-1344.
6. Lin, ZF, Xu, HB, Wang, JY, Lin, Q, Ruan, Z, Liu, FB. SIRT5 desuccinylates y activates SOD1 to eliminate ROS. Biochem. Biophys. Res Commun 2013; 441: 191-195.
7. Kajihara, J, Enomoto, M, Nishijima, K, Yabuuchi, M, Katoh, K. Comparison of properties between human recombinant and placental copper-zinc SOD. J Biochem 1988; 104: 851-854.
8. Arnesano, F, Banci, L, Bertini, I, Martinelli, M, Furukawa, Y, O'Halloran, TV. The unusually stable quaternary structure of human Cu,Zn-superoxide dismutase 1 is controlled by both metal occupancy and disulfide status. J Biol Chem 2004; 279: 47998-48003.
9. Barra, D, Schinina, M, Simmaco, M, Bannister, J, Bannister, W, Rotilio, G. The primary structure of human liver manganese superoxide dismutase. J Biol Chem 1984; 259: 12595-12601.
10. Perry, J, Herna, A, Cabelli, D, Nick, H, Tainer, J, Silverman, D. Contribution of human manganese superoxide dismutase tyrosine 34 to structure and catalysis. Biochemistry 2009; 48: 3417-3424.
11. Choudhary, C, Kumar, C, Gnad, F, Nielsen, M, Rehman, M, Walther, TC. Lysine acetylation targets protein complexes and co-regulates major cellular functions. Science 2009; 325: 834-840.
12. Goitre, L, Balzac, F, Degani, S, Degan, P, Marchi, S, Pinton, P. KRIT1 regulates the homeostasis of intracellular reactive oxygen species. Plos One 2010; 5: 11786-11786.
13. Xu, S, Ying, J, Jiang, B, Guo, W, Adachi, T, Sharov, V. Detection of sequence-specific tyrosine nitration of manganese SOD and SERCA in cardiovascular disease y aging. J Physiol 2006; 290: 2220-2227.
14. Nomiyama, T, Tanaka, Y, Piao, L, Nagasaka, K, Sakai, K, Ogihara, T. The polymorphism of manganese superoxide dismutase is associated with diabetic nephropathy in Japanese type 2 diabetic patients. Hum Genet 2003; 48: 138-141.
15. Nozik-Grayck, E, Suliman, H, Piantadosi, C. Extracellular superoxide dismutase. Int J Biochem Cell Biol 2005; 37: 246-247.
16. Antonyuk, S, Strange, R, Marklund, S, Hasnain, S. The structure of human extracellular copper-zinc superoxide dismutase at 1.7 A0 resolution: insights into heparin and collagen binding. J Mol Biol 2009; 388: 310-326.
17. Liu, T, Qian, WJ, Gritsenko, MA, Camp, DG, Monroe, ME, Moore, RJ. Human plasma N-glycoproteome analysis by immunoaffinity subtraction, hydrazide chemistry, and mass spectrometry. Proteome Res 2005; 4: 2070-2080.
18. Oberley, L. Free radicals and diabetes. Free Rad Biol Med 1988; 5: 13–124.
19. Williamson, JR, Chang, K, Frangos, M. Hyperglycemic pseudohypoxia and diabetic complications. Diabetes 1993; 42: 801–813.
20. Szaleczky, E, Prechl, J, Fehér, J, Somogyi, A. Alterations in enzymatic antioxidant defense in diabetes mellitus-a rational approach. Postgrad Med J 2000; 75: 13-17.
21. Tagami, S, Kondo, T, Yoshida, K, Hirokawa, J, Ohtsuka, Y, Kawakami, Y. Effect of insulin on impaired antioxidant activities in aortic endothelial cells from diabetic rabbits. Metabolism 1992; 41: 1053–1058.
22. Oberley, L, Bueftner, G. Role of Superoxide Dismutase in Cancer: A Review. Cancer Research 1979; 39: 1141-1149.
23. Peskin, A, Koen, Y, Zbarsky, I. Superoxide dismutase y glutathione peroxidase activities in tumors. Febs Left 1977; 78: 41-45.
24. Sahu, S, Oberley, L, Stevens, R, Riley, E. Superoxide dismutase activity of Ehrlich ascites tumor cells. J Nat I Cancer Inst 1977; 58: 1125-1128.
25. Yamanaka, N, Ota, K, Utsumi, K. Changes in superoxide dismutase activity using development, aging and transformation. In: Hayishi, O, Asada, K, Eds. Biochemical and medical aspects of active oxygen. Tokyo: University of Tokyo Press 1977; pp. 183-90.
26. Cullen, J, Weydert, C, Hinkhouse, M. The Role of Manganese Superoxide Dismutase in the Growth of Pancreatic Adenocarcinoma. Cancer Reserch 2003; 63: 1297-1303.
27. Fernández, J, Oliva, B, Tejeda, Y, Astrada, S, Garay, H, Reyes, O. The Antitumor Peptide CIGB-552 Increases COMMD1 and Inhibits Growth of Human Lung Cancer Cells. J Amino Acids 2013; 251398.
28. Edwards, S, Tolkovsky, A. Characterization of apoptosis in cultured rat sympathetic neurons after nerve growth factor withdrawal. J Cell Biol 1994; 124: 965-972.
29. Greenlund, L, Deckwerth, T, Johnson, E. Superoxide Dismutase Delays Neuronal Apoptosis: A Role for Reactive Oxygen Species in Programmed Neuronal Death. Neuron 1995; 14: 303-315.
30. Araujo, J, Breuer, P, Dieringer, S, Krauss, S, Dorn S, Zimmermann, K. FOXO4-dependent upregulation of superoxide dismutase-2 in response to oxidative stress is impaired in spinocerebellar ataxia type 3. Human Molecular Genetics 2011; 20: 2928-41.
31. Lee, J, Shin, J, Hwang, S, Gwag, B, McKee, A, Junghee Lee. MST1 functions as a key modulator of neurodegeneration in a mouse model of ALS. PNAS. 2013; 110: 12066-71.
32. Castellano, I, Cecere, F, Vendittis, A, Cotugno, R, Chambery, A, Di Maro, A. Rat Mitochondrial Manganese Superoxide Dismutase: Amino Acid Positions Involved in Covalent Modifications, Activity, and Heat Stability. Biopolymers 2009; 91: 1215-26.
33. Candas, D, Fan, M, Nantajit, D, Vaughan, A, Murley, J, Woloschak, G. CyclinB1/Cdk1 phosphorylates mitocondrial antioxidant MnSOD in cell adaptive response to radiation stress. Journal of Molecular Cell Biology 2013; 5: 166–175.
34. Ubersax, J, Woodbury, E, Quang, P. Targets of the cyclin-dependent kinase Cdk1. Nature 2003; 425: 859–864.
35. Rudner, A, Murray, A. Phosphorylation by Cdc28 activates the Cdc20-dependent activity of the anaphase-promoting complex. J Cell Biol 2000; 149: 1377–1390.
36. Stenlund, P, Tibell, L. Chimeras of human extracellular y intracellular superoxide dismutases. Analysis of structure y function of the individual domains. Protein Engineering 1999; 12: 319–325.
37. Summerer, D, Chen, S, Wu, N, Deiters, A, Chin, J, Schultz, P. A genetically encoded fluorescent amino acid. PNAS 2006; 103: 9785-9789.
38. Gurney, M. et al. Motor neuron degeneration in mice that express a human Cu,Zn superoxide dismutase mutation. Science 1994; 264: 1772–1775.
39. Banci, L, Bertini, I, Boca, M, Girotto, S, Martinelli, M, Valentine, J.S. et al. SOD1 and amyotrophic lateral sclerosis: mutations and oligomerization. Plos One 2008; 3: e1677.
40. Seijffers, R, Zhang, J, Matthews, J, Chen, A, Tamrazian, E, Babaniyi, O, et al. ATF3 expression improves motor function in the ALS mouse model by promoting motor neuron survival and retaining muscle innervation. PNAS 2013; 111: 1622-7.
41. Weisiger, R, Fridovich, I. Superoxide Dismutase. Organelle Specificity. J Biol Chem 1973; 248: 3582-3592.
42. Uchida, K, Kawakishi, S. Identification of Oxidized Histidine Generated at the Active Site of Cu,Zn-Superoxide Dismutase Exposed to H2O2. J Biol Chem 1994; 269: 2405-2410.
43. Veronese, F, Largajolli, R, Boccú, E, Benassi, C, Schiavon, O, et al. Surface modification of proteins activation of monomethoxy-polyethylene glycols by phenylchloroformates and modification of ribonuclease and superoxide dismutase. Applied Biochemistry and Biotechnology, 1985; 11: 141-152.
44. Liu, T, Beckman, J, Freeman, B, Hogan, E, Hsu, C. Polyethylene glycol-conjugated superoxide dismutase and catalase reduce ischemic brain injury. AJP-Heart 1989; 256: 589-593.
45. Fujita, T, Nishikawa, M, Tamaki, C, Takakura, Y, Hashida, M, et al. Targeted delivery of human recombinant superoxide dismutase by chemical modification with mono- and polysaccharide derivatives. JPET 1992; 263: 971-978.
46. Hirano, T, Todoroki, T, Morita, R, Kato, S, Ito, Y, Kim, K, et al. Anti-inflammatory effect of the conjugate of superoxide dismutase with the copolymer of divinyl ether and maleic anhydride against rat re-expansion pulmonary edema. J Control Release 1997; 48: 131-9.
47. Sakurai, K, Miyazaki, K, Kodera, Y, Nishimura, H, Shingu, M, Inada, Y. Antiinflammatory activity of superoxide dismutase conjugated with sodium hyaluronate. J Glycoconj 1997; 14: 723-8.
48. Ogino, T, Inoue, M, Ando, Y, Awai, M, Maeda, H, Morino, Y. Chemical modification of superoxide dismutase: Extension of plasma half-life of the enzyme through its reversible binding to the circulating albumin. International Journal of Peptide and Protein Research 1988; 32: 153–159.
49. Valdivia, A, Domínguez, A, Pérez, Y, Caballero, J, Hernández, Y, Villalonga, R. Improved pharmacological properties for superoxide dismutase modified with Mannan. Biotechnology and Applied Biochemistry 2006; 44: 159-165.
50. Domínguez, A, Valdivia, A, Caballero, J, Martínez, G, Hernández, Y, Schacht, E, et al. Improved pharmacological properties for superoxide dismutase modified with carboxymethycellulose. Journal of Bioactive and Compatible Polymers 2005; 20: 557-70.
51. Ge, B, Scheller, F, Lisdat, F. Electrochemistry of immobilized CuZnSOD and FeSOD and their interaction with superoxide radicals. Biosensors and Bioelectronics 2001; 18: 295-302.
52. Endo, K, Miyasaka, T, Mochizuki, S, Aoyagi, S, Himi, N, Asahara, H, et al. Development of a superoxide sensor by immobilization of superoxide dismutase. Sensors and Actuators 2002; 83: 30-34.
53. Beissenhirtz, M, Scheller, F, Viezzoli, M, Lisdat, F. Engineered Superoxide Dismutase Monomers for Superoxide Biosensor Applications. Anal Chem 2006; 78: 928-935.
54. Villalonga, R, Cao, R, Fragoso, A, Damiao, A, Ortiz, P, Caballero, J. Supramolecular assembly of b-cyclodextrin-modified gold nanoparticles and Cu,Zn superoxide dismutase on catalase. J Mol Cat 2005; 35: 79-85.
55. Salimi, A, Noorbakhsh, A, Rafiee-Pour, H.A, Ghourchian, H. Direct Voltammetry of Copper,Zinc-Superoxide Dismutase Immobilized onto Electrodeposited Nickel Oxide Nanoparticles: Fabrication of Amperometric Superoxide Biosensor. Electroanalysis 2012; 23: 683-691.
56. Sheng, L, Zhang, X, Song, C. Preparation and characterization of a thermostable enzyme (Mn-SOD) immobilized on supermagnetic nanoparticles. Applied Microbiology and Biotechnology 2012; 96: 123-132.
57. Campanella, L, Favero, G, Tomassetti, M. Superoxide Dismutase Biosensors for Superoxide Radical Analysis. Analytical Letters 1999; 32: 2559-2581.
58. Emregul, E. Development of a new biosensor for superoxide radicals. Analytical and Bioanalytical Chemistry 2005; 383: 947-954.
59. Ellerby, L, Nishida, C, Nishida, F, Yamanaka, S, Dunn, B, Valentine, J. et al. Encapsulation of proteins in transparent porous silicate glasses prepared by the sol-gel method. Science 1992; 255: 1113-1115.
60. Vorauer-Uhl, K, Furnschlief, E, Wagner, A, Ferko, B, Katinger, H. Topically applied liposome encapsulated superoxide dismutase reduces postburn wond size and edema formation. Eur J Pharm Sci 2001; 14: 63-7.
61. Muscoli, C, Cuzzocrea, S, Riley, P, Zweier, J, Thiemermann, C, Wang, Z, et al. On the selectivity of superoxide dismutase mimetics and its importance in pharmacological studies. Br J Pharmacol 2003; 140: 445-60.
62. Pluta J, Karolewicz B. Evaluation of bioadhesive properties of excipients containing lipophilic adjuvants. Polim Med 2003; 33: 3-16.
63. Domínguez, A, Valdivia, A, Hernández, J, Villalonga, R. Biocompatibilidad in vitro de superóxido dismutasa en interacción con polímero e hidrogeles de carboximetilcelulosa ensayado con fibroblastos humanos. Biotecnología Aplicada 2004; 21: 218-223.