
About the vibrational spectroscopy in the diagnosis of Alzheimer’s disease
Title in Spanish: Sobre la espectroscopía vibracional en el diagnóstico de la enfermedad de Alzheimer
P. Carmona1*, E. López-Tobar1, M. Molina2, A. Toledano3,4
1Instituto de Estructura de la Materia (CSIC), Serrano 121, 28006 Madrid. 2Escuela Universitaria de Óptica, Universidad Complutense, Madrid.
3Instituto Cajal (CSIC), Av. Dr. Arce 37, 28002 Madrid.4Académico Correspondiente de la RANF
*Corresponding Author: p.carmona@iem.cfmac.csic.es An Real Acad Farm Vol. 81, Nľ 1 (2015), pp. 19-24
Received: January 21, 2015 Accepted: February 24, 2015 Language of Manuscript: Spanish
![]()
1. INTRODUCCIÓN
En los próximos 50 aĖos se espera que la enfermedad de Alzheimer (EA) afecte a 100 millones de personas en el mundo. Es de sobra conocido que las características patofisiológicas más importantes de la enfermedad de Alzheimer son las placas seniles y los ovillos neurofibrilares. El componente mayoritario de dichas placas es el péptido β-amiloide (Aβ). Este péptido de 39-43 aminoácidos es muy hidrofóbico, se libera en la escisión proteolítica de la proteína precursora amiloidea (APP) y se agrega para formar oligómeros. Estos oligómeros a su vez se agregan para formar fibras, que se depositan en el parénquima cerebral y originan las placas seniles (1). Los efectos neurotóxicos del péptido Ab implican también cambios en la composición y estructura de las membranas neuronales, afectando a sus propiedades fisicoquímicas. Uno de los mayores retos respecto a esta enfermedad neurodegenerativa reside en la consecución de un método de diagnóstico precoz con vistas a la administración de un tratamiento adecuado. En la actualidad el diagnóstico definitivo más eficaz está limitado a un examen post-mortem. En la enfermedad de Alzheimer, el diagnóstico clínico se hace por exclusión tras estudiar el especialista si existe una demencia y no encontrar ningún síntoma o signo que explique la causa de la misma.
Otros procedimientos actuales incluyen la identificación de marcadores para el diagnóstico clínico precoz de la EA utilizando técnicas de imagen tales como las de resonancia magnética nuclear (RMN) y tomografía por emisión de positrones (PET) (2). Pero estos procedimientos son generalmente muy caros, y la disponibilidad de instrumentación al respecto no se ha generalizado. Existen también técnicas alternativas de diagnóstico de la EA tales como pruebas genéticas y ensayos neuroquímicos de fluidos corporales. En el caso de las pruebas genéticas, existe una asociación significativa del alelo épsilon 4 (e4) de la apolipoproteína E (ApoE) con la EA de inicio tardío, pero la genotipificación de la ApoE no se recomienda actualmente como estrategia regular de la EA debido a la baja sensibilidad y especificidad (3).
Los biomarcadores en fluidos corporales tales como LCR, plasma y suero podrían ser utilizados para incrementar la exactitud del diagnóstico del deterioro cognitivo leve (DCL) y la predicción de su evolución. El LCR es un buen recurso para la investigación en enfermedades neurodegenerativas, pero su aplicación clínica está limitada por la naturaleza invasiva del procedimiento, especialmente en poblaciones de edad avanzada, y la exigencia de personal altamente capacitado, por lo que es inadecuado para la aplicación rutinaria. El plasma es un fluido corporal complejo que contiene proteínas, péptidos, lípidos y metabolitos que reflejan la actividad fisiológica y patología en diversos órganos corporales, incluyendo el sistema nervioso central (SNC). En seres humanos, aproximadamente 500 mL de LCR se absorben en la sangre diariamente (4), lo que hace a la sangre una fuente adecuada de biomarcadores de enfermedades neurodegenerativas. La facilidad de una punción venosa en comparación con una punción lumbar permite repetitividad, lo que hace adecuada su aplicación en ensayos clínicos para el diagnóstico de la EA y evaluar tratamientos modificadores de esta enfermedad.
La espectroscopía vibracional (infrarroja y Raman) genera información analítica y estructural como consecuencia de las transiciones fundamentales entre niveles de energía vibracional reflejadas en bandas espectrales. Los espectros vibracionales se pueden considerar como huellas digitales utilizables en la identificación cualitativa o análisis cuantitativo de las especies moleculares en cuestión. En el caso del plasma sanguíneo utilizado como fuente de marcadores de la EA, los espectros vibracionales correspondientes serán el resultado de la superposición de espectros de las proteínas, péptidos, lípidos y metabolitos contenidos en el mismo. La espectroscopía infrarroja y Raman en su modalidad bidimensional (2D) permite el análisis de espectros complicados de sistemas biológicos complejos como el plasma sanguíneo, revelando incluso pequeĖos cambios en la composición y/o estructura molecular resultantes de procesos patológicos, físicos y químicos que tienen lugar en el organismo (5). En esta publicación se presentan ejemplos que ilustran el uso de la espectroscopía vibracional de correlación 2D en la búsqueda de marcadores que pueden ser útiles para el diagnóstico de la EA.
2. ESPECTROSCOPIA VIBRACIONAL DE CORRELACION BIDIMENSIONAL
La observación directa de una correlación entre una banda determinada y otras bandas del mismo espectro, o entre una banda infrarroja y otra Raman, es posible actualmente mediante la espectroscopía de correlación bidimensional (2D). Este método permite obtener información analítica-estructural variada que no se puede conseguir fácilmente a partir de un espectro monodimensional convencional. Aunque la idea básica de la espectroscopía vibracional de correlación 2D es similar a la de RMN 2D, los métodos de calcular los espectros de correlación son diferentes. En la espectroscopía vibracional de correlación 2D se calcula una correlación cruzada dinámica entre variaciones de intensidad de bandas inducidas por una perturbación externa (temperatura, tiempo, etc.) para obtener de este modo un espectro de correlación 2D.
El espectro de correlación puede ser de tipo síncrono o asíncrono. En el espectro síncrono aparecen en la línea diagonal varios picos llamados picos de autocorrelación que corresponden a bandas correlacionadas consigo mismas. Cuanto mayor es el cambio de intensidad de una banda en respuesta a una perturbación externa (tal como un cambio de temperatura, tiempo, etc.), mayor es la intensidad de su pico de autocorrelación. Obviamente una banda que tiene una gran intensidad no necesariamente muestra un pico de autocorrelación fuerte. Por tanto, las bandas que se solapan en un espectro monodimensional se pueden observar como bandas separadas en espectros de correlación 2D a causa de sus diferentes niveles de respuesta a una perturbación. Los picos localizados fuera de la diagonal se llaman picos cruzados. La existencia de un pico cruzado a (n1, n2) en el espectro síncrono significa que dos bandas de frecuencias n1 y n2 cambian de manera similar una con respecto a otra en respuesta a una determinada perturbación. Un pico cruzado puede tener signo positivo o negativo. El signo es positivo cuando las intensidades de ambas bandas aumentan o disminuyen simultáneamente con una perturbación, y es negativo cuando una banda aumenta mientras que la otra disminuye.
Un espectro de correlación asíncrono proporciona información complementaria a la obtenida de un espectro de correlación síncrono, y carece de picos de autocorrelación. Un pico cruzado de frecuencias (n1, n2) en un espectro de correlación asíncrono significa que las intensidades de dos bandas a n1 y n2 presentan respuestas fuera de fase para una determinada perturbación. Por ejemplo, un pico cruzado aparece cuando las intensidades de dos bandas cambian a diferentes temperaturas, o cuando cambian en tiempos diferentes.
La utilidad de esta modalidad de espectroscopía vibracional se ha traducido en un número creciente de aplicaciones a lo largo de los últimos lustros en diversas áreas relacionadas con la espectroscopía óptica (6), bioquímica (7) (8) y química analítica (9). A continuación se presentan espectros de correlación síncronos infrarrojos y Raman obtenidos a partir de espectros medios de muestras de plasma sanguíneo extraído de un grupo de 35 pacientes con la EA (8, 16 y 11 en fases leve, moderada y grave, respectivamente) y de 12 controles sanos, de edades similares entre ambos grupos. Con este fin se ha utilizado el software denominado 2D-Pocha, escrito por los Dres. D. Adachi e Y. Ozaki (Kwansei-Gakuin University, Japan), programado sobre la base del algoritmo desarrollado de espectroscopía de correlación 2D generalizada (6).
3.ESPECTROSCOPIA INFRARROJA
El espectro síncrono de la región infrarroja amida I se incluye en la Figura 1, en donde se advierte como autopico más intenso el situado en la diagonal y centrado hacia 1633 cm-1, que es atribuible al aumento de concentración de estructura b-polipeptídica a lo largo del tiempo de evolución de la EA. Esta asignación es consistente con la presencia del autopico hacia 1690 cm-1, que también es característico de estructura b-polipeptídica y está correlacionado positivamente con el autopico hacia 1633 cm-1. Este pico de la diagonal está a su vez correlacionado negativamente con el situado hacia 1656 cm-1 que se puede asignar a estructura a-helicoidal/desordenada sobre la base de consideraciones de frecuencias de grupo y de estructura secundaria de proteínas (10). Esta información estructural es consistente con la generada por la región entre 1350 y 990 cm-1 (Figura 2), en la que aparecen dos autopicos situados hacia 1298 y 1234 cm-1 que son atribuibles a a-hélices y estructura b-polipeptídica respectivamente (11) (10). Ambos picos están correlacionados negativamente como indica el pico cruzado a (1298, 1234), debido al aumento de estructura b-polipeptídica y disminución de a-hélices.
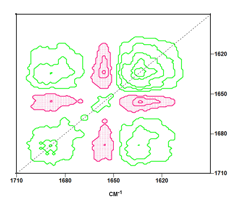
Figura 1. Espectro síncrono obtenido a partir de espectros infrarrojos medios en la región 1710-1590 cm-1 de plasma sanguíneo de controles sanos y pacientes con EA leve, moderada y grave.
Los lípidos son unos de los componentes del plasma más susceptibles del ataque por radicales libres inductores de peroxidación (12). La generación de productos muy reactivos que se forman en la peroxidación lipídica puede contribuir al daĖo celular y por tanto la medida de estos productos se ha usado habitualmente para evaluar el estrés oxidativo. Compuestos hidroxilados (por ejemplo, isoprostanos, hidroperóxidos) son productos de la peroxidación lipídica y se han descrito como marcadores de daĖo oxidativo en la EA (13). La espectroscopía infrarroja es muy sensible a la presencia de grupos hidroxilo, que se hacen visibles no solamente a través de las bandas de tensión OH sino también a través de las de tensión C-O (14). La presencia de algunos restos de agua puede interferir con medidas cuantitativas de grupos hidroxilo en la región de tensión OH a lo largo de la EA. Por tanto, una región alternativa para este fin puede ser la comprendida entre 1150 y 1000 cm-1 como se muestra en la Figura 2. Un amplio autopico que abarca desde 1135 a 1000 cm-1 aproximadamente aparece en este espectro síncrono y es atribuible a vibraciones de tensión C-O. Este autopico está correlacionado positivamente con el situado hacia 1234 cm-1 como consecuencia del aumento simultáneo de concentraciones de estructura b-polipeptídica y compuestos hidroxilados derivados de la oxidación lipidídica asociada al estrés oxidativo presente en la EA.
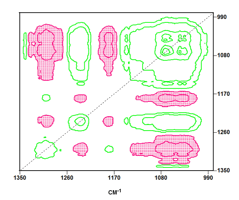
Figura 2. Espectro síncrono obtenido a partir de espectros infrarrojos medios en la región 1350-980 cm-1 de plasma sanguíneo de controles sanos y pacientes con EA leve, moderada y grave.
Los cambios de intensidad de algunas bandas infrarrojas puestos de manifiesto por espectroscopía de correlación bidimensional se han utilizado como marcadores de la EA en curvas ROC para evaluar pruebas diagnósticas de la EA. Clásicamente, la exactitud de una prueba diagnóstica se ha evaluado en función de dos características: la sensibilidad y la especificidad. La sensibilidad de una prueba diagnóstica es la probabilidad de obtener un resultado positivo cuando el individuo tiene la enfermedad. Mide su capacidad para detectar la enfermedad cuando está presente. La especificidad de una prueba indica la probabilidad de obtener un resultado negativo cuando el sujeto en cuestión no tiene la enfermedad. Mide su capacidad para descartar la enfermedad cuando ésta no está presente. Las curvas ROC son gráficos en los que se observan todos los pares de sensibilidad/especificidad resultantes de la variación continua de los puntos de corte en todo el intervalo de resultados observados. En el eje de ordenadas se sitúa la sensibilidad (S) o fracción de verdaderos positivos calculada en el grupo de enfermos. En el eje de abscisas se sitúa la fracción de falsos positivos o 1-especificidad (1 – E), calculada en el grupo no afectado por la enfermedad. Cada punto de la curva representa un par S/1-E correspondiente a un nivel de decisión determinado. Una prueba con discriminación perfecta, sin solapamiento de resultados entre las poblaciones de sujetos sanos y enfermos, tiene una curva ROC que pasa por la esquina superior izquierda, en donde S y E toman valores máximos (S y E = 1). Una prueba sin discriminación, con igual distribución de resultados en los dos grupos, da lugar a una línea diagonal de 45ľ, desde la esquina inferir izquierda hasta la superior derecha. La mayoría de las curvas ROC caen entre estos dos extremos. Cualitativamente, cuanto mayor es el área encerrada entre la curva ROC y la diagonal más alta es la exactitud global del método de diagnóstico.
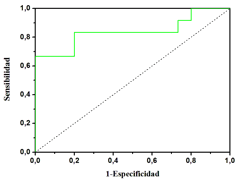
Figura 3. Curva ROC obtenida mediante la intensidad del perfil espectral entre 1639 y 1624 cm-1 medida en plasma sanguíneo de controles sanos y pacientes con EA en fase leve.
La Figura 3 muestra una curva ROC obtenida mediante la intensidad del perfil espectral entre 1639 y 1624 cm-1 medida en plasma sanguíneo de 15 sujetos sanos y 12 sujetos enfermos con la EA en fase leve. El porcentaje del área comprendida entre la curva ROC y la diagonal, que indica el porcentaje de exactitud en las clasificaciones de muestras, es aproximadamente 84%. Este disminuye a 75% si en el grupo de pacientes se incluyen los de EA moderada (resultados no mostrados), lo que se puede explicar teniendo en cuenta que la formación de péptidos b-amiloides contribuye al aumento de intensidad en esta región infrarroja (11) (10), y su concentración va disminuyendo al pasar a fases más avanzadas (moderada, grave) de la EA (13). Por otra parte, la Figura 4 incluye una curva ROC resultante de medir la relación de intensidades a 1156 y 1171 cm-1 en dos grupos de plasma sanguíneo integrados por controles sanos y pacientes con EA leve y moderada. El porcentaje de área bajo la curva ROC es de aproximadamente 80%.
4. ESPECTROSCOPIA RAMAN
Los resultados de espectroscoía Raman de correlación 2D son consistentes con los obtenidos por espectroscopía infrarroja. La Figura 5 muestra el espectro síncrono obtenido a partir de espectros Raman medidos en las regiones 1725-1600 cm-1 y 1000-900 cm-1, que son características de la estructura secundaria de péptidos y proteínas. Sobre la diagonal aparecen dos autopicos situados a 1671 y 934 cm-1 que están correlacionados negativamente con el pico cruzado a (1671, 934) generado por un aumento de estructura b-polipeptídica y una disminución de a-hélices (15) a lo largo de la EA. El mencionado cambio espectral indicativo de aumento de estructura b y la disminución inherente de estructura a-helicoidal puede ser debido a la superposición de seĖales espectrales de diversos componentes del plasma que aparecen en el curso de la EA y que se han descrito como posibles biomarcadores de esta enfermedad.
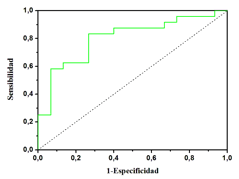
Figura 4. Curva ROC obtenida mediante la relación de intensidades 1156/1171 cm-1 medida en plasma sanguíneo de controles sanos y pacientes con EA en fase leve y moderada.
Aparte de los péptidos Ab40 y Ab42, en el plasma sanguíneo existen otras isoformas truncadas de péptidos amiloides tales como Ab37, Ab38 y Ab39 (18). En el SNC, los péptidos Ab se generan en el cerebro y son transportados al sistema vascular periférico a través de la barrera hemato-encefálica (19), y también son segregados por las plaquetas en la sangre (20). Por otra parte, una proteína rica en estructura b-polipeptídica, la a-2-macroglobulina, se ha identificado a concentraciones elevadas en plasma sanguíneo de pacientes con la EA (4). La a-1-antitripsina se ha descrito también como componente del plasma asociado a la EA y posible biomarcador de esta enfermedad (21). Asimismo bajo este punto de vista se pueden mencionar otras proteínas ricas en estructura b-polipeptídica, tales como la transferrina (22) y a1-antiquimitripsina (23) (24).
Así, dos péptidos de 40 y 42 aminoácidos (Ab40 y Ab42) derivados de la proteína precursora amiloide (APP) son los dos principales componentes de las placas seniles amiloides extracelulares (16). La mayoría de los péptidos Ab del plasma están unidos a la albúmina, y muy pocos de estos péptidos están en estado libre (17).
Otros cambios espectrales por debajo de 800 cm-1 se generan también al pasar de controles sanos a pacientes afectados con la EA (5), probablemente como consecuencia de alteraciones en la estructura terciaria y aumento de concentración de determinadas proteínas en el curso de esta enfermedad.
La Figura 6 incluye una curva ROC obtenida mediante la intensidad relativa de la banda amida I a 1671 cm-1 medida en plasma sanguíneo de controles sanos y pacientes con EA en fase leve y moderada. El porcentaje de área incluida entre la curva y la diagonal es 86%, que equivale a la exactitud en la discriminación entre controles y pacientes.

Figura 5. Espectro síncrono obtenido a partir de espectros Raman medidos en las regiones 1725-1600 cm-1 y 1000-900 cm-1 de plasma sanguíneo de controles sanos y pacientes con EA leve, moderada y grave.
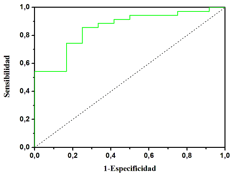
Figura 6. Curva ROC obtenida mediante la intensidad relativa de la banda amida I a 1671 cm-1 medida en plasma sanguíneo de controles sanos y pacientes con EA en fase leve y moderada.
5. CONCLUSIONES
La espectroscopía de correlación 2D infrarroja y Raman puede detectar pequeĖos cambios espectrales que se originen en el curso de una determinada enfermedad y que representados en sus respectivas curvas ROC se puedan utilizar para el diagnóstico de la misma. Es el caso de los ejemplos anteriores referentes a la enfermedad de Alzheimer, para cuyo diagnóstico algunas regiones espectrales generan unas curvas ROC con un grado de exactitud en la clasificación de muestras superior al 80%. Por tanto se satisface el criterio propuesto por el National Institute on Aging (NIA) (25) en lo que respecta a la especificidad y sensibilidad que debe tener un biomarcador ideal para el diagnóstico de la EA. No obstante se proseguirá dando robustez a este método con la inclusión de más controles sanos y pacientes afectados por la EA.
6. AGRADECIMIENTOS
Gran parte de los trabajos aquí mencionados han sido subvencionados con un proyecto del Plan Nacional 2009 y un proyecto INNPACTO 2012, así como con un Convenio/Contrato CSIC-Lab. Raman-Health.
7. REFERENCIAS
1. Haass C. Take five-Bace and the g-secretase quartet conduct Alzheimer’s amyloid b-peptide generation. EMBO J 2004; 23: 483-88.
2. Hampel H, Burger K, Teipel SJ, et al. Core candidate neurochemical and imaging biomarkers of Alzheimer's disease. Alzheimers Dement 2008; 4: 38–48.
3. Patterson C, Feightner JW, Garcia A, et al. Diagnosis and treatment of dementia: 1. Risk assessment and primary prevention of Alzheimer disease. CMAJ 2008; 178: 548–56.
4. Hye A, Lynham S, Thambisetty M, et al. Proteome-based plasma biomarkers for Alzheimer's disease. Brain 2006; 129: 3042–50.
5. Carmona P, Molina M, Calero M, et al. Discrimination analysis of blood plasma associated with Alzheimer’s disease using vibrational spectroscopy. J Alzheimer’s Dis 2013; 34, 911-20.
6. Noda I, Ozaki Y. Principle of two-dimensional correlation spectroscopy. In Two-dimensional Correlation Spectroscopy. Applications in Vibrational and Optical Spectroscopy, John Wiley 2004.
7. Ortiz M, Sanoguel Z, Hu HT, et al. Dynamics of hydrogen - Deuterium exchange in Chlamydomonas centrin. Biochemistry 2005; 44, 2409-18.
8. Carmona P, Molina M. Interactions of protein and nucleic acid components of hepatitis C virus as revealed by Fourier transform infrared spectroscopy. Biochemistry 2010; 49: 4724-31.
9. Pivonka D. Vibrational analysis of structure activity relationships (SAR) in molecular binding. Appl. Spectrosc. 2004; 58: 323-31.
10. Barth A, Zscherp C. What vibrations tell us about proteins. Quart Rev Biophys 2002; 35: 369-430.
11. Krimm S, Bandekar J. Vibrational spectroscopy and conformation of peptides, polypeptides, and proteins. Adv Protein Chem 1986; 38: 181-363.
12. Montuschi P, Barnes PJ, Roberts LJ. Isoprostanes: Markers and mediators of oxidative stress. FASEB J 2004; 18: 1791-1800.
13. Song F, Poljak A, Smythe GA, et al. Plasma biomarkers for mild cognitive impairment and Alzheimer’s disease. Brain Res Rev 2009; 61; 69-80.
14. Socrates G. Hydroxyl group compounds: O-H group. In Infrared and Raman Characteristic Group Frequencies: Tables and Charts. Socrates G (ed), John Willey, England, 2001: pp. 94-100.
15. Tuma R. Raman spectroscopy of proteins: From peptides to large assemblies. J. Raman Spectrosc. 2005; 36: 307-19.
16. Selkoe DJ. Normal and abnormal biology of the beta-amyloid precursor protein. Annu. Rev. Neurosci.1994; 17: 489–517.
17. Biere AL, Ostaszewski B, Stimson ER, et al. Amyloid beta-peptide is transported on lipoproteins and albumin in human plasma. J. Biol. Chem. 1996; 271: 32916–22.
18. Maler JM, Klafki HW, Paul S, et al. Urea-based two-dimensional electrophoresis of beta-amyloid peptides in human plasma: evidence for novel Abeta species. Proteomics 2007; 7: 3815–20.
19. Zlokovic BV. Clearing amyloid through the blood–brain barrier. J Neurochem 2004; 89: 807–11.
20. Chen M, Inestrosa NC, Ross GS, et al. Platelets are the primary source of amyloid beta-peptide in human blood. Biochem Biophys Res Commun 1995; 213: 96–103.
21. Liao P, Yu L, Kuo CC, et al. Proteomics analysis of plasma for potential biomarkers in the diagnosis of Alzheimer's disease. Proteomics. Clinical Applications 2007; 1: 506–12.
22. Yu HL, Chertkow HM, Bergman H, et al. Aberrant profiles of native and oxidized glycoproteins in Alzheimer plasma. Proteomics 2003; 3: 2240–48.
23. Akiyama H, Barger S, Barnum, S, et al. Inflammation and Alzheimer's disease. Neurobiol. Aging 2001; 21; 383–421.
24. Yasojima K, Schwab C, McGeer EG, et al. Human neurons generate C-reactive protein and amyloid P: upregulation in Alzheimer's disease. Brain Res 2000; 887: 80–9.
25. Frank RA, Galasko D, Hampel H, et al. Biological markers for therapeutic trials in Alzheimer's disease. Proceedings of the biological markers working group; NIA initiative on neuroimaging in Alzheimer's disease. Neurobiol. Aging 2003; 24: 521–36.