ARTêCULO |
Efectos cardioprotectores de reducci—n de tama–o del infarto de miocardio y prevenci—n del remodelado ventricular post-infarto del agonista del receptor de esfingosina-1-fosfato: estudio experimental en un modelo porcino de isquemia-reperfusi—n
Carlos Garc’a Santos-Gallego*
*e-mail: carlosgsantos@yahoo.es
An. Real Acad. Farm. Vol. 80, N¼ 3 (2014), pag. 694-719
Premio ÒReal Academia Nacional de FarmaciaÓ en el Concurso Cient’fico 2013 de la Real Academia Nacional de Farmacia.
resumen
La isquemia mioc‡rdica induce fen—menos de muerte celular por necrosis y apoptosis. La apoptosis es un proceso que requiere energ’a (dependiente de ox’geno y ATP), por lo que -aunque los genes proapopt—ticos se activen durante la isquemia- el programa apopt—tico no se lleva a cabo hasta la reperfusi—n (cuando el ox’geno est‡ nuevamente disponible para sintetizar ATP). La esfingosina 1-fosfato es un fosfol’pido presente en el cuerpo con propiedades antiapopt—ticas ya demostradas. Fingolimod es el œnico agonista sintŽtico del receptor de esfingosina 1-fosfato (S1P-R) que est‡ aprobado para uso en pacientes (en concreto, para esclerosis mœltiple). Nuestra hip—tesis consiste en que la activaci—n del receptor S1P-R mediante el tratamiento con Fingolimod durante el periodo isquŽmico del infarto agudo de miocardio disminuye la apoptosis, aumenta el miocardio preservado, reduce el tama–o de infarto y mitiga el remodelado del ventr’culo izquierdo en un modelo porcino de isquemia-reperfusi—n (I-R). Se indujo isquemia-reperfusi—n en cerdos Yorkshire mediante la oclusi—n percut‡nea de la arteria coronaria descendente anterior en su segmento proximal durante 60 minutos. Los animales fueron aleatorizados a recibir Fingolimod o salino (grupo control). Los animales fueron evaluados con resonancia magnŽtica cardiaca (RM), ecocardiograf’a 3D, tŽcnicas de hemodin‡mica invasiva, histolog’a y an‡lisis por Western blot. En un estudio inicial, se observ— los cerdos tratados con Fingolimod presentaban a las 24 horas post-IAM menos apoptosis en el miocardio isquŽmico y m‡s activaci—n de prote’nas cardioprotectoras y anti-apopt—ticas que los cerdos del grupo control. En un estudio a largo plazo, la RM cardiaca una semana post-infarto (IAM) mostr— que, a pesar de tener un tama–o similar de ‡rea en riesgo en el miocardio en ambos grupos, Fingolimod redujo significativamente el tama–o del infarto y mejor— la funci—n sist—lica del ventr’culo izquierdo (VI). Estos efectos cardioprotectores segu’an asimismo presentes un mes post-IAM, pues los cerdos tratados con Fingolimod presentaban menor tama–o de IAM, mejor funci—n sist—lica de VI y menor remodelado cardiaco a nivel anat—mico (expresado como menos dilataci—n de VI, menor masa de VI y menor pŽrdida de la morfolog’a normal del VI). Adicionalmente, Fingolimod mitig— el desarrollo del remodelado adverso del ventr’culo izquierdo a nivel histol—gico (una disminuci—n de la hipertrofia de los cardiomiocitos y de la fibrosis intersticial) y molecular (menor activaci—n de Akt y de ERK1/2). Finalmente, el grupo Fingolimod presentaba asimismo menor activaci—n neurohormonal (medida como menores niveles de catecolaminas). La activaci—n precoz de S1P-R mediante el tratamiento con Fingolimod previo a la reperfusi—n provoca efectos cardioprotectores beneficiosos, incrementa el miocardio salvado, reduce el tama–o de infarto, mejora la funci—n sist—lica y la mec‡nica mioc‡rdica del VI y mitiga el remodelado cardiaco adverso post-IAM. |
Palabras clave: Infarto de miocardio; da–o por isquemia-reperfusi—n; remodelado del VI; esfingosina 1-fosfato; miocardiopat’a; apoptosis; farmacolog’a.
abstract
Cardioprotective effects of reduction in size of the myocardial infarction and prevention of the ventricular remodeling post-infarction sphingosine‐1‐phosphate receptor agonist: an experimental study in a porcine model of isquemia‐reperfusion
Myocardic ischemia induces cell death due to necrosis or apoptosis. Apoptosis requires energy (obtained from oxygen and ATP). Th Although proapoptotic genes are activated during ischemia the apoptotic programm does not take place until re-perfusion (when oxygen is again available to synthesize ATP). Sphingosine -1-phosphate is a phospholipid with known antiapoptotic properties. Fingolimod is the only synthetic agonist known of spingosine-1-phosphate receptor ( S1P-R) aproved for use in patients ( with multiple sclerosis). Our hypotheis is that activation of S-1-P R with Fingolimod during the period of ischemia of acute myocardic infartion decreases apoptosis, reduce the size and the process of remodeling of left ventricle in a porcine model of ischemia-reperfusion ( I-R). Thus, I-R was induced in Yorkshire pigs by oclusi—n of coronary ateria in its proximal segment during 60 min. and treated or not with Fingolimod. Animals were evaluated by cardiac magnetic resonance (RM), ecocardiography 3D, hemodynamic tecniques, histology and Western blot analysis. Pigs treated with Fingolimod after 24 hr showed lower apoptosis of the myocardium and activation of antiapototic proteins Tan control group. In a long term study Fingolimod reduced the size of infartion and improved sustolic function of left ventricle. In addition Fingolimod decreased cardiomyocites hypertrophy and activation of molecular parameters as Akt and ERK 1/2. We conclude that early activation of S1P-R by Fingolimod reduces the size of infartion improves systolic function and mitigates adverse cadiac remodelling . |
Keywords: Myocardial infarction; ischemia-reperfusion; Sphingosine -1-phosphate; myocardiopathy; apoptosis; pharmacology.
1. INTRODUCci—N
La reperfusi—n precoz mediante cateterismo cardiaco/angioplastia coronaria o mediante trombolisis es el mŽtodo m‡s utilizado actualmente en el tratamiento de pacientes con infarto agudo de miocardio (IAM). La reperfusi—n temprana reduce con Žxito el tama–o de infarto, preserva la funci—n cardiaca y disminuye la morbilidad y la mortalidad (1). Desafortunadamente, la reperfusi—n no siempre es suficiente para conseguir la recuperaci—n adecuada del miocardio. De hecho, la reperfusi—n por s’ misma puede parad—jicamente inducir el da–o del cardiomiocito y muerte celular, fen—meno llamado da–o por isquemia-reperfusi—n (I-R) (2,3). Por esta raz—n son necesarias intervenciones farmacol—gicas para reducir mejor el tama–o del infarto, preservar la funci—n del ventr’culo izquierdo, mitigar el remodelado y, por consiguiente, mejorar la supervivencia en pacientes con IAM.
La isquemia mioc‡rdica induce fen—menos de muerte celular por necrosis y apoptosis, que son los causantes del infarto final. Durante el periodo isquŽmico se produce necrosis pero adem‡s se activa la apoptosis. La apoptosis es un proceso que requiere energ’a (es un proceso dependiente de ox’geno y ATP), por lo que -aunque los genes proapopt—ticos se activen durante la isquemia- el programa apopt—tico no se lleva a cabo hasta la reperfusi—n (cuando el ox’geno est‡ nuevamente disponible para sintetizar ATP). Es decir, la apoptosis se activa durante la isquemia pero se efectœa durante la reperfusi—n. Por ello, la reperfusi—n, aunque beneficiosa para evitar la muerte por necrosis, parad—jicamente puede tener efectos perjudiciales al poner en marcha la muerte celular por apoptosis. Este es el origen de la lesi—n por isquemia reperfusi—n (I-R), que es responsable hasta del 50% del tama–o final del IAM (2,3). Por ello, se postula que f‡rmacos antiapopt—ticos podr’an disminuir la lesi—n por I-R.
La esfingosina-1-fosfato (S1P) ha recibido recientemente mucha atenci—n por sus efectos antiapopt—ticos y citoprotectores y su potencial para mejorar el da–o por I-R (4). S1P es un lipofosfol’pido bioactivo derivado del l’pido de membrana esfingomielina (5). De una manera importante, se ha demostrado recientemente que S1P reduce el da–o por I-R en el h’gado (6), ri–—n (7), p‡ncreas (8), y en el cerebro (9). En experimentos in vitro, S1P aumenta la supervivencia del cardiomiocito en condiciones de hipoxia (10,11), y reduce el tama–o del infarto en experimentos ex vivo de preparaciones de corazones aislados (12,13). Adem‡s, experimentos in vivo iniciales tambiŽn apoyan el papel cardioprotector de S1P en ratones durante el IAM (14,15).
Nuestra estrategia final consiste en aplicar un f‡rmaco antiapopt—tico al paciente que sufre un IAM ya durante el traslado en ambulancia del paciente al hospital, es decir antes de la reperfusi—n. Para facilitar la aplicaci—n de nuestros hallazgos a la pr‡ctica cl’nica, elegimos un agonista de los receptores de S1P (S1P-R). Fingolimod, un derivado sintŽtico de la miriocina (un metabolito del hongo Isariasinclairii), es el œnico agonista de S1P-R disponible para el uso cl’nico en humanos (16). Fingolimod reduce las recurrencias y las lesiones en cerebro (medidas por resonancia magnŽtica) en pacientes con esclerosis mœltiple recurrente-remitente (17,18), y fue aprobado por la Asociaci—n Americana de Medicamentos y Alimentos (FDA) en Septiembre de 2010 como tratamiento de primera l’nea para estos pacientes. Adem‡s, la activaci—n de S1P-R mediada por Fingolimod podr’a ser una terapia prometedora con el objetivo de mejorar la recuperaci—n del miocardio durante el IAM. De hecho, estudios preliminares han demostrado que Fingolimod reduce la apoptosis del cardiomiocito en experimentos in vitro en condiciones de hipoxia (4,19-21). Sin embargo, aunque estos estudios preliminares son muy prometedores, el efecto cardioprotector de Fingolimod no se han estudiado todav’a en modelos in vivo.
Nuestra hip—tesis consiste en que la activaci—n de S1P-R con Fingolimod durante la isquemia reduce la apoptosis de los cardiomiocitos dando lugar a un aumento de la recuperaci—n mioc‡rdica, disminuci—n del tama–o de infarto y reducci—n del remodelado del VI en un modelo porcino de I-R.
2. material y mŽtodos
2.1. Dise–o del estudio
Utilizamos cerdos Yorkshire albinos (20±2kg) para este estudio, que fueron alojados en un animalario acreditado por la Asociaci—n para la Evaluaci—n y Acreditaci—n del Cuidado de Animales de Laboratorio. Todos los experimentos se realizaron manteniendo a los animales anestesiados. Justo antes de la inducci—n del IM se realizaron ecocardiograf’as 2D y 3D. Seguidamente se llev— a cabo un modelo de I-R tal y como est‡ descrito previamente por nuestro grupo (22).
En el primer grupo de animales, indujimos IAM en 10 cerdos (5 tratados con Fingolimod 1mg/kg IV 15 minutos antes de la reperfusi—n, 5 controles), que fueron sacrificados a las 24 horas post-IAM para la valoraci—n de la apoptosis y la activaci—n de rutas moleculares en la zona del borde del miocardio isquŽmico.
Para el an‡lisis a largo plazo, indujimos IAM en 14 animales. Los animales fueron aleatorizados a tratamiento con Fingolimod (1mg/kg IV, Cayman) 15 minutos antes de la reperfusi—n y una vez al d’a durante los siguientes 3 d’as, o con salino (grupo control) con un dise–o 1:1. Una semana post-IAM se tomaron im‡genes por resonancia magnŽtica (RM, para la cuantificaci—n de la funci—n del VI, ‡rea en riesgo –AAR-23 y tama–o de IAM) y ecocardiograf’a 2D y 3D para estudiar la mec‡nica del VI. As’ mismo se repitieron estas tŽcnicas 1 mes despuŽs del IM. Al finalizar las tŽcnicas de imagen los animales fueron evaluados por tŽcnicas invasivas de hemodin‡mica (an‡lisis de presi—n-volumen) y seguidamente sacrificados para la toma de muestras de tejido.
2.2. Inducci—n del Infarto Agudo de Miocardio
Doce horas antes de la inducci—n del IM todos los animales recibieron una dosis oral de clopidogrel150 mg. El d’a del IM la anestesia de los animales se indujo con telazol (6 mg/kg i.m.) y se mediante administraci—n intravenosa constante de propofol (10 mg/kg/hr). Los cerdos fueron medicados con 3000 UI de heparina IV, 75 mg de amiodarona IV y atropina (0,04mg/kg). Se administr— una perfusi—n continua a 2 ml/kg/hr que conten’a amiodarona 75 mg, cloruro de potasio 10mEq y atropina 0,04 mg/kg.
Llevamos a cabo el acceso arterial a travŽs de la arteria femoral por punci—n percut‡nea. Colocamos un introductor arterial de 7,5 French mediante tŽcnica de Seldinger e insertamos un catŽter gu’a coronario de 7 French desplaz‡ndolo hasta la arteria aorta ascendente hasta alcanzar el tronco coronario izquierdo. Realizamos una angiograf’a en el momento inicial. Bajo fluoroscopia, implantamos una gu’a coronaria en la arteria coronaria descendente anterior (DA). Sobre esa gu’a coronaria, implantamos un catŽter bal—n de angioplastia (TREK OTW Coronary Dilation Catheter 4.0 x 15 mm, Abbot Vascular) en el segmento proximal de la DA inmediatamente proximal a la salida de la primera rama septal. De esta manera indujimos el IM por oclusi—n de la DA proximal durante 60 minutos inflando el globo en la arteria coronaria a 10 atm. A lo largo de todo el proceso, mantuvimos a los animales monitorizados con un EKG y un sistema invasivo para la medida de la presi—n sangu’nea. Fue necesario prestar una atenci—n especial para la detecci—n temprana de arritmias ventriculares para llevar a cabo la desfibrilaci—n. Tras 60 minutos, deshinchamos el bal—n y retiramos el catŽter de la DA. La reperfusi—n fue documentada con un angiograma final. Retiramos entonces el introductor arterial y realizamos compresi—n manual sobre la zona de punci—n durante unos 15-20 minutos para hemostasia. El cuidado tras este procedimiento consisti— en cefazolina (25 mg/kg) como profilaxis antibi—tica, buprenorfina como profilaxis analgŽsica (0,1 mg/kg), e infusi—n continua de amiodarona (150 mg en 500 ml de salino, a pasar en 12 horas) como profilaxis antiarr’tmica.
2.3. Eutanasia
Inmediatamente tras la realizaci—n de RM y ecocardio, los animales fueron sacrificados por inyecci—n intravenosa de cloruro de potasio (20 mEq inyectados a travŽs del acceso venoso central en la vena femoral), se extrajeron los corazones y se realizaron siete cortes del mismo grosor a lo largo del eje corto del VI. Se recogieron muestras de tejido de la zona de la cicatriz, borde y remota, parte se incluy— y congel— en medio OCT (TissueTek, California) para los estudios histol—gicos y parte se congel— para el an‡lisis molecular. Visualizamos el tama–o final del infarto en los cortes restantes a travŽs de la tinci—n con cloruro de 2,3,5-trifenil tetrazolio (TTC) y se tomaron im‡genes de alta resoluci—n pudiendo diferenciar el ‡rea del infarto (blanco) y el miocardio normal (rojo). Las im‡genes se cuantificaron utilizando el software Image J (National Institutes of Health, Bethesda, MD). El volumen de infarto se expres— como porcentaje del volumen total del miocardio.
2.4. Imagen cardiaca por resonancia magnŽtica
Los estudios por resonancia magnŽtica (RM) se realizaron en un equipo de RM de 3.0 Tesla (Achieva, Philips Medical System, Netherlands). Se realiz— una secuencia de cine en el eje corto del VI (TR 3,6 ms, TE 1,6 ms, flipangle 45¼, campo de visi—n 250 x 250 mm)desde la base hasta el ‡pex del VI para la cuantificaci—n de los volœmenes, masa y fracci—n de eyecci—n del VI (FEVI). A continuaci—n realizamos una secuencia spin echo potenciada en T2(STIR, TR 2-3 latidos, TE 60 ms, TI 210 ms, campo de visi—n 250 x 250 mm, SENSE factor 3) para la medida del edema y determinaci—n del ‡rea en riesgo (AAR). Realizamos realce tard’o de gadolinio 15 minutos despuŽs de la administraci—n del gadolinio (Magnevist, 0,2 mmol/kg) usando una secuencia de inversi—n-recuperaci—n (TR 9 ms, TE 5,4 ms, TI optimizado para anular el miocardio sano, campo de visi—n 250 x 250 mm). DespuŽs del realce tard’o, infundimos dobutamina a 5µg/kg/min y repetimos la secuencia SSFP para la determinaci—n de la reserva contr‡ctil.
Todas las im‡genes de RM fueron analizadas de manera ciega usando un software comercial (Extended MR Workspace, Philips Medical Systems, Netherlands). Se trazaron los contornos del epicardio y del endocardio en cada una de las im‡genes SSFP para la obtenci—n de los volœmenes sist—licos y diast—licos finales (LVEDV y LVESV), FEVI y la masa del VI; por convenci—n, los mœsculos papilares se incluyeron en la cavidad del VI. Para la determinaci—n del AAR y de tama–o de IAM se delimitaron manualmente los bordes epic‡rdicos y endoc‡rdicos de cada uno de los cortes del eje corto en las secuencias STIR e inversi—n-recuperaci—n, respectivamente; las ‡reas hiperintensas (intensidad de se–al superior a tres veces la desviaci—n est‡ndar del miocardio remoto sano) defini— el AAR y la escara. El VI se dividi— en 16 segmentos y a cada segmento se le asign— una puntuaci—n del cero al cuatro, teniendo en cuenta el porcentaje de miocardio cicatrizado (0- sin cicatriz, 1- menos del 25% de cicatriz, 2- del 25 al 50% de cicatriz, 3- del 50 al 75% de cicatriz, 4- m‡s del 75% de cicatriz). La puntuaci—n final (el ’ndice de transmuralidad de la cicatriz) fue calculado como la suma de los 16 segmentos. El miocardio preservado se calcul— como la diferencia entre el ‡rea en riesgo (edema medido en secuencias SE potenciadas en T2) y el tama–o de la cicatriz (medida a partir del realce tard’o de gadolinio). El ’ndice de miocardio preservado del miocardio se calcul— como [çrea en Riesgo (g) – Tama–o de IAM (g)] / çrea en Riesgo (g) y expresado como porcentaje del VI.
2.5. Ecocardiograf’a
Realizamos ecocardiograf’a 2D con un sistema iE33 con transductor S5 (Philips Medical Systems, Andover, MA) de acuerdo con las recomendaciones de la Sociedad Americana de Ecocardiograf’a y de la Sociedad Europea de Ecocardiograf’a (24,25). Las im‡genes fueron analizadas con el software comercial Q-Lab (Philips Medical Systems, Andover, MA).Las im‡genes ecocardiogr‡ficas en 3D del volumen total se adquirieron con este mismo sistema iE33 utilizando un transductor X3 (Philips Medical Systems, Andover, MA). Se tuvo un especial cuidado a la hora de incluir la cavidad del VI dentro del volumen piramidal del transductor. Los ajustes para la adquisici—n de la imagen fueron optimizados para una visualizaci—n —ptima del endocardio y al menos se adquirieron y guardaron tres datos para las posteriores medidas. La imagen en 3D de la superficie del endocardio se construy— de una forma semiautom‡tica a lo largo del ciclo cardiaco. Seguidamente se ajust— manualmente la superficie si era necesario. Para determinar la deformaci—n global del miocardio, realizamos un an‡lisis de strain 3D utilizando el software 4D (Tom Tec Imaging Systems, Germany). Se seleccionaron vistas apicales a diferentes niveles de dos-c‡maras, cuatro-c‡maras y eje corto al final de la di‡stole. El VI se dividi— en 16 segmentos de tres dimensiones usando una segmentaci—n est‡ndar. Se midieron los strains longitudinal (LS), circunferencial (RS) y radial (RS) globales en 3D y se hizo la media de los 16 segmentos. El ’ndice de esfericidad del VI se calcul— como el cociente eje mayor (longitudinal) del VI / eje menor (transversal) del VI en un eje apical de cuatro-c‡maras (Figura 5C), como estaba descrito previamente (26). Calculamos el grosor relativo de la pared como 2 x Grosor de la Pared Posterior / Di‡metro del VI al final de la di‡stole (26).
2.6. Hemodin‡mica invasiva con microcatŽter
Las curvas de presi—n-volumen del VI se obtuvieron un mes despuŽs del infarto e inmediatamente antes del sacrificio para determinar las diferencias hemodin‡micas entre grupos. A travŽs de la arteria femoral, introdujimos un microcatŽter de tipo Millar de 7F (Millar Instruments Inc., Houston, TX) hasta el ‡pex del VI y tomamos durante las siguientes medidas: presi—n sist—lica, presi—n al final de la di‡stole, tasa m‡xima de cambio de la presi—n en el VI (dP/dt) m‡x, y trabajo cardiaco; el ’ndice de contractilidad fue calculado como (dP/dt) m‡x / (presi—n telesist—lica de VI – presi—n telediast—lica de VI). Cada par‡metro se calcul— a partir de la media de, al menos, tres ciclos cardiacos consecutivos.
2.7. Niveles plasm‡ticos de metanefrinas
Se tomaron muestras de plasma quince minutos tras la inserci—n del introductor arterial y teniendo al animal anestesiado y en un estado de reposo. Los niveles de metanefrinas se determinaron utilizando un mŽtodo de ELISA (Rocky Mountain Diagnostics Colorado Springs, Co).
2.8. An‡lisis histol—gico
Los corazones incluidos en OCT se cortaron a 8 µm y fueron usados para analizar fibrosis y tama–o de los cardiomiocitos en el tejido mioc‡rdico remoto, no isquŽmico y para la determinaci—n de la apoptosis en el tejido del borde del infarto. Para analizar el tama–o celular, se realiz— una inmunohistoqu’mica para vinculina (#V9131, Sigma-Aldrich). Para ello utilizamos tres cortes de cada muestra que fueron permeabillizados y bloqueados con Triton 0,3% y con BSA 1% respectivamente. El anticuerpo primario anti-vinculina a una diluci—n 1:100 fue incubado durante toda la noche y a 4¼C. Tras varios lavados con PBS, los cortes fueron incubados con el anticuerpo secundario, Alexa Fluor 488 Goat Anti-mouse (#A11001, Invitrogen) a una diluci—n 1:500 durante 1h a temperatura ambiente. Tras varios lavados con PBS, las preparaciones se montaron con medio de montaje con DAPI (#H-1500, Vector Lab) y se tomaron im‡genes digitales (microscopio Zeiss Axioplan2 y el programa Zeiss Axio Vision, Micro-optik). El ‡rea y tama–o de los cardiomiocitos fueron cuantificados con el programa Image J (National Institutes of Health, Bethesda, MD).
Para la determinaci—n de la fibrosis intersticial, se ti–eron 3 cortes de cada muestra con Rojo Sirio (Spectrum Chemical) de acuerdo con las especificaciones de la casa comercial. Las im‡genes fueron realizadas con luz polarizada (microscopio Zeiss Axioplan2 y el programa Zeiss Axio Vision (Micro-optik)). Se cuantific— y analiz— el ‡rea del miocardio positiva para esta tinci—n con el programa Image Pro Plus.
Para la determinaci—n de la apoptosis celular v’a fragmentaci—n del DNA se utiliz— un kit ensayo comercial de TUNEL (ApoTag¨ Florescein In Situ Apoptosis Detection Kit, Millipore) siguiendo el protocolo del manual. Para las cuantificaciones se analiz— un m’nimo de 10 campos con un objetivo 20X por corte.
2.9. Expresi—n de prote’nas
Para la preparaci—n del extracto proteico de las muestras de coraz—n se homogeneizaron unos 50 mg de miocardio congelado de cada uno de los animales (RIPA buffer (#R0278, Sigma-Aldrich) con inhibidores de proteasas y un sistema espec’fico de homogeneizado (Fast Prephomogenizer). DespuŽs de 20 minutos de centrifugaci—n a 30.000 g, la parte insoluble de la muestra fue descartada y el sobrenadante almacenado a -80¼C para posteriores estudios bioqu’micos. Para el estudio de la expresi—n de prote’nas, se cargaron 50 µg de prote’na junto con tamp—n de carga (40% β-mercaptoetanol, 8% SDS, 40% glicerol, 0,025% azul de bromofenol, and 0,25 mmol/L Tris, pH 6,4), y se llev— a cabo la separaci—n de las prote’nas por electroforesis en geles de acrilamida al 12%. Una vez separadas las prote’nas, se transfirieron a una membrana de nitrocelulosa y se incub— durante toda la noche y a 4¼C con los anticuerpos espec’ficos contra las prote’nas que quer’amos estudiar (Cell Signaling), anti-phospho-p44/42 MAPK (Erk1/2), p44/42 MAPK (Erk1/2), phospo-Akt (Thr308), and Akt (Thr308). La diluci—n usada para todos ellos fue 1:1000. Tras varios lavados con TBST, se las membranas se incubaron con el anticuerpo secundario conjugado con peroxidasa durante 1 hora a 4¼C (#RPN4301, Amersham) a una diluci—n. Un anticuerpo monoclonal anti-GAPDH (#G8795, Sigma-Aldrich) se us— como control de carga. Para la visualizaci—n de las bandas en las pel’culas autorradiogr‡ficas utilizamos el sustrato quimioluminiscente ECL-Plus (#RPN2132, Amersham). Las pel’culas fueron densitometradas y analizadas con el programa Image J.
2.10. An‡lisis estad’stico
Los resultados est‡n expresados como la media ± error est‡ndar. La comparaci—n entre ambos grupos, cerdos tratados con Fingolimod y grupo control, se realiz— con el test t-test para las medidas tomadas en un œnico tiempo. Para aquellas medidas tomadas a una semana y a un mes despuŽs de la inducci—n del IM, los datos se analizaron mediante una ANOVA de medidas repetidas seguidos de un an‡lisis post-hoc Tukey para determinar si hab’a diferencias entre los grupos. Todos los an‡lisis se realizaron con el programa estad’stico SPSS 18.0 (SPSS Inc., Chicago, Illinois). ònicamente fueron consideradas significativas aquellas con una p < 0,05.
3. resultados y discusi—n
La activaci—n de S1P-R con Fingolimod en el periodo pre-reperfusi—n redujo la apoptosis de los cardiomiocitos en la zona isquŽmica 24 horas despuŽs del IAM
La activaci—n de S1P con Fingolimod dio lugar a una reducci—n significativa del nœmero de nœcleos positivos para la tinci—n de TUNEL indicando una disminuci—n de la apoptosis de los cardiomiocitos (Figura 1A-B) en el grupo Fingolimod. La tŽcnica de Western blot confirma estos resultados pues se observa una disminuci—n de la activaci—n de prote’nas proapopt—ticas Caspasa-3 y p53 y un aumento en la activaci—n de la prote’na antiapopt—tica Bcl-2.
Adem‡s, evaluamos la ruta molecular RISK (Reperfusion Injury Salvaje Kinases), la principal ruta de protecci—n de los cardiomiocitos contra el da–o por I-R, que actœa a travŽs de la fosforilaci—n de Akt, PKC-ε y GSK-3β. Nuestros resultados muestran que la fosforilaci—n de Akt, PKC-ε y GSK-3β estaba incrementada significativamente en los cerdos tratados con Fingolimod comparado con los controles (Figura 1C-D). Estos datos indican que la activaci—n de S1P-R con Fingolimod en el periodo pre-reperfusi—n activa la ruta RISK y promueve la citoprotecci—n de los cardiomiocitos.
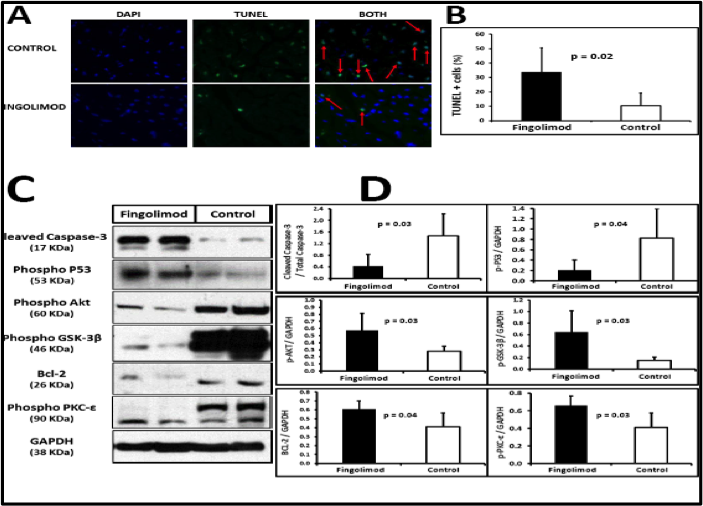
Figura 1.-El tratamiento con Fingolimod redujo la apoptosis en el miocardio isquŽmico. A: Im‡genes representativasde DAPI (indicando los nœcleos en azul) y de TUNEL (indicando los nœcleos apopt—ticos en verde) en inmunofluorescencia. Los nœcleos positivos para TUNEL se calcularon a partir de las im‡genes superpuestas TUNEL+DAPI. B: La cuantificaci—n de las cŽlulas TUNEL+ muestra menor porcentaje de cŽlulas apopt—ticas en los cerdos tratados Fingolimod. C y D: Western blot revela menor activaci—n de prote’nas pro-apopt—ticas(caspasa-3 activa o cleaved caspase-3, p-P53) y mayor activac’on de prote’nas anti-apopt—ticas(p-Akt, p-GSK3-β, Bcl-2, p-PKC-ε) en el miocardio isquŽmico de los cerdos tratados con Fingolimod. Im‡genes representativas de Western bloten C, cuantificaci—n en D.
La activaci—n de S1P-R con Fingolimod redujo el tama–o de infarto, aument— el miocardio preservado y mejor— la funci—n sist—lica del VI (FSVI) 1 semana despuŽs del IAM
La activaci—n de S1P-R con Fingolimod dio lugar a un tama–o de infarto significativamente menor tanto en tŽrminos de masa infartada absoluta como en porcentaje de miocardio de VI infartado en comparaci—n con los cerdos control (Figura 2A-B, Tabla 1). Dado que AAR medida mediante RM fue similar en ambos grupos (Figura 2C-D, Tabla 1), la activaci—n de S1P-R en el periodo pre-reperfusi—n aument— el porcentaje de miocardio preservado (Figura 2E, Tabla 1). De hecho, el porcentaje de miocardio preservado fue 5 veces mayor en los cerdos tratados con Fingolimod que en el grupo control. El ’ndice de transmuralidad, una medida alternativa por RM del tama–o de infarto, tambiŽn era significativamente menor al cabo de 1 mes en los cerdos tratados con Fingolimod (Figura 2F).
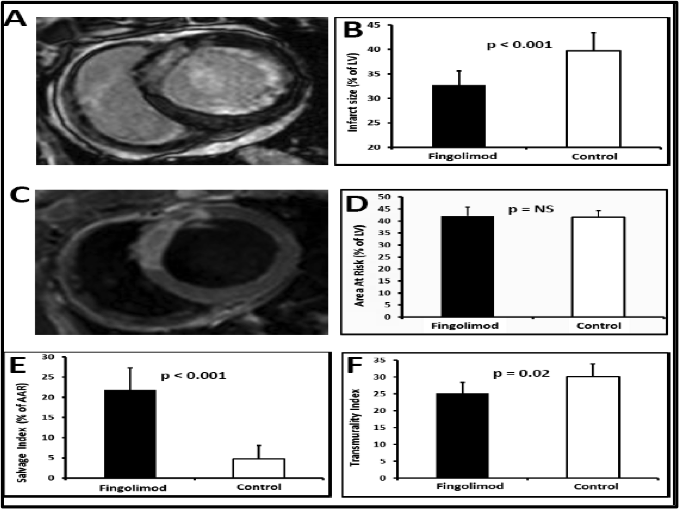
Figura 2.- El tratamiento con Fingolimodredujo el tama–o de infarto y aument— el miocardio preservado una semana post-IAM. A: Im‡genes representativas de RM cardiaca para realce tard’o de gadolino. Las zonas hiperintensas (blanco) representan el miocardio infartado. B: Cuantificaci—n de tama–o mediante RM; el tama–o de IAM era menor en los cerdos tratados con Fingolimod. C: Im‡genes representativas de RM cardiaca para edema. Las zonas hiperintensas (blanco) representan el ‡rea en riesgo (AAR), el miocardio sometido a isquemia. D: Cuantificaci—n de AAR mediante RM, que era similar en ambos grupos. E: El tratamiento con Fingolimodaument— significativamente el miocardio preservado. F: El ’ndice de transmuralidad, una medida alternative de tama–o de IAM, asisismo mostr— que el tama–o de IAM era significativamente menor en los cerdos tratados con Fingolimod. Infarctsize: Tama–o de IAM. Area At Risk: Miocardio en riesgo. MyocardialSalvage: Miocardio preservado. TransmuralityIndex: êndice de transmuralidad.
Inicialmente, FEVI por ecocardiograf’a-3D y los strain tridimensionales eran similares en ambos grupos pre-IAM (Tabla 2),por lo que hab’a diferencias en la funci—n sist—lica del VI antes de la inducci—n del infarto. Queremos resaltar que el aumento en miocardio preservado debido a la activaci—n de S1P-R con Fingolimod mejor— la funci—n contr‡ctil al cabo de 1 semana. La FEVI era significativamente mayor en el grupo Fingolimod que en el grupo control tanto por RM (Figura 3A, Tabla 1) como por ecocardiograf’a-3D (Tabla 2). Adem‡s, 1 semana post-IAM, tanto el strain tridimensional longitudinal (3D-LS), el strain tridimensional radial (3D-RS) como el strain tridimensional circunferencial (3D-CS) estaban m‡s preservados en los cerdos tratados con Fingolimod que en los controles (Figura 4, Tabla 2).
La activaci—n de S1P-R redujo el tama–o de IAM y mejor— la FSVI un mes post-IAM
Al igual que 1 semana post-IAM, el tama–o de infarto medido por RM un mes post-IAM era significativamente menor en los cerdos tratados con Fingolimod en comparaci—n con los controles (Tabla 1). Adem‡s, el ’ndice de transmuralidad tambiŽn era significativamente menor en los cerdos tratados con Fingolimod. La reducci—n en el tama–o final de infarto fue confirmada por histolog’a utilizando la tinci—n con TTC (23,32±3,78 vs 29,73±4,92 % del volumen del VI para el grupo Fingolimod y control respectivamente, p=0,02). Hubo adem‡s una excelente correlaci—n entre el tama–o de infarto al cabo de un mes cuantificado por LGE y por tinci—n con TTC (r=0,90, p=0,01).
Tabla 1.- Resultados de RM cardiaca una semana y un mes post-IAM.
1 semana post-IAM |
1 mes post-IAM |
|||||
Control |
Fingolimod |
p-Value |
Control |
Fingolimod |
p-Value |
|
Tama–o de IAM (% de VI) |
39,69±3,71 |
32,76±2,88 |
0,002 |
32,22±4,44 |
25,47±4,60 |
0,01 |
çrea en Riesgo (% de VI) |
41,63±2,74 |
42,01±3,74 |
0,83 |
|||
Miocardio preservado (% de çrea en Riesgo) |
4,78±3,28 |
22,86±5,39 |
<0,001 |
|||
Miocardio preservado (% de VI) |
1,93±1,22 |
9,26±2,84 |
<0,001 |
|||
êndice de transmuralidad |
26,43±3,64 |
20,83±3,87 |
26,43±3,64 |
20,83±3,87 |
0,04 |
|
Masa de VI (g) |
60,54±4,71 |
52,43±2,43 |
0,01 |
72,18±5,53 |
62,97±3,91 |
0,005 |
VTDVI (ml) |
83,70±15,35 |
73,57±15,87 |
0,25 |
118,33±22,14 |
96,96±15,98 |
0,08 |
VTSVI (ml) |
55,86±12,08 |
44,72±11,14 |
0,1 |
79,61±19,15 |
55,09±13,50 |
0,02 |
FEVI (%) |
33,61±2,84 |
39,61±4,16 |
0,008 |
33,30±4,26 |
43,68±5,85 |
0,001 |
Volumen Latido de VI (ml) |
27,86±3,56 |
29,01±5,35 |
0,64 |
38,73±3,77 |
41,85±5,14 |
0,23 |
Peak ejection rate (ml/ms) |
0,16±0,04 |
0,29±0,04 |
<0,001 |
|||
ΔLVEF, Incremento de FEVI desde 1 semana a 1 mes post-IAM (%) |
0,24±2,20 |
3,93±1,83 |
0,004 |
|||
Reserva contr‡ctil (FEVI maxima con dobutamina, %) |
35,94±8,21 |
55,66±10,34 |
0,007 |
|||
Reserva contr‡ctil (ΔLVEF con dobutamine, %) |
2,88±3,70 |
11,99±5,56 |
0,01 |
|||
FEVI: Fracci—n de Eyecci—n del VI. VTDVI: Volumen TeleDiast—lico del VI. VTSVI: Volumen TeleSist—lico del VI.
La activaci—n de S1P-R tambiŽn result— en una mejora de la funci—n sist—lica un mes post-IAM. Los animales tratados con Fingolimod mostraron mayor FEVI que los cerdos control tanto por RM (Tabla 1) como por ecocardiograf’a-3D (Tabla 2). Adem‡s, en los cerdos Fingolimod la FEVI por RM mejor— en el periodo comprendido entre una semana y un mes mientras que se mantuvo igual en los cerdos control (Figura 3B, cambio absoluto de FEVI 3,9±1,8% vs. -0,2±2,2% en el grupo Fingolimod y control respectivamente, p=0,004). Adem‡s, la reserva contr‡ctil con dobutamina estaba aumentada en los animales tratados con Fingolimod (Figura 3C), incremento absoluto en la FEVI 12±5,5% vs. 2,8±3,7% en el grupo Fingolimod y control respectivamente, p=0,01).
Tabla 2.- Resultados de ecocardiograf’a 3D pre-IAM, una semana y un mes post-IAM.
Control |
Fingolimod |
P-value |
|
3D-FEVI pre-IAM (%) |
71,59 ± 3,03 |
71,50 ± 1,34 |
0,95 |
3D-FEVI 1 semana post-IAM (%) |
32,98 ± 4,88 |
40,15 ± 5,02 |
0,04 |
3D-FEVI 1 mes post-IAM (%) |
34,24 ± 5,26 |
44,71 ± 6,96 |
0,001 |
3D-VTDVI pre-IAM (mL) |
43,81 ± 4,38 |
40,97 ± 6,46 |
0,37 |
3D-VTDVI 1 semana post-IAM (mL) |
66,94 ± 6,40 |
62,32 ± 7,68 |
0,31 |
3D-VTDVI 1 mes post-IAM (mL) |
93,99 ± 17,70 |
81,03 ± 15,39 |
0,18 |
3D-VTSVI pre-IAM (mL) |
12,4 ± 1,15 |
11,67 ± 1,89 |
0,41 |
3D-VTSVI 1 semana post-IAM (mL) |
45,06 ± 7,25 |
37,30 ± 5,29 |
0,07 |
3D-VTSVI 1 mes post-IAM (mL) |
65,27 ± 17,35 |
45,33 ± 12,64 |
0,03 |
3D-Strain Longitudinal - pre-IAM (%) |
-21,4 ± 1,45 |
-22,13 ± 3,0 |
0,60 |
3D-Strain Longitudinal - 1 semana post-IAM (%) |
-9,33 ± 2,81 |
-14,43 ± 1,77 |
0,005 |
3D-Strain Longitudinal - 1 mes post-IAM (%) |
-11,35 ± 1,70 |
-16,34 ± 1,95 |
<0,001 |
3D-Strain Circunferencial- pre-IAM (%) |
-27,18 ± 4,08 |
-24,5 ± 5,3 |
0,37 |
3D-Strain Circunferencial – 1 semana post-IAM (%) |
-10,73 ± 2,72 |
-17,06 ± 5,35 |
0,04 |
3D-Strain Circunferencial – 1 mes post-IAM (%) |
-11,86 ± 3,81 |
-16,6 ± 3,94 |
0,03 |
3D-Strain Radial- pre-IAM (%) |
129,42 ± 46,31 |
120,21 ± 31,41 |
0,69 |
3D-Strain Radial – 1 semana post-IAM (%) |
26,94 ± 9,82 |
55,95 ± 20,42 |
0,03 |
3D-Strain Radial – 1 mes post-IAM (%) |
32,77 ± 10,59 |
62,51 ± 20,45 |
0,005 |
FEVI: Fracci—n de Eyecci—n del VI. VTDVI: Volumen TeleDiast—lico del VI. VTSVI: Volumen TeleSist—lico del VI.
Las tŽcnicas de hemodin‡mica invasiva corroboraron la mejor funci—n sist—lica en el grupo Fingolimod, pues presentaba dP/dtm‡x, trabajo latido (strokework) ’ndice de contractilidad y presi—n telesist—lica del VI significativamente mayores que los controles (Figura 3D-F, Tabla 3).
Para caracterizar mejor la FSVI, determinamos la funci—n mec‡nica del VI mediantes strain-3D. Los cerdos tratados con Fingolimod mostraron significativamente mejores 3D-LS, 3D-CS y 3D-RS un mes post-IAM que los controles (Tabla 2 y Figura 4).
La activaci—n de S1P-R con Fingolimod en el periodo pre-reperfusi—n mitig— el remodelado anat—mico del ventr’culo izquierdo un mes despuŽs del IM.
Las caracter’sticas anat—micas del remodelado psot-IAM del VI son dilataci—n del VI con incremento en los volœmenes del VI, hipertrofia compensatoria del VI con aumento en la masa del VI y cambios en la morfolog’a del VI (desde la geometr’a el’ptica habitual hacia una conformaci—n m‡s esfŽrica). La excesiva activaci—n de la respuesta neurohormonal con activaci—n del sistema simp‡tico (expresado como altos niveles de catecolaminas en plasma) tambiŽn es un componente importante.
Tabla 3.- Medidas de funcion sist—lica de VI mediante hemodin‡mica invasiva un mes post-IAM.
Control |
Fingolimod |
P-value |
|
Presi—n TeleSist—lica de VI (mmHg) |
95,00 ± 10,88 |
116,60 ± 19,68 |
0,03 |
dP/dtmax (mmHg/s) |
1056,15 ± 261,03 |
1865,88 ± 147,46 |
< 0,001 |
êndice de Contractilidad (1/s) |
13,84 ± 1,53 |
19,06 ± 3,11 |
< 0,001 |
Trabajo Latido |
2395,67 ± 401,80 |
3269,91 ± 968,46 |
0,047 |
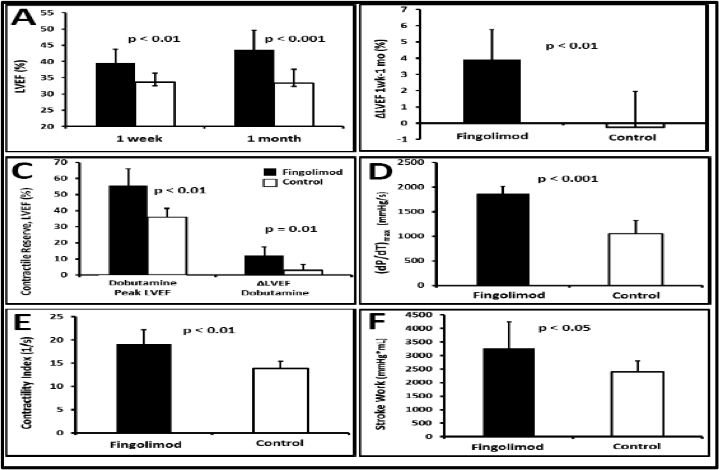
Figura 3.- El tratamiento con Fingolimod mejor— la funcion sist—lica post-IAM del VI evaluada mediante RM cardiaca (A-C) y mediante hemodin‡mica invasiva (curvas de presi—n-volumen, D-F). Los cerdos tratados con Fingolimod (columnas negras) mostraron una mejor funci—n sist—lica del VI comparado con el grupo control (columnas blancas): A) FEVI 1 semana post-IAM y 1 mes post-IAM, B) mejor’a de la FEVI desde 1 semana post-IAM a un mes post-IAM, C) reserva contr‡ctil con dobutamina, D) (dP/dt)max, E) ’ndice de contractilidad, and F) trabajo latido. LVEF: Fracci—n de Eyecci—n del VI o FEVI. Contractile Reserve: Reserva Contr‡ctil. ContractilityIndex: ’ndice de contractilidad. SrokeWork: Trabajo Latido.
La RM mostr— que los animales tratados con Fingolimod presentaban una masa del VI significativamente menos que los controles (Tabla 1). Cabe destacar que exist’a una correlaci—n inversa entre la masa del VI y la FEVI (r=-0,72, p<0,001), y una correlaci—n directa entre la masa del VI y el tama–o del infarto (r=0,65, p<0,001). Esto indica que los animales con mayor tama–o de infarto y menor FEVI muestran una mayor hipertrofia compensatoria. Los animales tratados con Fingolimod tambiŽn presentaron menor ’ndice de grosor de la pared (0,34±0,03 vs. 0,40±0,05, p=0,03), confirmando que el grupo Fingolimod presentaba una respuesta hipertr—fica menor.
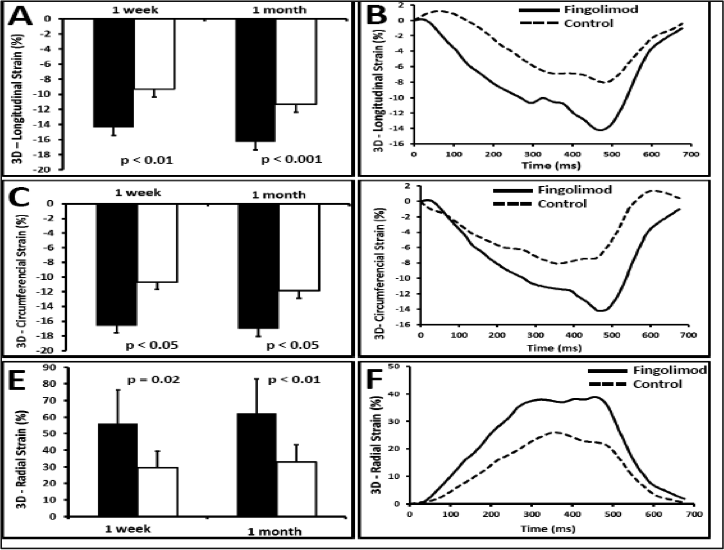
Figura 4.- El tratamiento con Fingolimod mejor— la mec‡nica mioc‡rdica evaluada mediante strain por ecocardiograf’a tridimensional. Los cerdos tratados con Fingolimod (columnas negras) mostraron una mejor contractilidad mioc‡rdica comparado con el grupo control (columnas blancas), tanto en strain 3D longitudinal (A), como en strain 3D circunferencial (C) como en strain 3D radial (E) una semana post-IAM y un mes post-IAM. Los paneles B, D y F muestra ejemplos representativos de la curvas de strain tridimensional de ambos grupos (control y Fingolimod).
Adem‡s, la RM demostr— que la activaci—n de S1P-R daba lugar a una reducci—n en la dilataci—n del VI al cabo de un mes del IM. Espec’ficamente, los cerdos tratados con Fingolimod mostraron significativamente menor Volumen Tele Sist—lico (LVESV) que los controles (Tabla 1). Adem‡s encontramos una fuerte tendencia (aunque no estad’sticamente significativa) a un menor Volumen TeleDiast—lico (LVEDV) en los cerdos tratados con Fingolimod (p=0,08, Figura 5B, Tabla 1).
Para evaluar los cambios geomŽtricos del VI se midi— tambiŽn el ’ndice de esfericidad del VI por ecocardiograf’a 2D. El ’ndice de esfericidad del VI fue 1,61±0,11 en los animales tratados con Fingolimod en comparaci—n con 1,37±0,14 en el grupo control (Figura 5C y 5D, p=0,01), que indica una menor deformaci—n del VI en el grupo Fingolimod.
Los niveles de metanefrinas en plasma estaban reducidos en los cerdos tratados con Fingolimod (285,11±366,85 vs. 774,21±158,42 pg/mL, p=0,045), lo que indica una menor activaci—n neurohormonal simp‡tica en el grupo Fingolimod.
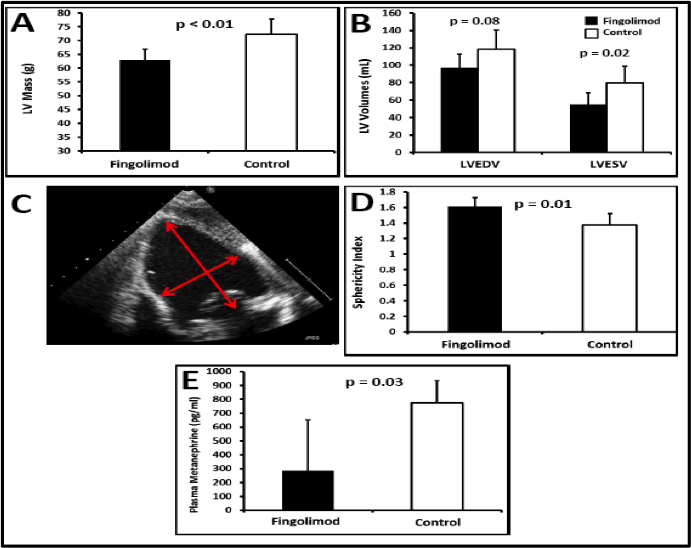
Figura 5.- El tratamiento con Fingolimod mitig— el remodelado anat—mico post-IAM. A: Los animales tratados con Fingolimod mostraban menor masa de VI, lo que indica menor hipertrofia compensadora en el grupo Fingolimod. B: Los cerdos tratados con Fingolimod mostraban unos volœmenes telesist—licos (LVESV) menores que los controles, y una tendencia hacia unos menores volœmenes telediast—licos (LVEDV) que el grupo control. C: El ’ndice de esfericidad del VI se calcul— como el cociente eje mayor (longitudinal) del VI / eje menor (transversal) del VI en un eje apical de cuatro-c‡maras en ecocardiograf’a bidimensional. D: Los animales tratados con Fingolimod mostraban menor cambio en el ’ndice de esfericidad, lo que indica que sufr’an menos cambios en la morfolog’a, en la arquitectura, en la forma del VI. E: Los animales tratados con Fingolimod presentaban menores niveles plasm‡ticos de metanefrinas, lo que indica menor activaci—n neurohormonal del sistema nervioso simp‡tico en el grupo Fingolimod. LV Mass: Masa de VI. LV Volumes: Volœmenes de VI. LVEDV: Volumen telediast—lico de VI. LVESV: Volumen telesist—lico de VI. Sphericity index: ’ndice de esfericidad.
El tratamiento con Fingolimod redujo la hipertrofia compensatoria del cardiomiocito y el acœmulo de fibrosis intersticial en el tejido mioc‡rdico remoto, no infartado
Los cambios histol—gicos del remodelado post-IAM son principalmente hipertrofia celular de los cardiomiocitos y aumento de la fibrosis mioc‡rdica intersticial en el tejido remoto no infartado.
El tama–o del cardiomiocito un mes post-IAM era menor en el grupo Fingolimod evaluado mediante marcajade vinculina por inmunohistoqu’mica. Los animales tratados con Fingolimod presentaron un per’metro celular menor (157,92±19,93 vs. 175,95±7,94 µm, p=0,045) y un ‡rea celular transversal menor (1751,56±436,39 vs. 2198,45±290,17 µm2 , p=0,049) que los controles (Figura 6A-E), lo cual indica una menor respuesta hipertr—fica compensatoria en el grupo Fingolimod.
La hipertrofia del cardiomiocito en el contexto del remodelado del VI est‡ mediada por la activaci—n (fosforilaci—n) de Akt y de ERK 1/2. En concordancia con los resultados histol—gicos, la activaci—n de S1P-R por Fingolimod da lugar a una reducci—n significativa en la fosforilaci—n de Akt (0,33±0,32 vs 0,94±0,5, p=0,02) and ERK1/2 (0,16±0,03 vs 0,82±0,08, p=0,04) (Figura 7).
Finalmente, exist’a menos fibrosis intersticial un mes post-IAM en el miocardio remoto no infartado en los animales tratados con Fingolimod en comparaci—n con los controles (rojo picrosirio: 8,42±0,87% vs. 10,10±1,58% del miocardio respectivamente, p=0,03, Figura 6F-J).

Figura 6.- El tratamiento con Fingolimodredujo el remodelado histol—gico en el miocardio remoto no infartado un mes post-IAM. A-E: Medida del tama–o de los cardiomiocitos. Im‡genes representativas de inmunohistoqu’mica con vinculina y DAPI (la membrana de los cardiomiocitosest‡ marcada en verde, los nœcleos en azul) que muestra el tama–o de los cadiomiocitos en el grupo Fingolimod (A, detalle en B) y grupo control (C, detail in D). E: Los animales tratados con Fingolimod mostraban menor tama–o de cardiomiocitos que el grupo control, resultado de una menor hipertrofia de VI. F-J: Medida de fibrosis interstiticial mioc‡rdica. Im‡genes representativas de tinci—n con rojo sirio en brightfield (F y H, col‡geno en rojo, cardiomiocitos en amarillo)y luz polarizada (G e I, col‡geno en amarillo y verde, el resto del tejido en negro) de un cerdo del grupo Fingolimod(F y G) y de un cerdo del grupo control (H e I). J: Los animales tratados con Fingolimod mostraban menor porcentaje de fibrosis intersticial en miocardio que los controles. Cardiomyocyte perimeter: Per’metro de los cardiomiocitos.
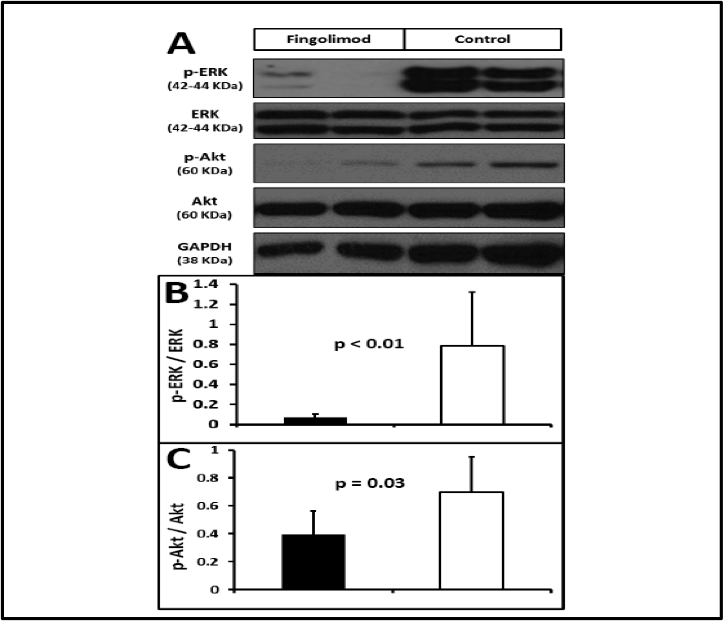
Figura 7.- El tratamiento con Fingolimod redujo el remodelado molecular un mes post-IAM, pues hab’a menor activaci—n (fosforilaci—n) de ERK1/2 y de Akten el miocardio remoto no infartado un mes post-IAM. A: Western blotde p-ERK, ERK, p-Akt, Akt, y GAPDH (control de carga). B: Los animales tratados con Fingolimod presentaban menor activaci—n de ERK1/2, demostrado por un menor cociente pERK/ERK. Este hallazgo apoya una menor hipertrofia en el grupo Fingolimod. C: El tratamiento con Fingolimod se asociaba con una menor activaci—n (fosforilaci—n) de Akt, consistente con menor est’mulo hacia la hipertrofia de VI. p-ERK: ERK1/2fosforilado. P-Akt: Aktfosforilado.
4. DISCUSIîN
En este estudio examinamos los efectos cardioprotectores del agonista del receptor de S1P Fingolimod en un modelo porcino de I-R. El principal hallazgo de este estudio es que la activaci—n de S1P-R con Fingolimod inmediatamente pre-reperfusi—n da lugar a un mayor miocardio preservado, una disminuci—n del tama–o de infarto y una mejora en la funci—n sist—lica del VI. Estos efectos est‡n mediados por la activaci—n de la ruta molecular cardioprotectora RISK que promueve una reducci—n en la apoptosis en los cardiomiocitos. Adem‡s, el tratamiento pre-reperfusi—n con Fingolimod reduce el remodelado adverso del ventr’culo izquierdo que tiene lugar tras el infarto, tanto a nivel macrosc—pico como a nivel microsc—pico, y produce una normalizaci—n del eje catecolaminŽrgico.
Nuestra estrategia final consiste en intentar reducir el tama–o de IAM mediante la administraci—n de un f‡rmaco antiapopt—tico durante el traslado en ambulancia del paciente con IAM al hospital, es decir incluso antes de la reperfusi—n. Para facilitar la aplicaci—n de nuestros hallazgos a la pr‡ctica cl’nica, elegimos Fingolimod, el œnico agonista de S1P-R aprobado para uso humano.
Papel de S1P en el da–o por I-R
Limitar el tama–o del infarto es de gran importancia puesto que se trata de un par‡metro clave en la morbilidad y mortalidad. La restauraci—n del flujo sangu’neo en el miocardio isquŽmico puede parad—jicamente activar apoptosis (da–o por I-R), siendo la lesi—n por I-R responsable hasta del 50% del tama–o de IAM (2,3). El lisofosfol’pido SP1 ha sido reconocido recientemente como un mediador clave en la fisiolog’a celular (5). La esfingosina es un derivado del l’pido de membrana esfingomielina por la v’a de las ceramidas. S1P es producto de la fosforilaci—n de la esfingosina, reacci—n catalizada por una esfingosinakinasa. El concepto del re—stato de esfingosina fue introducido para expresar el balance entre ceramida, que es proapopt—tica, y S1P, que activa rutas de supervivencia (27). Dado el papel fundamental dela apoptosis en el da–o por I-R, la funci—n de S1P como antiapopt—tico representa una nueva diana farmacol—gica para disminuir este da–o.
S1P promueve la supervivencia de los cardiomiocitos en experimentos in vitro llevados a cabo en condiciones de hipoxia, tanto en cŽlulas neonatales (10) como en cŽlulas adultas (11) de ventr’culo de rata. S1P induce adem‡s resistencia al da–o por I-R en experimentos in vivo en corazones aislados de ratones (12) y de rata (13) wild-type. Los ratones deficientes en esfingosinakinasa (la enzima responsable de la s’ntesis de S1P) mostraban un da–o mioc‡rdico por I-R m‡s severo que los controles (28), mientras que la sobreexpresi—n de esfingosinakinasa (mediante transfecci—n con adenovirus) proteg’a al miocardio del da–o por I-R (14). Adem‡s, ratones deficientes en S1P-R mostraron un tama–o de infarto mayor que los ratones controles (15). Asimismo, S1P es un mediador clave en el precondicionamiento y en el postcondicionamiento, dos estrategias de cardioprotecci—n establecidas. De hecho, el precondicionamiento y el postcondicionamiento reducen el tama–o de infarto en corazones wild-type pero ninguno de ellos fue cardioprotector en corazones deficientes en esfingosinakinasa o en S1P-R (13,28,29). Finalmente, se ha demostrado que HDL reduce el tama–o de infarto in vivo (30); este efecto est‡ mediado por S1P ya que el efecto cardioprotector de HDL se pierde en ratones deficientes en S1P-R y durante el tratamiento con antagonistas de S1P-R. Todos estos resultados apuntan hacia un prometedor papel de S1P en la prevenci—n del da–o por I-R. Nosotros decidimos estudiar Fingolimod en nuestros experimentos puesto que es el œnico agonista de S1P-R aprobado por la FDA, lo que facilitar’a la aplicaci—n de esta estrategia terapŽutica a la pr‡ctica cl’nica.
La apertura del poro de permeabilidad mitocondrial (MPTP) es el responsable final de la apoptosis mediada por el da–o por I-R. En concreto, est‡ demostrado que la prevenci—n de la apertura del MPTP reduce el tama–o del infarto (31). La principal ruta molecular involucrada en la inhibici—n de la apertura del MPTP es la ruta RISK (32), que conlleva la fosforilaci—n (activaci—n) de Akt y PKC-ε y la fosforilaci—n (inactivaci—n) de GSK3-β. De hecho, nuestros resultados demuestran que Fingolimod da lugar a la activaci—n de Akt y PKC-ε y a la inactivaci—n de GSK3-β a las 24 horas post-IAM. Estos datos son consistentes con estudios in vitro preliminares que muestran que Fingolimod previene la apoptosis de los cardiomiocitos expuestos a condiciones de hipoxia mediante la activaci—n de la ruta RISK (19), demostrando nuestros resultados el mismo proceso in vivo. Como resultado, los cerdos tratados con Fingolimod presentaron una reducci—n de la apoptosis celular medida por ensayo TUNEL y un incremento de la expresi—n de la prote’na antiapopt—tica Bcl-2 24 horas despuŽs del IAM. Estos mecanismos celulares ser’an la causa de la mejora en la recuperaci—n del miocardio y a la disminuci—n del tama–o del infarto en los cerdos tratados con Fingolimod.
La activaci—n de S1P-R con Fingolimod reduce el tama–o de infarto y mejora la funci—n sist—lica del VI
Nuestros resultados demuestran que Fingolimod reduce el tama–o de infarto, determinado por tŽcnicas no invasivas (RM) y por tinci—n post-mortem (TTC). Ambos mŽtodos mostraron una reducci—n del 20% en el tama–o del infarto en el grupo tratado con Fingolimod. Este resultado tiene mucha importancia ya que el tama–o de infarto es un predictor independiente de pron—stico de enfermedad cardiovascular, incluso tras ajustar por FEVI (33-37).
Existe siempre una variaci—n entre animales en el tama–o de infarto debido a las variaciones de la anatom’a coronaria de cada animal. Para solucionar este problema, no s—lo medimos el tama–o de infarto sino que tambiŽn calculamos el ‡rea en riesgo (el miocardio sometido a isquemia que ser‡ necrosado si no se trata a tiempo) (22,23). El miocardio preservado (la proporci—n de miocardio en riesgo que es salvado con una intervenci—n terapŽutica, en nuestro caso el tratamiento con Fingolimod) es 5 veces mayor en los cerdos tratados con Fingolimod que en los cerdos control. Este hecho es de gran importancia ya que el miocardio preservado per se es un par‡metro que predice de forma independiente eventos cardiovasculares adversos, incluso tras ajustar con el tama–o de infarto (38).
Adem‡s, la reducci—n del tama–o de IAM se correlaciona con una mejora en la FSVI. El grupo Fingolimod mostr— una FEVI mayor a una semana y a un mes post-IAM (tanto por RM como por Eco-3D) y una mayor recuperaci—n de la FEVI que el grupo control. Adem‡s el grupo tratado con Fingolimod present— una mejor reserva contr‡ctil que el grupo control. Estos resultados son importantes ya que tanto una FEVI m‡s preservada (39) como la presencia de reserva contr‡ctil (36,40) indican ambos mejor pron—stico cardiovascular.
Encontramos asimismo que la deformaci—n mioc‡rdica estaba m‡s preservada en los cerdos tratados con Fingolimod. La FEVI es un par‡metro cl’nicamente muy utilizado pero que presenta ciertos inconvenientes (dependiente de precarga, asunciones geomŽtricas que no son ciertas ante alteraciones de contractilidad segmentarias post-IAM). Por ello, recientemente se ha desarrollado el an‡lisis de strain mediante ecocardiograf’a, una herramienta nueva que permite una evaluaci—n m‡s detallada de la mec‡nica del miocardio (41) y que predice eventos cl’nicos mejor que la FEVI en pacientes con IAM previo (42,43). Nuestros datos indican claramente que el tratamiento con Fingolimod mejora los tres strains tridimensionales (strain longitudinal, circunferencial y radial) en comparaci—n con el grupo control. Estos hallazgos apoyan la reducci—n en el tama–o de infarto y la mejora de la FSVI en el grupo Fingolimod asimismo mostrada por FEVI y por las curvas de presi—n-volumen.
La activaci—n de S1P-R con Fingolimod reduce el remodelado del VI
A pesar de que el tama–o de infarto es un predictor importante de la mortalidad tras un IM, la disfunci—n sist—lica cr—nica y el remodelado adverso del VI tras el IM son importantes determinantes de la morbilidad del paciente y de los eventos a largo plazo (44). Nuestros datos son los primeros en demostrar que el tratamiento agudo con Fingolimod no s—lo reduce el da–o por I-R y disminuye el tama–o de infarto a corto plazo sino que sus efectos beneficiosos se extienden al periodo cr—nico pues adem‡s mitiga el desarrollo de miocardiopat’a isquŽmica y remodelado cardiaco adverso.
El remodelado cardiaco se define como los cambios en la expresi—n genŽtica, molecular, celular e intersticial que se manifiestan cl’nicamente como cambios en el tama–o, forma y funcionalidad del coraz—n ante el da–o cardiaco (45). Los cambios macrosc—picos que caracterizan el remodelado del VI conllevan dilataci—n de los volœmenes del VI e incremento en la masa del VI que dan lugar al desarrollo de una hipertrofia compensatoria y cambios en la arquitectura del VI haciendo que pierda su forma el’ptica habitual (forma de bala) para tomar una forma m‡s esfŽrica. En nuestro estudio, los corazones de los cerdos tratados con Fingolimod presentaban menor dilataci—n post-IAM que el grupo control; en concreto, el volumen telesist—lico (LVESV), el mejor predictor de eventos adversos en remodelado del VI (46,47), era significativamente menor en el grupo tratado con el agonista de S1P-R analizado tanto por RM como por ecocardiograf’a 3D.
Finalmente, la hipertrofia del cardiomiocito del tejido mioc‡rdico remoto no infartado es un mecanismo compensatorio inicial importante, pero si se prolonga en el tiempo provoca incremento en la masa del VI y se convierte en un proceso negativo asociado a eventos adversos (48). Los efectos cardioprotectores de la activaci—n de S1P-R en el momento del IM redujeron el nivel de remodelado compensatorio del VI, como muestra la menor masa del VI, la menor activaci—n de Akt y ERK1/2 y el menor tama–o del cardiomiocito en los cerdos tratados con Fingolimod un mes post-IAM. Akt y ERK1/2 son importantes inductores del crecimiento y supervivencia de los miocitos; mientras que la activaci—n (fosforilaci—n) aguda y puntual de Akt da lugar a una disminuci—n de la apoptosis, la activaci—n cr—nica de Akt y de ERK da lugar a hipertrofia, aspecto clave en el remodelado adverso del VI (49) y relacionado con efectos negativos sobre el miocardio (50). Por ello, la disminuci—n de los ratios pAkt/Akt y pErk/Erk en el tejido mioc‡rdico remoto no infartado en los cerdos tratados con Fingolimod, un mes despuŽs del IM, es un reflejo del menor remodelado del VI presente en este grupo, mientras que la elevaci—n de pAkt en el miocardio isquŽmico a las 24 horas post-IAM en el grupo tratado con Fingolimod es el resultado de una mayor activaci—n de las rutas de supervivencia mediadas por S1P-R (resultado consistente con una menos tasa de apoptosis en el grupo Fingolimod). La reducci—n en la hipertrofia de los cardiomiocitos (tanto tama–o como per’metro) a nivel histol—gico en el grupo Fingolimod apoya adem‡s esta disminuci—n de la hipertrofia del VI. Finalmente, la fibrosis mioc‡rdica intersticial en el miocardio remoto no isquŽmico, otro marcador de remodelado cardiaco (44,45,51), era menor en los cerdos tratados con Fingolimod, lo que corrobora la prevenci—n de remodelado del VI producida por la activaci—n de S1P-R.
La activaci—n cr—nica de la respuesta neurohormonal, especialmente del sistema nervioso simp‡tico (52), es un componente principal en el remodelado del VI. De hecho, los niveles plasm‡ticos de catecolaminas son un importante predictor de la mortalidad cardiovascular en pacientes tras un IAM (53,54). En este estudio, nos hemos enfocado en medir los productos de degradaci—n de las catecolaminas plasm‡ticas (metanefrinas) ya que presentan una mayor estabilidad y representan la actividad neurohormonal a largo plazo (55). Curiosamente, los niveles plasm‡ticos de metanefrinas eran menores en el grupo Fingolimod que en el grupo control, lo que indica un menor remodelado post-IAM en los animales tratados con agonismo de S1P-R.
Limitaciones del estudio
Nuestro estudio presenta varias limitaciones. En primer lugar no podemos estar seguros de si los beneficios de Fingolimod en la prevenci—n del remodelado cardiaco post-IAM se deben exclusivamente a la reducci—n inicial del tama–o de IAM o si la activaci—n de S1P-R per se posee efectos anti-remodelado. De hecho, el tratamiento cr—nico con Fingolimod previno el remodelado patol—gico del VI en otro estudio en modelo murino de sobrecarga de presi—n (56). No obstante, dado que nosotros administramos el f‡rmaco a lo largo de un periodo de tiempo muy limitado (pre-reperfusi—ny durante 3 d’as post-IAM), creemos que la prevenci—n del remodelado del VI en nuestro modelo se debe a una reducci—n del tama–o de IAM y no a un efecto cr—nico directo de Fingolimod en el miocardio no isquŽmico. Sin embargo, m‡s estudios son necesarios para responder esta pregunta.
La enfermedad coronaria en humanos est‡ asociada frecuentemente con comorbilidades que no est‡n presentes en este modelo animal como por ejemplo hipertensi—n, diabetes mellitus o hiperlipidemia. Por otro lado, no sabemos quŽ potencia podr’a tener la activaci—n de S1P-R sobre el remodelado cardiaco con las terapias mŽdicas est‡ndar con beta-bloqueantes, inhibidores de la ECA y los antagonistas de la aldosterona. Por lo tanto, la eficacia cl’nica de la activaci—n de S1P-R en el contexto del IAM tendr’a que ser investigada en pacientes humanos.
5. CONCLUSIONES
Como conclusi—n, nuestros datos proporcionan un apoyo al concepto de la intervenci—n farmacol—gica con el agonista de S1P-R Fingolimod en la reducci—n de los efectos deletŽreos del IAM en un contexto experimental. Hemos demostrado por primera vez que la activaci—n de S1P-R con Fingolimod antes de la reperfusi—n mejora el miocardio preservado y reduce el tama–o de infarto, dando lugar a una mejora de la funci—n sist—lica y de la mec‡nica del VI y a una reducci—n del remodelado del VI en un modelo con animales grandes. Estos efectos cardioprotectores de Fingolimod en un contexto agudo est‡n mediados por la activaci—n de la ruta RISK y la reducci—n de la apoptosis. Estos hallazgos muestran el potencial terapŽutico de la se–alizaci—n de S1P-R en el periodo peri-infarto y justifica futuros estudios en pacientes humanos.
6. referencias
1. De Luca G.; Suryapranata H.; Ottervanger JP.; Antman EM. Time delay to treatment and mortality in primary angioplasty for acute myocardial infarction, every minute of delay counts. Circulation 109(10), 1223-1225 (2004).
2. Yellon DM.; Hausenloy DJ. Myocardial reperfusion injury. N Engl J Med 357(11), 1121-1135 (2007).
3. Hausenloy DJ.; Yellon DM. Myocardial ischemia-reperfusion injury, a neglected therapeutic target. J Clin Invest 123(1), 92-100 (2013).
4. Karliner JS. Sphingosine kinase and sphingosine 1-phosphate in the heart, a decade of progress. Biochim Biophys Acta 1831(1), 203-212 (2012).
5. Spiegel S.; Milstien S. Sphingosine-1-phosphate, an enigmatic signalling lipid. Nat Rev Mol Cell Biol 4(5), 397-407 (2003).
6. Man K.; Ng KT.; Lee TK.; Lo CM.; Sun CK.; Li XL.; Zhao Y.; Ho JW.; Fan ST. FTY720 attenuates hepatic ischemia-reperfusion injury in normal and cirrhotic livers. Am J Transplant 5(1), 40-49 (2005).
7. Delbridge MS.; Shrestha BM.; Raftery AT.; El Nahas AM.; Haylor JL. Reduction of ischemia-reperfusion injury in the rat kidney by FTY720.; a synthetic derivative of sphingosine. Transplantation 84(2), 187-195, (2007).
8. Laychock SG.; Sessanna SM.; Lin MH.; Mastrandrea LD. Sphingosine 1-phosphate affects cytokine-induced apoptosis in rat pancreatic islet beta-cells. Endocrinology 147(10), 4705-4712 (2006)
9. Hasegawa Y.; Suzuki H.; Sozen T.; Rolland W.; Zhang JH. Activation of sphingosine 1-phosphate receptor-1 by FTY720 is neuroprotective after ischemic stroke in rats. Stroke 41(2), 368-374 (2010).
10. Karliner JS.; Honbo N.; Summers K.; Gray MO.; Goetzl EJ. The lysophospholipids sphingosine-1-phosphate and lysophosphatidic acid enhance survival during hypoxia in neonatal rat cardiac myocytes. J Mol Cell Cardiol 33(9), 1713-1717 (2001).
11. Tao R.; Zhang J.; Vessey DA.; Honbo N.; Karliner JS. Deletion of the sphingosine kinase-1 gene influences cell fate during hypoxia and glucose deprivation in adult mouse cardiomyocytes. Cardiovasc Res 74(1), 56-63 (2007).
12. Jin ZQ.; Zhou HZ.; Zhu P.; Honbo N.; Mochly-Rosen D.; Messing RO.; Goetzl EJ.; Karliner JS.; Gray MO. Cardioprotection mediated by sphingosine-1-phosphate and ganglioside GM-1 in wild-type and PKC epsilon knockout mouse hearts. Am J Physiol Heart Circ Physiol 282(6), H1970-1977 (2002).
13. Lecour S.; Smith RM.; Woodward B.; Opie LH.; Rochette L.; Sack MN. Identification of a novel role for sphingolipid signaling in TNF alpha and ischemic preconditioning mediated cardioprotection. J Mol Cell Cardiol 34(5), 509-518 (2002).
14. Duan HF.; Wang H.; Yi J.; Liu HJ.; Zhang QW.; Li LB.; Zhang T.; Lu Y.; Wu CT.; Wang LS. Adenoviral gene transfer of sphingosine kinase 1 protects heart against ischemia/reperfusion-induced injury and attenuates its postischemic failure. Hum Gene Ther 18(11), 1119-1128 (2007).
15. Means CK.; Xiao CY.; Li Z.; Zhang T.; Omens JH.; Ishii I.; Chun J.; Brown JH. Sphingosine 1-phosphate S1P2 and S1P3 receptor-mediated Akt activation protects against in vivo myocardial ischemia-reperfusion injury. Am J Physiol Heart Circ Physiol 292(6), H2944-2951 (2007)
16. Brinkmann V.; Billich A.; Baumruker T.; Heining P.; Schmouder R.; Francis G.; Aradhye S.; Burtin P. Fingolimod (FTY720), discovery and development of an oral drug to treat multiple sclerosis. Nat Rev Drug Discov 9(11), 883-897 (2010)
17. Kappos L.; Radue EW.; O'Connor P.; Polman C.; Hohlfeld R.; Calabresi P.; Selmaj K.; Agoropoulou C.; Leyk M.; Zhang-Auberson L.; Burtin P. A placebo-controlled trial of oral fingolimod in relapsing multiple sclerosis. N Engl J Med 362(5), 387-401 (2010).
18. Cohen JA.; Barkhof F.; Comi G.; Hartung HP.; Khatri BO.; Montalban X.; Pelletier J.; Capra R.; Gallo P.; Izquierdo G.; Tiel-Wilck K.; de Vera A.; Jin J.; Stites T.; Wu S.; Aradhye S.; Kappos L. Oral fingolimod or intramuscular interferon for relapsing multiple sclerosis. N Engl J Med 362(5), 402-415 (2010)
19. Zhang J.; Honbo N.; Goetzl EJ.; Chatterjee K.; Karliner JS.; Gray MO. Signals from type 1 sphingosine 1-phosphate receptors enhance adult mouse cardiac myocyte survival during hypoxia. Am J Physiol Heart Circ Physiol 293(5), H3150-3158 (2007).
20. Hofmann U.; Burkard N.; Vogt C.; Thoma A.; Frantz S.; Ertl G.; Ritter O.; Bonz A. Protective effects of sphingosine-1-phosphate receptor agonist treatment after myocardial ischaemia-reperfusion. Cardiovasc Res 83(2), 285-293 (2009).
21. Egom EE.; Mohamed TM.; Mamas MA.; Shi Y.; Liu W.; Chirico D.; Stringer SE.; Ke Y.; Shaheen M.; Wang T.; Chacko S.; Wang X.; Solaro RJ.; Fath-Ordoubadi F.; Cartwright EJ.; Lei M. Activation of Pak1/Akt/eNOS signaling following sphingosine-1-phosphate release as part of a mechanism protecting cardiomyocytes against ischemic cell injury. Am J Physiol Heart Circ Physiol 301(4), H1487-1495 (2011).
22. Ibanez B.; Prat-Gonzalez S.; Speidl WS.; Vilahur G.; Pinero A.; Cimmino G.; Garcia MJ.; Fuster V.; Sanz J.; Badimon JJ. Early metoprolol administration before coronary reperfusion results in increased myocardial salvage, analysis of ischemic myocardium at risk using cardiac magnetic resonance. Circulation 115(23), 2909-2916 (2007).
23. Aletras AH.; Tilak GS.; Natanzon A.; Hsu LY.; Gonzalez FM.; Hoyt RF.; Jr..; Arai AE. Retrospective determination of the area at risk for reperfused acute myocardial infarction with T2-weighted cardiac magnetic resonance imaging, histopathological and displacement encoding with stimulated echoes (DENSE) functional validations. Circulation 113(15), 1865-1870 (2006).
24. Lang RM.; Bierig M.; Devereux RB.; Flachskampf FA.; Foster E.; Pellikka PA.; Picard MH.; Roman MJ.; Seward J.; Shanewise JS.; Solomon SD.; Spencer KT.; Sutton MS.; Stewart WJ. Recommendations for chamber quantification, a report from the American Society of Echocardiography's Guidelines and Standards Committee and the Chamber Quantification Writing Group.; developed in conjunction with the European Association of Echocardiography.; a branch of the European Society of Cardiology. J Am Soc Echocardiogr 18(12), 1440-1463 (2005)
25. Mor-Avi V.; Lang RM.; Badano LP.; Belohlavek M.; Cardim NM.; Derumeaux G.; Galderisi M.; Marwick T.; Nagueh SF.; Sengupta PP.; Sicari R.; Smiseth OA.; Smulevitz B.; Takeuchi M.; Thomas JD.; Vannan M.; Voigt JU.; Zamorano JL. Current and evolving echocardiographic techniques for the quantitative evaluation of cardiac mechanics, ASE/EAE consensus statement on methodology and indications endorsed by the Japanese Society of Echocardiography. J Am Soc Echocardiogr 24(3), 277-313 (2011).
26. Savu O.; Jurcut R.; Giusca S.; van Mieghem T.; Gussi I.; Popescu BA.; Ginghina C.; Rademakers F.; Deprest J.; Voigt JU. Morphological and functional adaptation of the maternal heart during pregnancy. Circ Cardiovasc Imaging 5(3), 289-297 (2012).
27. Cuvillier O.; Pirianov G.; Kleuser B.; Vanek PG.; Coso OA.; Gutkind S.; Spiegel S. Suppression of ceramide-mediated programmed cell death by sphingosine-1-phosphate. Nature 381(6585), 800-803 (1996).
28. Jin ZQ.; Zhang J.; Huang Y.; Hoover HE.; Vessey DA.; Karliner JS. A sphingosine kinase 1 mutation sensitizes the myocardium to ischemia/reperfusion injury. Cardiovasc Res 76(1), 41-50 (2007).
29. Jin ZQ.; Goetzl EJ.; Karliner JS. Sphingosine kinase activation mediates ischemic preconditioning in murine heart. Circulation 110(14), 1980-1989 (2004).
30. Theilmeier G.; Schmidt C.; Herrmann J.; Keul P.; Schafers M.; Herrgott I.; Mersmann J.; Larmann J.; Hermann S.; Stypmann J.; Schober O.; Hildebrand R.; Schulz R.; Heusch G.; Haude M.; von Wnuck Lipinski K.; Herzog C.; Schmitz M.; Erbel R.; Chun J.; Levkau B. High-density lipoproteins and their constituent.; sphingosine-1-phosphate.; directly protect the heart against ischemia/reperfusion injury in vivo via the S1P3 lysophospholipid receptor. Circulation 114(13), 1403-1409 (2006).
31. Piot C.; Croisille P.; Staat P.; Thibault H.; Rioufol G.; Mewton N.; Elbelghiti R.; Cung TT.; Bonnefoy E.; Angoulvant D.; Macia C.; Raczka F.; Sportouch C.; Gahide G.; Finet G.; Andre-Fouet X.; Revel D.; Kirkorian G.; Monassier JP.; Derumeaux G.; Ovize M. Effect of cyclosporine on reperfusion injury in acute myocardial infarction. N Engl J Med 359(5), 473-481 (2008).
32. Ovize M.; Baxter GF.; Di Lisa F.; Ferdinandy P.; Garcia-Dorado D.; Hausenloy DJ.; Heusch G.; Vinten-Johansen J.; Yellon DM.; Schulz R. Postconditioning and protection from reperfusion injury, where do we stand? Position paper from the Working Group of Cellular Biology of the Heart of the European Society of Cardiology. Cardiovasc Res 87(3), 406-423 (2010).
33. Kwong RY.; Chan AK.; Brown KA.; Chan CW.; Reynolds HG.; Tsang S.; Davis RB. Impact of unrecognized myocardial scar detected by cardiac magnetic resonance imaging on event-free survival in patients presenting with signs or symptoms of coronary artery disease. Circulation 113(23), 2733-2743 (2006).
34. Cheong BY.; Muthupillai R.; Wilson JM.; Sung A.; Huber S.; Amin S.; Elayda MA.; Lee VV.; Flamm SD. Prognostic significance of delayed-enhancement magnetic resonance imaging, survival of 857 patients with and without left ventricular dysfunction. Circulation 120(21), 2069-2076 (2009).
35. Yan AT.; Shayne AJ.; Brown KA.; Gupta SN.; Chan CW.; Luu TM.; Di Carli MF.; Reynolds HG.; Stevenson WG.; Kwong RY. Characterization of the peri-infarct zone by contrast-enhanced cardiac magnetic resonance imaging is a powerful predictor of post-myocardial infarction mortality. Circulation 114(1), 32-39 (2006).
36. Kelle S.; Roes SD.; Klein C.; Kokocinski T.; de Roos A.; Fleck E.; Bax JJ.; Nagel E. Prognostic value of myocardial infarct size and contractile reserve using magnetic resonance imaging. J Am Coll Cardiol 54(19), 1770-1777 (2009).
37. Wu E.; Ortiz JT.; Tejedor P.; Lee DC.; Bucciarelli-Ducci C.; Kansal P.; Carr JC.; Holly TA.; Lloyd-Jones D.; Klocke FJ.; Bonow RO. Infarct size by contrast enhanced cardiac magnetic resonance is a stronger predictor of outcomes than left ventricular ejection fraction or end-systolic volume index, prospective cohort study. Heart 94(6), 730-736 (2008).
38. Masci PG.; Ganame J.; Strata E.; Desmet W.; Aquaro GD.; Dymarkowski S.; Valenti V.; Janssens S.; Lombardi M.; Van de Werf F.; L'Abbate A.; Bogaert J. Myocardial salvage by CMR correlates with LV remodeling and early ST-segment resolution in acute myocardial infarction. JACC Cardiovasc Imaging 3(1), 45-51 (2010).
39. Solomon SD.; Anavekar N.; Skali H.; McMurray JJ.; Swedberg K.; Yusuf S.; Granger CB.; Michelson EL.; Wang D.; Pocock S.; Pfeffer MA. Influence of ejection fraction on cardiovascular outcomes in a broad spectrum of heart failure patients. Circulation 112(24), 3738-3744 (2005).
40. Williams MJ.; Odabashian J.; Lauer MS.; Thomas JD.; Marwick TH. Prognostic value of dobutamine echocardiography in patients with left ventricular dysfunction. J Am Coll Cardiol. 27(1), 132-139 (1996).
41. Geyer H.; Caracciolo G.; Abe H.; Wilansky S.; Carerj S.; Gentile F.; Nesser HJ.; Khandheria B.; Narula J.; Sengupta PP. Assessment of myocardial mechanics using speckle tracking echocardiography, fundamentals and clinical applications. Journal of the American Society of Echocardiography , official publication of the American Society of Echocardiography 23(4), 351-369, quiz 453-355 (2010).
42. Stanton T.; Leano R.; Marwick TH. Prediction of all-cause mortality from global longitudinal speckle strain, comparison with ejection fraction and wall motion scoring. Circulation. Cardiovascular imaging 2(5), 356-364 (2009).
43. Hung CL.; Verma A.; Uno H.; Shin SH.; Bourgoun M.; Hassanein AH.; McMurray JJ.; Velazquez EJ.; Kober L.; Pfeffer MA.; Solomon SD.; investigators V. Longitudinal and circumferential strain rate.; left ventricular remodeling.; and prognosis after myocardial infarction. Journal of the American College of Cardiology 56(22), 1812-1822 (2010).
44. Konstam MA.; Kramer DG.; Patel AR.; Maron MS.; Udelson JE. Left ventricular remodeling in heart failure, current concepts in clinical significance and assessment. JACC Cardiovasc Imaging 4(1), 98-108 (2011).
45. Cohn JN.; Ferrari R.; Sharpe N. Cardiac remodeling--concepts and clinical implications, a consensus paper from an international forum on cardiac remodeling. Behalf of an International Forum on Cardiac Remodeling. Journal of the American College of Cardiology 35(3), 569-582 (2000).
46. White HD.; Norris RM.; Brown MA.; Brandt PW.; Whitlock RM.; Wild CJ. Left ventricular end-systolic volume as the major determinant of survival after recovery from myocardial infarction. Circulation 76(1), 44-51 (1987).
47. Migrino RQ.; Young JB.; Ellis SG.; White HD.; Lundergan CF.; Miller DP.; Granger CB.; Ross AM.; Califf RM.; Topol EJ. End-systolic volume index is a strong predictor of early and late mortality. The GUSTO-I Angiographic Investigators. Circulation 96(1), 116-121 (1997).
48. Verma A.; Meris A.; Skali H.; Ghali JK.; Arnold JM.; Bourgoun M.; Velazquez EJ.; McMurray JJ.; Kober L.; Pfeffer MA.; Califf RM.; Solomon SD. Prognostic implications of left ventricular mass and geometry following myocardial infarction, the VALIANT (VALsartan In Acute myocardial iNfarcTion) Echocardiographic Study. JACC Cardiovasc Imaging 1(5), 582-591 (2008).
49. van Berlo JH.; Maillet M.; Molkentin JD. Signaling effectors underlying pathologic growth and remodeling of the heart. J Clin Invest 123(1), 37-45 (2013).
50. Haq S.; Choukroun G.; Lim H.; Tymitz KM.; del Monte F.; Gwathmey J.; Grazette L.; Michael A.; Hajjar R.; Force T.; Molkentin JD. Differential activation of signal transduction pathways in human hearts with hypertrophy versus advanced heart failure. Circulation 103(5), 670-677 (2001).
51. Gonzalez A.; Ravassa S.; Beaumont J.; Lopez B.; Diez J. New targets to treat the structural remodeling of the myocardium. J Am Coll Cardiol 58(18), 1833-1843 (2011).
52. Lymperopoulos A.; Rengo G.; Koch WJ. Adrenergic nervous system in heart failure, pathophysiology and therapy. Circ Res 113(6), 739-753 (2013).
53. Francis GS.; Cohn JN.; Johnson G.; Rector TS.; Goldman S.; Simon A. Plasma norepinephrine.; plasma renin activity.; and congestive heart failure. Relations to survival and the effects of therapy in V-HeFT II. The V-HeFT VA Cooperative Studies Group. Circulation. 87(6 Suppl), VI40-48 (1993).
54. Benedict CR.; Shelton B.; Johnstone DE.; Francis G.; Greenberg B.; Konstam M.; Probstfield JL.; Yusuf S. Prognostic significance of plasma norepinephrine in patients with asymptomatic left ventricular dysfunction. SOLVD Investigators. Circulation. 94(4), 690-697 (1996).
55. Raake PW.; Schlegel P.; Ksienzyk J.; Reinkober J.; Barthelmes J.; Schinkel S.; Pleger S.; Mier W.; Haberkorn U.; Koch WJ.; Katus HA.; Most P.; Muller OJ. AAV6.betaARKct cardiac gene therapy ameliorates cardiac function and normalizes the catecholaminergic axis in a clinically relevant large animal heart failure model. Eur Heart J 34(19), 1437-1447 (2013).