REVISIîN |
Tratamientos experimentales contra el virus ƒbola Zaire
M» del Carmen Avenda–o L—pez1
1Real Academia Nacional de Farmacia, AcadŽmica de Nœmero
e-mail: avendano@ucm.es
An. Real Acad. Farm. Vol. 80, N¼ 4 (2014), pag.649-665
resumen
Se analizan las caracter’sticas de los filovirus, en especial del virus Ebola Zaire, as’ como varios tratamientos experimentados hasta el momento. Se incluyen vacunas, anticuerpos monoclonales, prote’na C activada, prote’na c2 recombinante de nematodos, interferones, RNAs de interferencia, oligonucle—tidos antisentido (f—sosforodiamidato morfolino olig—meros), y antimetabolitos (inhibidores de RNA polimerasa RNA-dependiente). Hacemos hincapiŽ en los fundamentos, dianas erapŽuticas, mecanismos de acci—n, objetivos y situaci—n actual. TambiŽn se comentan algunos antivirales descubiertos por mŽtodos de cribado al azar y proyectos para un futuro inmediato. |
Palabras clave: ƒbola; vacunas; tratamientos experimentales.
abstract
Experimental treatments against Zaire Ebola virus
The characteristics of filoviruses of the genus Ebolavirus, especially of Zaire Ebola virus, as well as several experimental treatments are analyzed. We include vaccines, monoclonal antibodies, recombinant human activated protein C, recombinant nematode anticoagulant protein c2, interferons, RNA interference, antisense ologonucleotides (phosphorodiamidate morpholino oligomers), and antimetabolites (RNA polimerase RNA-dependent inhibitors). We emphasize the fundamental principles, drug targets, action mechanisms, aims, and actual situation. We also comment some antiviral compounds found by throughput screening and near projects. |
Keywords: Ebola virus; vaccines; experimental treatments.
1. INTRODUCci—N
El jueves 30 de octubre de 2014, la Real Academia Nacional de Farmacia celebr— una tertulia cient’fica con el tema: "EBOLA: breve recapitulaci—n sobre etiolog’a, epidemiolog’a, patogenia, tratamiento y control", en la que actu— como ponente el Prof. Dr. Rafael Rotger Anglada, Catedr‡tico de Microbiolog’a y Director del Centro de An‡lisis Sanitarios de la UCM. En su documentada intervenci—n mencion— el tratamiento que segœn fuentes sanitarias se administr— a la auxiliar de cl’nica Teresa Romero, la primera europea contagiada fuera de çfrica que, afortunadamente, fue felizmente curada. Este acto, as’ como la avalancha de informaci—n producida como consecuencia del actual brote de ƒbola (1), nos ha impulsado a elaborar una revisi—n que contemple gran parte de los esfuerzos realizados para la prevenci—n y el tratamiento de esta epidemia.
2. CARACTERêSTICAS DEL VIRUS ƒBOLA ZAIRE
Dentro de los filovirus, denominados as’ por su aspecto filamentoso, el gŽnero Ebolavirus comprende cinco serotipos o especies. A excepci—n de la especie Ebola Reston encontrada en Filipinas, todas las dem‡s producen fiebre hemorr‡gica y una alta tasa de mortalidad en las personas. La especie Ebola Zaire (EBO-Z) tiene un periodo de incubaci—n de 3-21 d’as, tras el cual los pacientes presentan s’ntomas gripales hasta que se produce una progresi—n muy r‡pida caracterizada por hemorragias y finalmente un fracaso multiorg‡nico (2). El primer brote documentado de esta especie se produjo en 1976 en la Repœblica Democr‡tica del Congo, anteriormente denominada Zaire, y aunque desde entonces ha causado 34 epidemias en distintos pa’ses del çfrica sub-Sahariana, ninguna ha causado la alarma de la actual por su posible diseminaci—n al resto del mundo.
Un grave problema a la hora de estudiar vacunas o f‡rmacos contra este virus es disponer de modelos animales adecuados ya que, aunque esta especie es letal para los ratones reciŽn nacidos, los ratones adultos (que suelen ser los modelos m‡s comunes para los estudios in vivo) son resistentes a la infecci—n, por lo que si se utilizan para estos prop—sitos hay que manipularlos (3). Los macacos son por el momento el mejor modelo animal.
El genoma del virus ƒbola consiste en una molŽcula œnica de ARN monocatenario lineal de polaridad negativa, por lo que no sirve directamente de ARN mensajero sino que mediante una RNA polimerasa v’rica debe originar primero una copia complementaria que traduce las siete prote’nas que posee el viri—n. Este est‡ formado por un nucleoide con forma tubular rodeado por una c‡psida helicoidal (Figura 1). El nucleoide est‡ constituido por una nucleoprote’na (N) y la mencionada RNA polimerasa (L). La c‡psida est‡ recubierta de una membrana en la que se integra una glicoprote’na (GP), y en ella se encuentran tambiŽn la prote’na VP30 (que permite al viri—n desdoblarse dentro de una cŽlula hospedadora), la VP35, y las prote’nas VP24 y VP40 (que forman una matriz que mantiene unidos el nucleoide y la c‡psida).
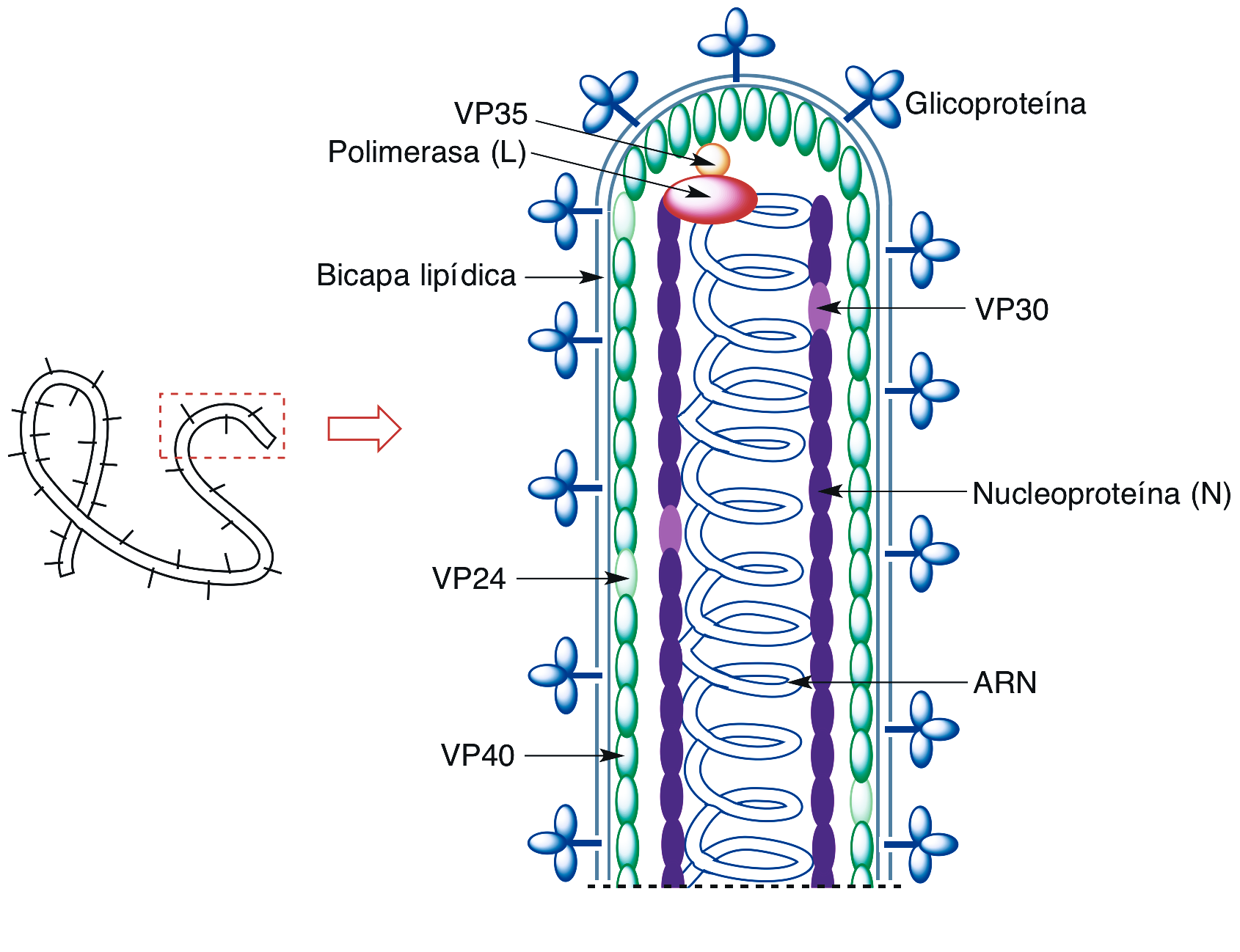
Figura 1.- Representaci—n de un viri—n ƒbola.
Los filovirus penetran en el citoplasma de la cŽlula hospedadora a travŽs de la fusi—n de su membrana externa con la membrana de endosomas, compartimentos de transporte desde la membrana plasm‡tica a los lisosomas. En este proceso son especialmente importantes las glicoprote’nas presentes en dicha membrana que, al experimentar procesos de proteolisis y de reordenamiento, facilitan dicha fusi—n y la posterior internalizaci—n del virus. El Žxito obtenido en el desarrollo de antivirales y anticuerpos que tienen como objetivo impedir la entrada al interior celular de virus pat—genos, incluyendo los virus de la gripe o el HIV, ha requerido un conocimiento detallado de los correspondientes mecanismos de entrada. Este conocimiento ha demostrado que muchas de las prote’nas virales que intervienen en la fusi—n e internalizaci—n de distintos virus poseen lazos con residuos hidr—fobos (fusion loops, FL). En el caso del virus ƒbola Zaire se ha determinado la estructura de estos lazos (4) (Figura 2) y cu‡les son los residuos de amino‡cidos que son cr’ticos (5).
Estudios in vitro tambiŽn han demostrado que un receptor de la glicoprote’na
v’rica es la prote’na Niemann-Pick C1 (NPC1), conocida por su importante papel
en el transporte de colesterol (6). En estos estudios se utilizaron como
inhibidores de NPC1 derivados de adamantano, por ejemplo el compuesto 1, observ‡ndose que cuanto menor es la
capacidad para transportar el colesterol mayor es la capacidad para resistir la
infecci—n del virus del ƒbola.
Figura 2.- Estructura de un lazo de fusi—n del virus ƒbola, generada a partir de pdb 2LCY y representada con Chimera 1.81.
Sin embargo, este hallazgo no ha conducido por el momento a ninguna actuaci—n terapŽutica, ya que el uso de estos inhibidores inducir’a la enfermedad denominada Niemann-Pick de tipo C, una enfermedad rara de origen hereditario con una prevalencia de un caso por cada 150.000 habitantes que es consecuencia de mutaciones en las prote’nas NPC1 y NPC2. Esta enfermedad afecta fundamentalmente a ni–os de edad escolar y conduce a un desenlace fatal por la acumulaci—n de colesterol en los lisosomas de tejidos y —rganos (7).
Tras la entrada en el citoplasma, el genoma v’rico se replica y transcribe, se sintetizan las correspondientes prote’nas y brotan nuevos viriones al exterior (Figura 3).
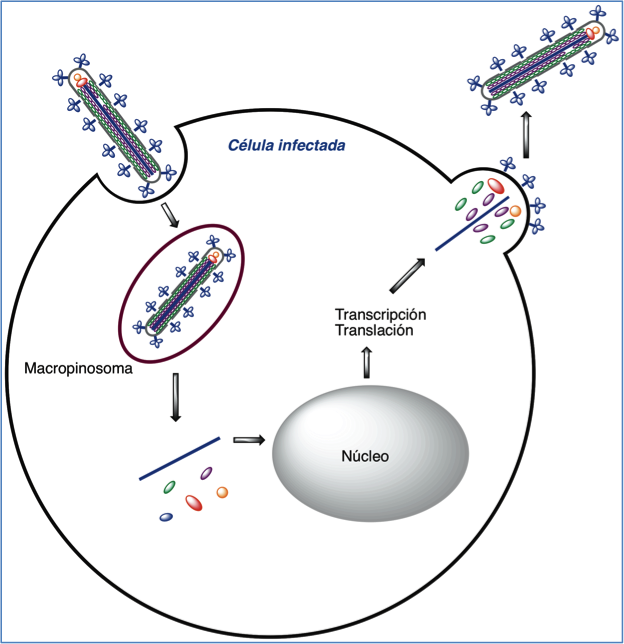
Figura 3.- Ciclo vital del virus ƒbola.
3. tratamientos experimentales. vacunas
El desarrollo de vacunas eficaces es la mejor manera de contener y atajar la epidemia e incluso podr’a ser m‡s f‡cil que para otros virus ARN como el VIH (8). Hasta el momento se han desarrollado mœltiples vacunas experimentales que han demostrado su eficacia utilizando primates como animales modelo, pero no hay todav’a ninguna aprobada para uso humano (Figura 4).
Figura 4.- Vacunas frente al virus ƒbola Zaire |
Tampoco se ha aprobado hasta el momento ningœn f‡rmaco, ya sea molŽcula peque–a o biol—gica. Aunque se han investigado varios, muy pocos han iniciado ensayos cl’nicos en humanos. Por ello, el tratamiento de los enfermos en çfrica se ha limitado al uso de cuidados paliativos. Estos cuidados, junto a los mŽtodos empleados para prevenir la transmisi—n, todav’a no han resuelto el actual brote. Comentaremos algunos de los tratamientos estudiados, centr‡ndonos en los fundamentos en que se han basado.
4. ANTICUERPOS MONOCLONALES
El desarrollo de anticuerpos monoclonales (mAbs) anti-ƒbola est‡ basado en el mismo principio que las vacunas: la administraci—n de anticuerpos que estimulen el sistema inmune del paciente para que responda de forma m‡s r‡pida y eficaz al virus. Entre ellos se incluyen los mAbs quimŽricos humanizados de rat—n c13C6, h-13F6, y c6D8, cuya mezcla se denomina MB-300. Tras la administraci—n de MB-300 a macacos una hora despuŽs de la infecci—n por virus ƒbola, estos animales mostraron una viremia baja o nula (10). Por otra parte, tres mAbs murinos: m1H3, m2G4 y m4G7, componentes de otro c—ctel denominado ZMAb, se humanizaron para originar el c—ctel de mAbs c1H3, c2G4 y c4G7 denominado cZMAb. Estos anticuerpos, producidos en la planta Nicotiana benthamiana, dieron lugar a la mezcla denominada ZMapp, que ataca a prote’nas de la superficie del virus (Figura 5).
ZMapp se desarrolla por la empresa Mapp Biopharmaceuticals y parece ser la mezcla de anticuerpos m‡s eficaz hasta el momento, ya que es capaz de rescatar al 100% de los macacos cuando el tratamiento se inicia 5 d’as despuŽs de la infecci—n (11). Sin embargo, su proceso de producci—n es muy lento, ya que depende del crecimiento y aislamiento de una planta, por lo que se han obtenido y utilizado hasta ahora cantidades tan peque–as que no se sabe si las personas que han sobrevivido al tratamiento lo han hecho gracias a ZMapp o a sus propias defensas.
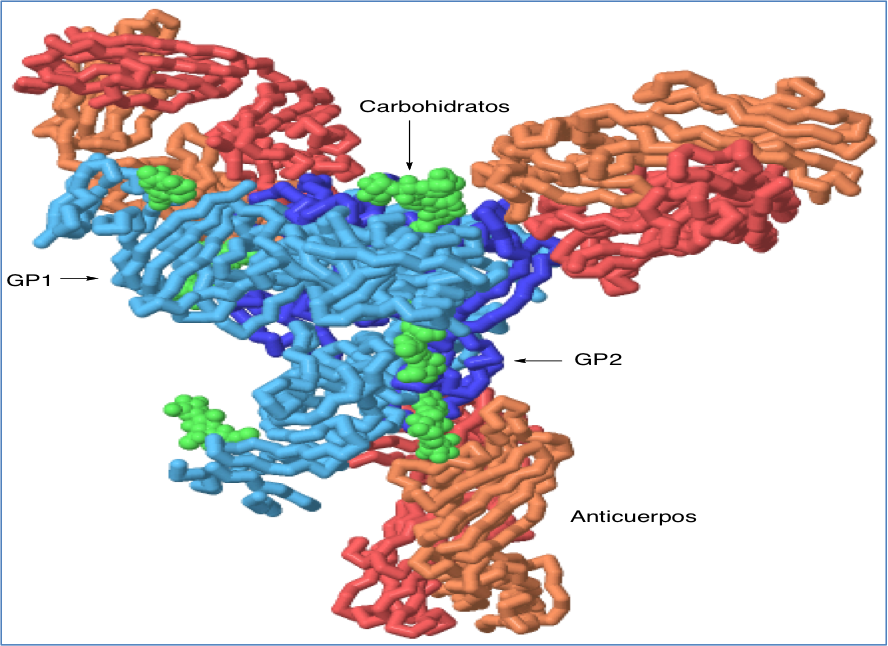
Figura 5.- Estructura del complejo que forma la glicoprote’na del virus ƒbola con anticuerpos humanos, aislado de un superviviente de la enfermedad. La estructura se ha generado a partir de pdb 3CSY y se ha representado con Jmol. Se observan dos cadenas en la glicoprote’na, GP1 que participa en la uni—n a receptor y GP2 que se encarga de la fusi—n a la cŽlula infectada. La estructura incluye algunas molŽculas de carbohidratos, que en condiciones fisiol—gicas recubren completamente la prote’na.
5. PROTEêNA C ACTIVADA, PROTEêNA C2 RECOMBINANTE DE NEMATODOS, E INTERFERONES
Adem‡s de las vacunas y de los c—cteles de mAbs, diversas aproximaciones estudiadas en primates en la œltima dŽcada han demostrado ser de interŽs como posibles tratamientos del ƒbola, aunque es su mayor’a s—lo producen efectos beneficiosos si se administran antes del segundo d’a post-infecci—n. Estas aproximaciones incluyen la administraci—n de la prote’na C activada recombinante humana (rhAPC) o de la prote’na c2 recombinante de nematodos (rNAPc2), y la administraci—n de interferones.
La prote’na C activada recombinante humana (rhAPC, Xigris¨), fabricada por la empresa Eli Lilly, estaba autorizada cuando exist’a grave riesgo de muerte por sepsis severas (12). En estas circunstancias, hay una r‡pida disminuci—n de los niveles de prote’na C activada, al igual que ocurre en la fiebre hemorr‡gica causada por filovirus. Por esta raz—n, se suministr— a macacos una infusi—n intravenosa de rhAPC a los 30-60 minutos del contagio y se continu— el tratamiento durante 7 d’as, demostr‡ndose que la fiebre hemorr‡gica de origen v’rico y las sepsis severas pueden beneficiarse de tratamientos comunes (13).
Por su parte, el estudio de la prote’na c2 recombinante de nematodos (rNAPc2) pretend’a averiguar si esta enzima, que es una proteasa de serina inhibidora del factor VII iniciador de la coagulaci—n de la sangre, es capaz de evitar la coagulaci—n intravascular diseminada que produce el virus. Su administraci—n a macacos infectados tras 10 minutos o tras 24 horas de la infecci—n prolong— el tiempo de supervivencia, lo que se interpret— como un punto de partida de los tratamientos dirigidos al contrarrestar los efectos de la enfermedad en vez de los dirigidos a inhibir la replicaci—n v’rica (14).
En cuanto al uso de interferones, hemos de recordar que los interferones a y b son citocinas que al interaccionar con su receptor (interferon-α/β receptor, IFNAR) activan la v’a de se–alizaci—n JAK/STAT y producen una respuesta inmunol—gica especialmente dirigida contra los virus (Figura 6) (15).
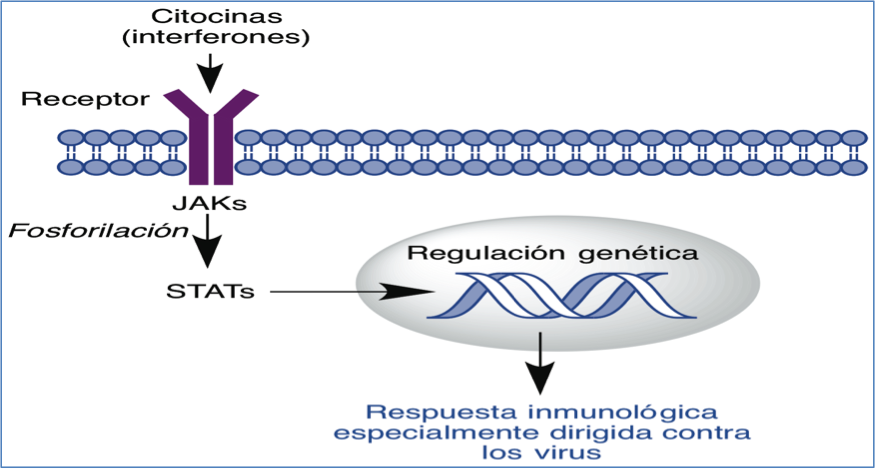
Figura 6.- Respuesta inmune inducida por la uni—n de los interferones a/b a su receptor transmitida por la v’a de se–alizaci—n JAK/STAT.
En la fiebre hemorr‡gica producida por filovirus se observan concentraciones de interfer—n b en plasma que son 60-100 veces superiores a las que existen en otras infecciones v’ricas, junto a una baja producci—n del mismo. Estos datos sugieren que la terapia con interfer—n podr’a utilizarse en el tratamiento de las infecciones causadas por estos virus y, en efecto, la administraci—n de interfer—n b a macacos recientemente infectados prolong— su supervivencia (16). Por otra parte, la combinaci—n de Zmab con interfer—n a (Ad-IFN) utilizando adenovirus como vectores del mismo, ha demostrado ser eficaz en primates si el tratamiento se inicia pasados 3 d’as desde la infecci—n. Este aumento en la ventana terapŽutica permitir’a su uso en el momento en que la viremia y sus s’ntomas son detectables (17).
6. RNAs de INTERFERENCIA y OLIGONUCLEîTIDOS ANTISENTIDO
Hay otros enfoques terapŽuticos que est‡n basados en la administraci—n de RNAs de interferencia (siRNA) y oligonucle—tidos antisentido (ASOs) de tipo PMOplus (positively-charged phosphorodiamidate morpholino oligomers).
El uso de RNAs de interferencia (siRNA) contra la RNA polimerasa (L) viral se ensay— primero en cobayas, a los que se administr— una formulaci—n estable de aquŽllos inmediatamente despuŽs de la infecci—n. Los resultados favorables indujeron a un posterior estudio en primates utilizando una combinaci—n de siRNAs formulados de la misma manera que ten’an como diana a las prote’nas v’ricas polimerasa (L), VP24 y VP35. Un grupo de macacos, a los que se administr— esta mezcla a los 30 minutos de la infecci—n y en los 6 d’as siguientes, experiment— una protecci—n del 66%. Estos datos se interpretaron como una demostraci—n del potencial de los RNA de interferencia (18).
Por su parte, los oligonucle—tidos antisentido tienen aqu’ como diana determinadas secuencias de RNA, copia del RNA viral, que son capaces de traducirse en prote’nas. Por consiguiente, la inhibici—n de esta secuencias produce el bloqueo de este proceso (Figura 7).
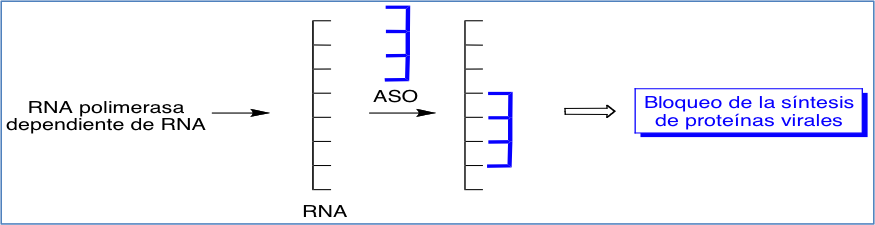
Figura 7. Bloqueo de la s’ntesis de prote’nas virales producido por la acci—n de los nucle—tidos antisentido (ASOs).
Dentro de esta aproximaci—n hay que mencionar dos combinaciones de olig—meros de morfolino f—sforodiamidato para al tratamiento de los virus ƒbola y Marburg, respectivamente. Tras un estudio previo en primates, estas combinaciones han sido objeto de ensayos cl’nicos de fase I. AVI-6002 est‡ dirigida a evitar la expresi—n de las prote’nas de la matriz VP24 y VP35, mientras que AVI-6003 est‡ dirigida a evitar la expresi—n de las prote’nas VP24 y NP) (19). En ambos caso se ha utilizado la metodolog’a qu’mica denominada PMOplus,¨ desarrollada por la firma Sarepta Therapeutics. Los componentes de AVI-6002 son AVI-7537 y AVI-7539, cada uno de los cuales es un olig—mero de morfolino f—sforodiamidato en el que ciertos agrupamientos de tipo dimetilamina se han sustituido por anillos de piperazina (ver la Figura 8). Recordemos que los oligonucle—tidos con potencial terapŽutico, adem‡s de tener una afinidad selectiva con la secuencia de RNA a la que se dirigen, tienen que evitar su degradaci—n por las enzimas denominadas nucleasas. AVI-7537 y AVI-7539, debido a la presencia de residuos de piperazina, contienen cargas positivas que favorecen su interacci—n con el RNA v’rico, que est‡ negativamente cargado.

Figura 8.- Estructura general de algunos oligonucle—tidos. Morfolino f—sforodiamidatos componentes de AVI-7537 y AVI-7539.
7. ANTIMETABOLITOS INHIBIDORES DE RNA POLIMERASA RNA-DEPENDIENTE
El uso de antimetabolitos que inhiban la RNA polimerasa RNA-dependiente, o causen mutagŽnesis letales cuando se incorporen al RNA viral, es otro enfoque terapŽutico de interŽs aunque, dada la facilidad de estos virus para sufrir mutaciones, estos f‡rmacos podr’an desarrollar resistencias y quiz‡s requerir’an su uso en combinaci—n. Se conocen varios prof‡rmacos de estos antimetabolitos, como BCX4430, favipiravir y brincidofovir, que inhiben la polimerase de RNA dependiente de RNA de filovirus (Figura 9). El compuesto BCX4430 es un azanucle—sido an‡logo de forodesina, un f‡rmaco huŽrfano indicado para el tratamiento de varios tipos de leucemia, que se desarroll— primero como posible tratamiento de la hepatitis C y luego en infecciones por filovirus con la colaboraci—n del NIAID. En estos estudios, BCX4430 demostr— su actividad in vitro como terminador de cadena. Ensayos con roedores y macacos han demostrado que protege frente a virus ƒbola y Marburg cuando se administra antes del tercer d’a tras la infecci—n (20).

Figura 9.- Algunos prof‡rmacos de antimetabolitos que inhiben la polimerase de RNA dependiente de RNA de filovirus.
Favipiravir, tambiŽn conocido como T-705, se descubri— en los laboratorios de investigaci—n de la empresa Toyama Chemical Co., Ltd. Bas‡ndose en su actividad para inhibir la replicaci—n del virus influenza en ratones, demostrada en estudios realizados en colaboraci—n con el Profesor Kimiyasu Shiraki de la Universidad de Toyama, se seleccion— para ser estudiado cl’nicamente. TambiŽn fue activo frente a diferentes tipos de virus ARN, entre otros el virus de la fiebre amarilla y el virus del Nilo Occidental. Su interŽs aument— debido a que su novedoso mecanismo de acci—n (21) le permiti— proteger a ratones de una infecci—n letal de virus H5N1 altamente pat—genos resistentes al inhibidor de neuraminidasa oseltamivir (22). Fabricado por el grupo Fuji Film, favipiravir se utiliza en Jap—n como antigripal con el nombre comercial Avigan,¨ y se encuentra en ensayos cl’nicos avanzados para ser aprobado para este indicaci—n en EEUU (23). Las enzimas de la cŽlula huŽsped lo bioactivan transform‡ndolo en el ribofuranosil-5′-trifosfato correspondiente (T-705-RTP), que actœa probablemente como un falso nucle—tido incorpor‡ndose al RNA viral e inhibiendo su RNA polimerasa dependiente de RNA (Figura 10). Se ha comprobado que antes de transformarse en el trifosfato, la enzima humana hipoxanthina guanina fosforibosiltransferasa (HGPRT) lo convierte en su ribosa-5′-monofosfato (T-705-RMP) (24).
Recientemente se ha empleado favipiravir experimentalmente para tratar la infecci—n por el virus ƒbola en humanos, bas‡ndose en estudios previos en los que mostr— esta actividad in vitro e in vivo (25) (en los estudios in vivo se utilizaron ratones carentes del receptor de interfer—n tipo I, IFNAR-/-). Aunque se sabe que favipiravir no produce toxicidad aparente en las cŽlulas de mam’fero, ni inhibe en ellas la s’ntesis de DNA o RNA, se desconoce su seguridad y eficacia en las dosis empleadas contra el virus ƒbola. Segœn fuentes mŽdicas, en Espa–a se ha utilizado favipiravir en el tratamiento de Teresa Romero a dosis mucho mayores que las que se emplean para su uso como antigripal.

Figura 10.- Bioactivaci—n de favipiravir y mecanismo de acci—n.
El liberiano diagnosticado en Dallas (Tejas) como enfermo de ƒbola, se trat— con brincidofovir (CMX001), un conjugado de cidofovir que se convierte intracelularmente en el antiviral activo cidofovir difosfato (cidofovir-DP). Gracias a su cadena lip’dica, brincidofovir es un prof‡rmaco que puede administrase por v’a oral, siendo m‡s potente que cidofovir porque se encuentra a mayores concentraciones intracelulares y carece de la toxicidad renal de cidofovir. Este es un an‡logo de 2Õdesoxicitidina monofosfato originalmente desarrollado para el tratamiento de infecciones por virus DNA, que cuando penetra en el interior celular se disfosforila a cidofovir-DP y este, debido a su semejanza con citidina-TP, actœa como falso sustrato de polimerasas DNA inhibiendo finalmente la replicaci—n (Figura 11) (26).

Figura 11.- Mecanismo de acci—n de brincidofovir.
Brincidofovir inhibe poxvirus, herpesvirus, y adenovirus, habiŽndose estudiado en ensayos cl’nicos de fases II y III. Por su actividad frente a los poxvirus, se almacena en EEUU como defensa frente a un posible ataque bioterrorista con virus de la viruela. Cuando surgi— la epidemia de ƒbola en 2014, la firma Chimerix que lo fabrica lo puso (junto con otros de sus compuestos) a disposici—n de las autoridades sanitarias para averiguar si pod’a eliminar este virus, aunque no fuera un virus DNA. Inesperadamente, brincidofovir fue un potente inhibidor de ƒbola in vitro, por lo que la FDA autoriz— su uso con el paciente de Dallas que finalmente falleci—.
8. ANTIVIRALES ENCONTRADOS POR CRIBADO AL AZAR
El cribado de molŽculas peque–as para observar en ellas una posible actividad antiviral ha permitido identificar varios inhibidores de filovirus. Por ejemplo, en un cribado in vitro de distintos f‡rmacos conocidos, se encontr— esta actividad en los moduladores del receptor estrogŽnico clomifeno y toremifeno (Figura 12).

Figura 12.- Inhibidores de filovirus hallados por mŽtodos de cribado al azar.
Utilizando ratones modificados convenientemente modificados para poder ser utilizados como modelos de infecci—n, estos f‡rmacos fueron tambiŽn activos in vivo, demostr‡ndose que esta acci—n es independiente de los receptores de estr—genos y se debe a que interfieren el proceso de entrada del virus al interior celular anteriormente mencionado (27). El compuesto NSC 62914, que posee actividad in vitro e in vivo frente a los virus ƒbola y Marburg entre otros, se encontr— en el cribado de otras estructuras. Este compuesto es un antioxidante que atrapa especies reactivas de ox’geno, modulando as’ el estrŽs oxidativo. Sin embargo, dado que cuando se estudiaron otros compuestos antioxidantes no se observ— ningœn efecto antiviral, se cree que su acci—n antiviral debe implicar la modulaci—n de mœltiples dianas o v’as de se–alizaci—n (28).
9. PROYECTOS FUTUROS
ÒMŽdicos Sin FronterasÓ ha anunciado que pretende realizar a partir de febrero de 2015 tres proyectos de investigaci—n en sus centros africanos. Uno en Conakry, Guinea, liderado por el Antwerp Institute of Tropical Medicine (ITM) estudiar‡ la administraci—n de sangre y plasma de pacientes de ƒbola que han sobrevivido y que, por tanto, contienen anticuerpos espec’ficos. Otro estudiar‡, en un lugar todav’a sin determinar, la administraci—n dos veces por semana durante dos semanas de formulaciones orales de brincidofovir a 140 pacientes, y estar‡ financiado por el Wellcome Trust y liderado por la Universidad de Oxford. El tercero, liderado por el French National Institute of Health and Medical Research (Inserm), se llevar‡ a cabo en Gueckedou, Guinea, y estudiar‡ el uso de favipiravir. En cuanto a las vacunas, aunque normalmente se requerir’a m‡s tiempo para su aprobaci—n, se pretende que a principios del a–o 2015 lleguen a çfrica y se utilicen unas 20.000 dosis de las vacuna producidas por GlaxoSmithKline (GSK) y la Agencia de Salud Pœblica de Canad‡.
10. CONCLUSIONES
Aunque no hay todav’a disponible para su uso humano ninguna vacuna o tratamiento para la fiebre hemorr‡gica causada por el virus ƒbola, los conocimientos b‡sicos y los hallazgos experimentales que ya existen permiten ser optimistas acerca de una aplicaci—n cl’nica no muy lejana. Sin embargo, parece claro que no ser‡ posible este cambio de situaci—n sin una importante aportaci—n de fondos pœblicos a la financiaci—n de este proceso.
10. CONCLUSIONS
Although neither a vaccine nor an effective antiviral treatment is currently available for use in humans, the fundamental knowledge and experimental findings already achieved, generate cautious optimism about the translation of these findings into clinical practice for prevention and treatment of Ebola hemorrhagic fever. However, it seems quite obvious that an effective progress will require public financial support.
11. Agradecimientos
La autora desea expresar su agradecimiento al Dr. J. C. MenŽndez por la elaboraci—n de algunas de las figuras.
12. referencias
1. Gatherer, D. The 2014 Ebola virus disease outbreak in West Africa. J. Gen. Virol. 95, 1619-1624 (2014).
2. Feldmann, H.; Geisbert, T. W. Ebola haemorrhagic fever. Lancet, 377, 849-862 (2011).
3. Ver, por ejemplo: (a) Bray, M.; Davis, K.; Geisbert, T.; Schmaljohn, C.; Huggins; J. A mouse model for evaluation of prophylaxis and therapy of Ebola hemorrhagic fever. J. Infect. Dis. 179, S248-58,(1999) (b) Bausch, D. G.; Sprecher, A. G.; Jeffs, B.; Boumandouki, P. Treatment of Marburg and Ebola hemorrhagic fevers: a strategy for testing new drugs and vaccines under outbreak conditions. Antiviral Res. 78, 150-161 (2008).
4. Gregory, S. M.; Harada, E.; Liang, B.; Delos, S. E.; White, J. M.; Tamm, L. K. Structure and function of the complete internal fusion loop from Ebolavirus glycoprotein 2. Proc. Natl. Acad. Sci. U S A. 108, 11211-11216 (2011).
5. Gregory, S. M.; Larsson, P.; Nelson, E. A.; Kasson, P. M.; White, J. M.; Tamm, L. K. Ebolavirus entry requires a compact hydrophobic fist at the tip of the fusion loop. J. Virol. 88, 6636-6649 (2014).
6. (a) Carette, J. E.; Raaben, M.; Wong, A. C.; Herbert, A. S.; Obernosterer, G.; Mulherkar, N.; Kuehne, A. I.; Kranzusch, P. J.; Griffin, A. M.; Ruthel, G.; Dal Cin, P.; Dye, J. M.; Whelan, S. P.; Chandran, K.; Brummelkamp, T. R. Ebola virus entry requires the cholesterol transporter Niemann–Pick C1. Nature 477, 340-343 (2011). (b) C™tŽ, M.; Misasi, J.; Ren, T.; Bruchez, A.; Lee, K.; Filone, C. M.; Hensley, L.; Li, Q.; Ory, D.; Chandran, K.; Cunningham, J. Small molecule inhibitors reveal Niemann-Pick C1 is essential for Ebola virus infection. Nature, 477, 344-348 (2011). (c) White, J. M.; Schornberg, K. L. A new player in the puzzle of filovirus entry. Nat. Rev. Microbiol. 10, 317-322 (2012).
7. Chang, T.-Y.; Reid, P. C.; Sugii, S.; Ohgami, N.;Cruz, J. C.;. Chang, C. C. Y. Niemann-Pick Type C Disease and Intracellular Cholesterol Trafficking. J. Biol. Chem. 280, 20917-20920 (2005).
8. Dhillon, R. S.; Srikrishna, D.; Sachs, J. Controlling Ebola: next steps Lancet 384, 1409-1411 (2014).
9. Kanapathipillai, R.; Restrepo, A. N. H.; Fast, P.; Wood, D.; Dye, Ch.; Kieny, M.-P.; Moorthy, V. Ebola Vaccine-An Urgent International Priority. N. Eng. J. Med. DOI: 10.1056/NEJMp1412166 (2014).
10. Olinger, G. G.; Pettitt, J.; Kim, D.; Working, C.; Bohorov, O.; Bratcher, B.; Hiatt, E.; Hume, S. D.; Jhonson, A. K.; Morton, J.; Pauly, M.; Whaley, K. J.; Lear, C. M.; Biggins, J. E.; Scully, C.; Hensley, L.; Zeitlin, L. Delayed treatment of Ebola virus infection with plant-derived monoclonal antibodies provides protection in rhesus machaques. Proc. Natl. Acad. Sci. U S A. 109, 18030-18035 (2012).
11. Qiu, X.; Wong, G.; Audet, J.; Bello, A.; Fernando, L.; Alimonti, J. B.; Fausther-Bovendo, H.; Wei, H.; Aviles, J.; Hiatt, E.; Jhonson, A.; Morton, J.; Swope, K.; Bohorov, O.; Bohorova, N.; Goodman, C.; Kim, D.; Pauly, M. H.; Velasco, J.; Pettitt, J.; Olinger, G. G.; Whaley, K.; Xu, B.; Strong, J. E.; Zeitlin, L.; Kobinger, G. P. Reversion of advanced Ebola virus disease in nonhuman primates with ZMapp. Nature 514, 47-53 (2014).
12. La empresa retir— este producto del mercado en octubre de 2011.
13. Hensley, L. E.; Stevens, E. L.; Yan, S. B.; Geisbert, J. B.;. Macias, W. L.; Larsen, T.; Daddario-DiCaprio, K. M.; Cassell, G. H.; Jahrling, P. B.; Geisbert, T. W. Recombinant human activated protein C for the postexposure treatment of Ebola hemorrhagic fever. J. Infect. Dis. 196, S390-S399 (2007).
14. Geisbert, T. W.; Hensley, L. E.; Jahrling, P. B.; Larsen, T.; Geisbert, J. B.; Paragas, J.; Young, H. A.; Fredeking, T. M.; Rote, W. E.; Vlasuk, G. P. Treatment of Ebola virus infection with a recombinant inhibitor of factor VIIa/tissue factor: a study in rhesus monkeys. Lancet 362, 1953-1958 (2003).
15. UzŽ, G.; Schreiber, G.; Piehler, J.; Pellegrini, S. The receptor of the type I interferon family. Curr. Top. Microbiol. Immunol. 316, 71-95 (2007).
16. Smith, L. M.; Hensley, L. E.; Geisbert, T. W.; Johnson, J.; Stossel, A.; Honko, A.; Yen, J. Y.; Geisbert, J.; Paragas, J.; Fritz, E.; Olinger, G.; Young, H. A.; Rubins, K. H.; Karp, C. L. Interferon-beta therapy prolongs survival in rhesus macaque models of Ebola and Marburg hemorrhagic fever. J. Infect. Dis. 208, 310-318 (2013).
17. Qiu, X.; Wong, G.; Fernando, L.; Audet, J.; Bello, A.; Strong, J.; Alimonti, J. B.; Kobinger, J. P. MAbs and Ad-vectored IFN-alpha therapy rescue Ebola-infected nonhuman primates when administered after the detection of viremia and symptoms, Sci. Transl. Med. 5, 207 ra143 (2013).
18. Geisbert, T. W.; Lee, A. C.; Robbins, M.; Geisbert, J. B.; Honko, A. N.; Sood, V.; Johnson, J. C.; de Jong, S.; Tavakoli, I.; Judge, A.; Hensley, L. E.; Maclachlan, I. Postexposure protection of non-human primates against a lethal Ebola virus challenge with RNA interference: a proof-of-concept study. Lancet, 375, 1896-1905 (2010).
19. Heald, A. E.; Iversen, P. L.; Saoud, J. B.; Sazani, P.; Charleston, J. S.; Axtelle, T.; Wong, M.; Smith, W. B.; Vutikullird, A.; Kaye, E. Safety and Pharmacokinetic Profiles of Phosphorodiamidate Morpholino Oligomers with Activity against Ebola Virus and Marburg Virus: Results of Two Single-Ascending-Dose Studies. Antimicrob. Agents Chemother, 58, 6639-6647 (2014).
20. (a) Stock, I. Marburg and Ebola hemorrhagic fevers-pathogens, epidemiology and therapy. Med. Monatsschr. Pharm. 37, 324-330 (2014). (b) Warren, T. K.; Wells, J.; Panchal, R. G.; Stuthman, K. S.; Garza, N. L.; Van Tongeren, S. A.; Dong, L.; Retterer, C. J.; Eaton, B. P.; Pegoraro, G.; Honnold, S.; Bantia, S.; Kotian, P.; Chen, X.; Taubenheim, B. R.; Welch, L. S.; Minning, D. M.; Babu, Y. S.; Sheridan, W. P.; Bavari, S. Protection against filovirus diseases by a novel broad-spectrum nucleoside analogue BCX4430. Nature 508, 402-405, (2014).
21. Baranovich, T.; , S.-S.; Armstrong, J.; Marjuki, H.; , R. J.; Webster, R. G.; Govorkova, E. A. T-705 (Favipiravir) Induces Lethal Mutagenesis in Influenza A H1N1 Viruses in Vitro. J. Virol. 87, 3741-3751 (2013).
22. Kiso, M.; Takahashi, K.; Sakai-Tagawa, Y.; Shinya, K.; Sakabe, S.; Le, Q. M.; Ozawa, M.; Furuta, Y.; Kawaoka, Y. T-705 (favipiravir) activity against lethal H5N1 influenza A viruses. Proc. Natl. Acad. Sci. U S A 107, 882-887 (2010).
23. (a) Furuta, Y.; Takahashi, K.; Fukuda, Y.; Kuno, M.; Kamiyama, T.; Kozaki, K.; Nomura, N.; Egawa, H.; Minami, S.; Watanabe, Y.; Narita, H.; Shiraki, K. In vitro and in vivo activities of anti-influenza virus compound T-705. Antimicrob. Agents Chemother. 46, 977-981 (2002). (b) Para una revisi—n ver: Furuta, Y.; Gowen, B. B.; Takahashi, K.; Shiraki, K.; Smee, D. F.; Barnard, D. L. Favipiravir (T-705), a novel viral RNA polymerase inhibitor. Antiviral Res. 100, 446-454 (2013).
24. Naesens, L.; Guddat, L. W.; Keough, D. T.; van Kuilenburg, A. B.; Meijer, J.; Vande Voorde, J.; Balzarini, J. Role of human hypoxanthine guanine phosphoribosyltransferase in activation of the antiviral agent T-705 (favipiravir). Mol. Pharmacol. 84, 615-629 (2013).
25. (a) Smither, S. J.; Eastaugh, L. S.; Steward, J. A.; Nelson, M.; Lenk, R. P.; Lever, M. S. Post-exposure efficacy of oral T-705 (favipiravir) against inhalational Ebola virus infection in a mouse model. Antiviral Res. 104, 153-155 (2014). (b) Oestereich, L.; LŸdtke, A.; Wurr, S.; Rieger, T.; Mu–oz-Fontela, C.; GŸnther, S. Successful treatment of advanced Ebola virus infection with T-705 (favipiravir) in a small animal model. Antiviral Res. 105, 17-21 (2014).
26. Florescu, D. F.; Keck, M. A. Development of CMX001 (Brincidofovir) for the treatment of serious diseases or conditions caused by dsDNA virases. Expert Rev. Anti Infect. Ther. 12, 1171-1178 (2014).
27. Johansen, L- M.; Brannan, J. M.; Delos, S. E.; Shoemaker, C. J.; Stossel, A.; Lear, .; Hoffstrom, B. G.; Dewald, L. E.; Schornberg, K. L.; Scully, C.; Lehar, J.; Hensley, L. E.; White, J. M.; Olinger, G. G. FDA-approved selective estrogen receptor modulators inhibit Ebola virus infection. Sci. Transl. Med. 5, 190ra79 (2013).
28. Panchal, R. G.; Reid, S. P.; Tran, J. P.; Bergeron, A. A.; Wells, J.; Kota, K. P.; Aman, J.; Bavari, S. Identification of an antioxidant small-molecule with broad-spectrum antiviral activity. Antiviral Res. 93, 23-29 (2012).