ARTÍCULO |
Un postre lácteo con un perfil lipídico modificado modula los niveles posprandiales de ApoB y puede promover la sensibilidad a la insulina en adultos sanos
Almudena Aguado-Barrios1†, Santiago Navas-Carretero1,2†, M. Ángeles Zulet1,2, J. Alfredo Martínez1,2*
1Departamento de Ciencias de la Alimentación y Fisiología. Universidad de Navarra. c/ Irunlarrea, 1. 31008, Pamplona, EspaĖa. 2CIBERobn, Fisiopatología de la Obesidad y Nutrición. Instituto de Salud Carlos III, Madrid, EspaĖa. †Ambos autores contribuyen igualmente.
*e-mail: jalfmtz@unav.es
Recibido el 9 de abril de 2014 An. Real Acad. Farm. Vol. 80, Nľ 3 (2014), pag.624-636
resumen
El objetivo del trabajo fue estudiar en adultos sanos los efectos de una cuajada con perfil lipídico modificado sobre marcadores de riesgo cardiovascular. El estudio consistió en una intervención nutricional posprandial, doble ciego, aleatorizada, en 20 adultos sanos. En cada visita los participantes consumían la cuajada asignada y se obtuvieron muestras de sangre basales y durante 6 horas, para analizar variables relacionadas con riesgo cardiovascular. Los niveles posprandiales de Apolipoproteína-B fueron significativamente inferiores (p=0.008), mientras que los valores de colesterol total y LDL-colesterol también se redujeron modestamente (ns), observándose una tendencia (p<0.10) a mejorar la sensibilidad a la insulina tras consumir la cuajada experimental frente al control. Estos resultados permiten atribuir un posible efecto beneficioso sobre la salud, asociado al consumo de un postre con perfil lipídico modificado. |
Palabras clave: Cuajada; intervención posprandial; enfermedad cardiovascular.
abstract
A dairy dessert with a modified lipid profile modulates postprandial apob levels and may influence insulin sensitivity in healthy adults
The aim of the present work was to study the effects of a curd with modified lipid profile on postprandial cardiovascular disease markers in healthy subjects. The study was a randomised postprandial, crossover, double-blind nutritional intervention, with 20 healthy adults. In each visit participants consumed the assigned curd and blood samples were obtained at baseline and during 6h, to analyse cardiovascular risk-related variables. ApoB postprandial levels were significantly lower (p = 0.008) while total cholesterol and LDL-cholesterol values were only slightly reduced(ns) and a tendency (p<0.10) to improve insulin sensitivity was also observed after consuming the experimental vs the reference curd. A possible beneficial effect on health can be attributed to the consumption of this dessert with modified lipid profile. |
Keywords: Curd; postprandial intervention; cardiovascular disease.
1. INTRODUCcióN
Las enfermedades cardiovasculares (ECV) son la primera causa de morbimortalidad en los países desarrollados. El riesgo de desarrollar aterosclerosis y ECV depende de numerosos factores como el estado inflamatorio del sujeto, hiperlipemia en ayunas y posprandial, disfunción endotelial, hipertensión, hiperglicemia, resistencia insulínica, obesidad y estado protrombótico. Muchos de estos factores están interrelacionados con el Síndrome Metabólico (1).
La situación posprandial constituye el estado metabólico habitual en el que se encuentra el ser humano a lo largo del día, que consiste fundamentalmente en el desarrollo de procesos metabólicos tras la ingesta de alimentos (2,3). La lipemia posprandial representa el acúmulo en plasma de lipoproteínas ricas en triglicéridos (TG), tales como quilomicrones (QM), lipoproteínas de muy baja densidad (VLDL) y sus remanentes (4,5), cuya hidrólisis resulta en la formación de ácidos grasos libres (AGL) y glicerol. La acumulación y el grado de saturación de los AGL son considerados uno de los factores de riesgo para el desarrollo de Síndrome Metabólico (6).
Hay evidencias de la relación entre la hipertrigliceridemiaposprandial, la resistencia insulínica y la enfermedad coronaria, siendo probable que los triglicéridos posprandiales sean un mejor predictor de enfermedad coronaria que los triglicéridos en ayunas (6). La hipertrigliceridemia posprandial está relacionada con la obesidad, el sexo, la edad, la diabetes y el estilo de vida (7). Por otro lado, la hipertrigliceridemiaposprandial produce una activación de neutrófilos y monocitos y un incremento en la concentración de moléculasproinflamatorias como interleuquina-6 (IL-6) y factor de necrosis tumoral alfa (TNF-α), que son citoquinas muy relacionadas con la génesis del Síndrome Metabólico y la resistencia a la insulina (8).
La variabilidad individual de la respuesta lipémicaposprandial excede a la que se produce en la lipemia del ayuno, debido a la influencia de factores ambientales y genéticos. Entre los primeros se incluye el grado de actividad física, el consumo de alcohol y tabaco, el estado hormonal de la mujer y el sexo, siendo el tipo de alimentación habitual de las personasuno de los factores más relevantes (9). En este contexto, la lipemia posprandial está influenciada por factores dietéticos, tanto por la cantidad de grasa ingerida (10), como por el tipo de grasa consumida o calidad de la grasa (6, 11). Las recomendaciones dietéticas para la prevención de ECV en los últimos aĖos (12)han ido dirigidas al reemplazo de los ácidos grasos saturados (AGS) por ácidos grasos monoinsaturados (AGM) y ácidos grasos poliinsaturados (AGP). En estudios metabólicos se ha evidenciado que el consumo de AGP y AGM resulta en un perfil lipídico más saludable que tras la ingesta de AGS (12, 13), pero existe también una relativa controversia dado que se han encontrado niveles aumentados(14) y disminuidos (11) de triglicéridos en estudios que comparaban los efectos del consumo de mantequilla (AGS) y ácido linoleico (AGP).
La dieta mediterránea, rica en AGM procedentes de aceite de oliva, ha sido asociada con un menor riesgo de ECV (16, 17). Múltiples ensayos basados en estudios de cohortes han observado que la elevada adherencia a esta dieta está asociada a una mejora en el estado de salud del individuo reduciendo la mortalidad y complicaciones asociadas a ECV y una menor prevalencia de enfermedades crónicas (14, 17). El consumo de AGM procedentes de la dieta favorece un perfil lipídico más saludable, mejora la sensibilidad a la insulina y regula los niveles de presión arterial y de glucosa sérica. Análisis recientes sugieren un posible papel de los AGM de la dieta en la regulación de la composición corporal reduciendo el riesgo de obesidad (18).
La situación posprandial es un período dinámico del metabolismo en el que, a partir de los substratos absorbidos de la dieta, ocurren fenómenos tanto de biosíntesis como de oxidación. Los estudios posprandiales tienen una serie de ventajas, siendo la situación fisiológica más habitual en el sujeto de las sociedades desarrolladas (1). Tras la ingesta, los niveles de glucosa y lípidos plasmáticos aumentan considerablemente hasta alcanzar estados hiperglicémicos e hipertrigliceridémicos, los cuales activan procesos inflamatorios y estrés oxidativo. En este sentido, es interesante el estudio del estado posprandial del individuo para analizar dichos procesos inflamatorios con el fin de prevenir el estrés oxidativo asociado al desarrollo de determinadas enfermedades crónicas. (7, 19-22).
El objetivo del presente estudio fue analizar el efecto del consumo de un producto lácteo con perfil lipídico modificado (cuajada de leche de oveja) frente a un producto lácteo de perfil lipídico comercial sobre el perfil lipídico y glucémico posprandial y marcadores inflamatorios de hombres y mujeres adultos sanos.
2. sujetos y métodos
2.1. Sujetos
El estudio enroló a 20 hombres y mujeres adultos sanos mediante la colocación de carteles informativos de reclutamiento en centros públicos de Pamplona previa autorización de dichos centros (polideportivos, centros culturales, etc). Los criterios de inclusión fueron: hombres y mujeres sanos de edades comprendidas entre 20 y 45 aĖos, con normopeso o sobrepeso grado I o II según la clasificación de la SEEDO, con un nivel de colesterol total plasmático < 240 mg/dL y sin enfermedades crónicas relacionadas con alteraciones del metabolismo o que requieran tratamiento farmacológico. Los criterios de exclusión fueron: sujetos con niveles de colesterol total plasmático fuera del rango de la normalidad, con obesidad grado I, II, III o IV; personas que, teniendo valores de colesterol total normales, presenten alguna otra alteración relacionada con un aumento de riesgo cardiovascular; sujetos con medicación concomitante con tratamientos adelgazantes o terapia hormonal sustitutiva, con alergias alimentarias conocidas y mujeres embarazadas, lactantes o menopáusicas.
2.2. Producto del estudio
El producto lácteo a estudio fue una cuajada de leche de oveja cuyos ingredientes principales eran leche de oveja pasteurizada y cuajo. La composición nutricional de ambas cuajadas fue facilitada por la empresa promotora, siendo la única diferencia entre la cuajada control y la experimental la composición de ácidos grasos (Tabla 1). El valor calórico total de ambas cuajadas fue 96 Kcal/100 gr de producto, del cual un 6.2% provenían de las grasas, un 4.5% de proteínas y un 5.5% de carbohidratos (de los cuales 2.8% en forma de azúcares).
2.3. DiseĖo del estudio
El estudio se planteó como una intervención posprandial, cruzada, doble ciega, con dos ramas:grupo experimental y grupo control. La duración del estudio posprandial fue de 6 horas desde el consumo del producto en estudio, durante las cuales se realizaron extracciones de sangre a los 30 minutos y cada hora después de haber consumido la cuajada hasta los 360 minutos, que se realizaba la última extracción. Los voluntarios acudieron a la Unidad Metabólica del Departamento de Ciencias de la Alimentación, Fisiología y Toxicología (CAFT) de la Universidad de Navarra en dos ocasiones con, al menos, dos semanas de diferencia y en ayunas de 10-12 horas tras haber consumido la noche anterior una cena protocolizada. En cada visita, los voluntarios llegaron a la Unidad Metabólica, y tras realizarles las correspondientes medidas antropométricas, se insertó una cánula y se realizó la primera extracción de muestra (basal o tiempo 0). A continuación se le proporcionó la cuajada de estudio asignada de manera aleatoria y se le pidió que la consumiera dentro de los 5 minutos siguientes. A los 30 minutos de su ingesta, se realizó una nueva extracción de sangre y así sucesivamente en los tiempos 60, 120, 180, 240, 300 y 360. Durante las 6 horas que duró el estudio posprandial, los voluntarios únicamente pudieron consumir agua.
Tabla 1.- Diferenciación del perfil de ácidos grasos entre las cuajadas.
CUAJADA CONTROL |
CUAJADA EXPERIMENTAL |
|
Ácido Butírico (C4:0) |
2,8 |
3,2 |
Ácido Caproico(C6:0) |
2,2 |
2,5 |
Ácido Caprílico (C8:0) |
2,1 |
2,3 |
Ácido Cáprico (C10:0) |
6,7 |
6,8 |
Ácido Laúrico (C12:0) |
3,7 |
3,7 |
Ácido Mirístico (C14:0) |
10,7 |
9,1 |
Ácido Miristoleico (n-5 C14:1) |
0,2 |
0,2 |
Ácido Pentadecanoico (C15:0) |
0,8 |
0,8 |
Ácido Palmítico (C16:0) |
31,7 |
23,1 |
Ácido Palmitoleico (n-7 C16:1) |
1,1 |
1,2 |
Ácido Heptadecanoico (C17:0) |
0,2 |
0,6 |
Ácido Esteárico (C18:0) |
9,6 |
11,5 |
Ácido Oleico (n-9 C18:1) |
23,1 |
28,7 |
Ácido Linoleico (n-6 C18:2) |
4,1 |
5,0 |
Ácido Linolénico (n-3 C18:3) |
0,6 |
0,7 |
Ácido Araquídico (C20:0) |
0,2 |
0,3 |
Ácido Gadoleico (n-9 C20:1) |
0,1 |
0,1 |
Ácido Behénico (C22:0) |
0,1 |
0,2 |
Ácidos Grasos Saturados |
70,8 |
64,1 |
Ácidos Grasos Monoinsaturados |
24,5 |
30,2 |
Ácidos Grasos Poliinsaturados |
4,7 |
5,7 |
El estudio cumple con las condiciones recomendadas en la Declaración de Helsinki para la investigación con sujetos. El protocolo del proyecto fue evaluado y aprobado por el Comité de Ética de la Investigación de la Universidad de Navarra (004/2012). Todos los voluntarios participantes en el estudio dieron su consentimiento informado por escrito antes de comenzar el ensayo.
2.4. Métodos analíticos
Las muestras de sangre recogidas tras canulización de una vía, fueron distribuidas en 2 tubos con EDTA de 4 mL (BectonDickinsonVacutainer, Madrid, EspaĖa) y 1 tubo con gel activador para la obtención de suero (BectonDickinsonVacutainer, Madrid, EspaĖa) y fueron inmediatamente almacenadas en refrigeración (4ľC). A continuación, los tubos fueron centrifugados a 3500 rpm durante 15 minutos en una centrífuga refrigerada a 4ľC (EppendorfCentrifuge 5804R, Hamburgo, Alemania) y plasma y suero fueron divididos en alícuotas de 500 Ķl (tubos eppendorf) y almacenados a -80ľC hasta su posterior análisis.
Las concentraciones séricas de colesterol total, c-HDL, triglicéridos, glucosa, homocisteína, ácido úrico y ácidos grasos libres fueron determinadas con unautoanalizador Pentra-C200 (HORIBA-ABX, Montpellier, Francia) mediante colorimetría y utilizando kits comerciales convencionales. Las concentraciones séricas de Apolipoproteína A (ApoA) y Apolipoproteína B (ApoB) fueron determinadas utilizando técnicas espectrofotométricas en el analizador Hitachi Modular Analytics 911 (Roche Diagnostics, Basle, Suiza) mediante reactivos comerciales. Las concentraciones de insulina, TNF-α y PCR ultrasensible fueron determinadas en plasma mediante un inmunoensayo ELISA (Enzyme Linked Immuno Sorbent Assay) en el autoanalizador Triturus (GRIFOLS, Barcelona, EspaĖa) utilizando kits de reactivos comerciales. La concentración de LDL-c se determinó mediante la fórmula de Friedewald (23) a partir de los valores de colesterol total, c-HDL y triglicéridos. Los valores del índice HOMA se obtuvieron a partir de la glucosa y la insulina aplicando la fórmula propuesta por Mathews y col en 1995 (24).
2.5. Análisis estadístico
En este estudio, cada sujeto consumió ambos productos, la cuajada experimental y la control.
Las variables analizadas se ajustaban a la normalidad, por lo que se presentan como media y desviación estándar. Los valores basales se han analizado mediante test de la t de Student para detectar diferencias significativas en las medidas antropométricas entre la visita de consumo de la cuajada experimental y la visita de consumo de la cuajada control antes de ingerir los productos. Los valores de PCR ultrasensible de 3 sujetos fueron excluidos del estudio debido a un aumento clínicamente relevante entre los días de visita, reflejo de algún probable proceso infeccioso y/o inflamatorio.
Las diferencias entre productos en las variables se han evaluado mediante un análisis de varianza de medidas repetidas, teniendo como factores o variables independientes el tipo de cuajada (A o B) y el tiempo (0, 30, 60, 120, 180, 240, 300, 360 minutos) así como la interacción entre el tipo de cuajada y el tiempo.
También se ha realizado un estudio de las áreas bajo la curva calculadas mediante el software Graph Pad Prism 5.0 para Windows (Graph Pad Software, Inc., EEUU) mediante análisis de la t de Student. El tratamiento estadístico de los datos se ha realizado con el paquete informático SPSS 15.0 para Windows (SPSS Inc., EEUU).
3. resultados
3.1. Características basales
Las características basales antropométricas y clínicas de los sujetos participantes en el estudio se muestran en la Tabla 2. Como era de esperar, no se obtuvieron cambios significativos en dichos parámetros entre ambas visitas que pudieran influir en los resultados.
Tabla 2.- Características basales de los participantes al consumir ambas cuajadas.
Variables |
Cuajada control |
Cuajada experimental |
Sujetos (n) |
20 |
20 |
IMC (Kg/m2) |
22,5 Ī 2,5 |
22,6 Ī 2,5 |
Colesterol total (mg/dL) |
190 Ī 32 |
187 Ī 31 |
c-HDL (mg/dL) |
66 Ī 11 |
66 Ī 12 |
c-LDL (mg(dL) |
107 Ī 27 |
101 Ī 30 |
Triglicéridos (mg/dL) |
85 Ī31 |
86 Ī 31 |
Apolipoproteína A (mg/dL) |
161 Ī 25 |
166 Ī 26 |
Apolipoproteína B (mg/dL) |
66 Ī 22 |
66 Ī 23 |
Glucosa (mg/dL) |
79,5 Ī 6,8 |
80,4 Ī 5,6 |
Insulina (ĶU/mL) |
5,5 Ī 2,9 |
4,8 Ī 2,6 |
HOMA-IR |
1,11 Ī 0,68 |
0,96 Ī 0,54 |
Ácidos grasos libres (mmol/L) |
0,7 Ī 0,4 |
0,7 Ī 0,2 |
Homocisteína (Ķmol/L) |
12,8 Ī 8,4 |
11,8 Ī 7,2 |
Ácido úrico (mg/dL) |
4,8 Ī 1,2 |
4,9 Ī 1,2 |
TNF-α (pg/mL) |
0,92 Ī 0,52 |
0,89 Ī 0,51 |
PCR (Ķg/mL) |
1,3 Ī 1,5 |
1,3 Ī 1,9 |
3.2. Lipemia posprandial
La ingesta de la cuajada experimental no presentó diferencias significativas con la cuajada control sobre la evolución posprandial del colesterol total, c-HDL, c-LDL, Triglicéridos y Apo A (Figura 1). En relación a la Apo B (Figura 1, p= 0,008), considerada la variable principal del estudio, la determinación de las concentraciones plasmáticas mostró diferencias significativas en cuanto al efecto de la interacción de cada tipo de cuajada con el tiempo. Para todas las variables medidas, sí existe un efecto del tiempo (p<0,05) sobre ellas, independientemente del tipo de cuajada consumida.
3.3. Metabolismo glucídico posprandial
La evolución posprandial de los biomarcadores del metabolismo glucídico estudiados: glucosa, insulina, índice de resistencia a la insulina HOMA-IR y ácidos grasos libres no permitió detectar diferencias significativas entre el efecto de la cuajada experimental y la cuajada control (Figura 2). Los niveles de insulina aumentaron a los 30 minutos de la ingesta de ambos tipos de cuajada (17,38Ī9,14 tras cuajada experimental, 18,97Ī10,66 tras cuajada control), hecho que no fue acompaĖado de un aumento en los niveles de glucosa. Las áreas bajo la curva de insulina y HOMA tras el consumo de la cuajada experimental mostraron una tendencia positiva, que parecen indicar que dicha cuajada podría aumentar marginalmente (p<0,10) la sensibilidad a la insulina en comparación con la cuajada control (Tabla 3), encontrando también un efecto significativo del tiempo sobre cada una de las variables dependientes estudiadas (p<0,05).
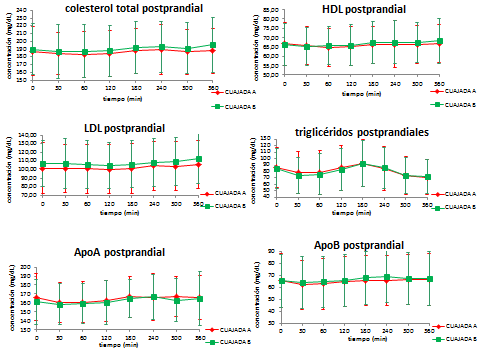
Figura 1.- Evolución posprandial (0-360 min) de los biomarcadores de metabolismo lipídico tras la ingesta de ambas cuajadas. * CUAJADA A = Cuajada Experimental; CUAJADA B = Cuajada Control. ī Tiempo*Cuajada = Diferencias significativas en la interacción tipo de cuajada y tiempo (p= 0,008).
3.4. Perfil inflamatorio posprandial
El consumo de la cuajada experimental y la cuajada control no produjo diferencias significativas sobre las variables estudiadas: ácido úrico, homocisteína, TNF-α y PCR (Tabla 3). Al igual que en casos anteriores, también se observó un efecto significativo del tiempo sobre el comportamiento posprandial de las variables estudiadas, independientemente del tipo de cuajada consumida (p<0,05).
4. DISCUSIÓN
El papel de la nutrición en la prevención de ECV ha sido ampliamente estudiado, existiendo evidencias de que los factores dietéticos pueden influir en la aterogénesis bien directamente o bien a través de marcadores clásicos de riesgo tales como el perfil lipídico, el metabolismo glucídico o el estado inflamatorio del individuo (1). Sin embargo, según nuestras investigaciones, esta es la primera vez que se ha estudiado los beneficios de una cuajada con perfil lipídico modificado funcionalmente.
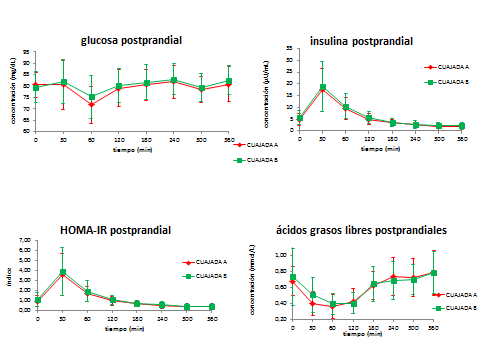
Figura 2.- Evolución posprandial (0-360 min) de los marcadores del metabolismo glucídico tras la ingesta de ambas cuajadas. * CUAJADA A = Cuajada Experimental; CUAJADA B = Cuajada Control.
Tabla 3.- Áreas bajo la curva de los marcadores de metabolismo glucídico posprandial.
Cuajada control (n= 20) |
Cuajada experimental (n= 20) |
p |
|
Glucosa (mg*dL-1*min) |
28957 Ī 2041 |
28462 Ī 2001 |
0,355 |
Insulina (mU*L-1*min) |
2034 Ī 850 |
1858 Ī 749 |
0,080 |
HOMA-IR (U*min) |
402 Ī 166 |
362 Ī 144 |
0,092 |
AGL (mmol*L-1*min) |
214 Ī 51 |
213 Ī 53 |
0,903 |
En este contexto, la cuajada es un postre lácteo ampliamente consumido en determinadas regiones de EspaĖa. Además, productos lácteos que han sufrido procesos de elaborado similares se consumen ampliamente en diversos países de Europa, América y el norte de África. Por ello, y debido a la falta de información científica sobre los efectos del consumo de productos cuajados de leche de oveja modificada, se planteó la realización de la presente investigación.
Este estudio con diseĖo cruzado cruzado y doble ciego, evaluó los efectos del consumo de una cuajada experimental que contiene menor cantidad de ácidos grasos saturados (AGS) y mayor cantidad de ácidos grasos monoinsaturados (AGM), frente a los efectos de una cuajada comercial (cuajada control) sobre marcadores sanguíneos posprandiales de metabolismo lipídico, glucídico y estado inflamatorio de individuos adultos sanos. A la hora de llevar a cabo esta intervención nutricional, tanto las medidas antropométricas de los voluntarios como la cena previa al estudio, fueron controladas, de forma que la única diferencia entre ambas visitas fue el tipo de cuajada consumida y por tanto, la cantidad de AGS y AGM ingerida.
Diversos ensayos clínicos han demostrado los efectos beneficiosos del consumo de AGM sobre la lipemia, glucemia y estado inflamatorio posprandial mostrando reducciones significativas en los niveles de TG, colesterol total y c-LDL (3-5, 25). También existen algunos estudios que muestran un incremento en los niveles de c-HDL tras el consumo de una dieta rica en AGM en comparación con una dieta rica en AGS (2, 11, 26). En este proyecto, los niveles séricos de ApoA y ApoB han sido medidos en el estado posprandial. Ambos biomarcadores lipídicos han sido propuestos como marcadores de riesgo de ECV (3, 25, 27). El consumo de la cuajada experimental produjo un importante descenso en los niveles posprandiales de ApoB en comparación con la cuajada control, con reducciones modestas y no significativas de colesterol total y c-LDL, encontrándose efectos similares entre cuajadas en el resto de marcadores posprandiales de metabolismo lipídico (c-HDL, TG o ApoA). Nuestros resultados están en consonancia con los obtenidos por estudios previos (2, 3, 26-28), aunque el descenso observado en nuestro caso es menos intenso, lo que podría explicarse debido a la menor cantidad de AGM ingerida, el hecho de que los sujetos fueran sanos o por la duración del estudio posprandial.
Los AGM han tomado un papel de gran relevancia gracias a su capacidad para regular la respuesta glucémica y mejorar la sensibilidad a la insulina (29). Sin embargo, en el caso de los AGS, comparativamente a su efecto nocivo sobre los lípidos circulantes, se ha demostrado que empeoran la respuesta glucémica y la sensibilidad a la insulina (30), especialmente en células del músculo esquelético(31).
Respecto al metabolismo glucídico posprandial, en nuestro ensayo no se han encontrado diferencias significativas en el efecto de ambos tipos de cuajada sobre los biomarcadores estudiados; dichos resultados coinciden con los obtenidos por estudios previos (23, 32-35). En nuestro caso, se ha observado una ligera tendencia en el Área bajo la curva de la insulina y el índice HOMA, lo cual sugiere una relativa mejora en la sensibilidad a la insulina tras la ingesta de la cuajada experimental. Este resultado coincide con estudios previos que, aunque no siendo mayoritarios, han demostrado una mejora de la sensibilidad a la insulina tras la ingesta de una dieta rica en AGM en comparación con dietas ricas en AGS (36, 37).
La asociación existente entre una respuesta lipémica posprandial elevada y un incremento en el riesgo de padecer ECV está ampliamente descrita, basada entre otros, en mecanismos de activación endotelial e inflamación (11). Las grasas ingeridas en la dieta pueden influir en la expresión diferencial de marcadores de inflamación en el estado posprandial del individuo (37, 38), pero no hay suficientes estudios evaluando los efectos de diferentes patrones dietéticos en marcadores de inflamación sistémica y disfunción endotelial, procesos ambos involucrados en el desarrollo de la aterosclerosis. En este estudio, el efecto del consumo de una cuajada experimental en la evolución posprandial de biomarcadores del estado inflamatorio y su posible relación con la lipemia posprandial, no produjo cambios significativos en los marcadores medidos. Estos resultados corroboran los datos obtenidos en otros estudios previos, que investigaron los efectos de diferentes grasas dietéticas en el estado inflamatorio posprandial de sujetos sanos (11, 28, 30, 37).
5. CONCLUSIONES
La cuajada experimental, que presenta mayor proporción de AGM y AGP y menor cantidad de AGS en su composición nutricional, presenta un posible efecto beneficioso en relación al metabolismo lipídico, como se observa en la reducción estadísticamente significativa de los niveles séricos posprandiales de Apolipoproteína-B tras su ingesta. El posible efecto de mejora de la sensibilidad a la insulina tras el consumo de la cuajada modificada y mejorada en ácidos grasos, sugiere la necesidad de profundizar en los mecanismos implicados para confirmar los efectos propuestos.
6. CONFLICTO DE INTERÉS
Los autores declaran no tener ningún conflicto de interés.
7. AGRADECIMIENTOS
Los autores agradecen al CDTI (Ministerio de Ciencia e Innovación) y SAT Ultzamakoa por la financiación de este proyecto y a SAT Ultzamakoa por proporcionar el producto de estudio.
Los autores también quieren agradecer a todos los voluntarios su participación en el estudio y a Verónica Ciaurriz, Blanca Martínez de Morentin, María Hernández y Salomé Pérez su ayuda técnica, así como el interés en el desarrollo del ensayo.
8. referencias
1. van Oostrom AJ, van Wijk J, Cabezas MC. Lipaemia, inflammation and atherosclerosis: novel opportunities in the understanding and treatment of atherosclerosis. Drugs 2004;64:19-41.
2. Cardona F, Tunez I, Tasset I, Murri M, Tinahones FJ. Similar increase in oxidative stress after fat overload in persons with baseline hypertriglyceridemia with or without the metabolic syndrome. Clin Biochem 2008;41:701-705.
3.Cohn JS. Postprandial lipemia and remnant lipoproteins. ClinLabMed 2006;26:773-786.
4. Anderson RA, Evans ML, Ellis GR, Graham J, Morris K, Jackson SK, et al. The relationships between post-prandial lipaemia, endothelial function and oxidative stress in healthy individuals and patients with type 2 diabetes. Atherosclerosis 2001;154:475-483.
5.Watts GF. Postprandial lipaemia in familial hypercholesterolaemia: clinical and metabolic significance. Atherosclerosis 2000;148:426-428.
6. van Oostrom AJ, Alipour A, Sijmonsma TP, Verseyden C, Dallinga-Thie GM, Plokker HW, et al. Comparison of differentmethods to investigate postprandial lipaemia. Neth J Med 2009;67:13-20.
7.Davignon J, Cohn JS. Triglycerides: a risk factor for coronary heart disease. Atherosclerosis 1996;124:S57-S64.
8.Burdge GC, Calder PC. Plasma cytokine response during the postprandial period: a potential causal process in vascular disease? Br J Nutr 2005;93:3-9.
9.Bergeron N, Havel RJ. Assessment of postprandial lipemia: nutritional influences. Curr Opin Lipidol 1997;8:43-52.
10. Castro Cabezas M, Halkes CJ, Meijssen S, van Oostrom AJ, Erkelens DW. Diurnal triglyceride profiles: a novel approach to study triglyceride changes. Atherosclerosis 2001;155:219-228.
11.Mekki N, Charbonnier M, Borel P, Leonardi J, Juhel C, Portugal H, et al. Butter differs from olive oil and sun flower oil in its effects on postprandial lipemia and triacylglycerol-richlipoproteins after single mixed meals in healthy youngmen. J Nutr 2002;132:3642-3649.
12.Vafeiadou K, Weech M, Sharma V, Yaqoob P, Todd S, Williams CM, et al. A review of the evidence for the effects of total dietaryfat, saturated, monounsaturated and n-6 polyunsaturated fatty acids on vascular function, endothelial progenitor cells and microparticles. Br J Nutr 2012;107:303-324.
13.Poppitt SD, Keogh GF, Lithander FE, Wang Y, Mulvey TB, Chan YK, et al. Postprandial response of adiponectin, interleukin-6, tumor necrosis factor-alpha, and C-reactive protein to a high-fatdietary load. Nutrition 2008;24:322-329.
14.Thomsen C, Rasmussen O, Christiansen C, Pedersen E, Vesterlund M, Storm H, et al. Comparison of the effects of a monounsaturated fat diet and a high carbohydrate diet on cardiovascular risk factors in first degree relatives to type-2 diabetic subjects. Eur J Clin Nutr 1999;53:818-823.
15.Grundy SM. Transmonounsaturated fatty acids and serum cholesterol levels. N Engl J Med 1990;323:480-481.
16.Kris-Etherton PM, Hecker KD, Binkoski AE. Polyunsaturated fatty acids and cardiovascular health. Nutr Rev 2004;62:414-426.
17. de Bruin TW, Brouwer CB, van Linde-SibeniusTrip M, Jansen H, Erkelens DW. Different postprandial metabolism of olive oil and soybeanoil: a possible mechanism of the high-density lipoprotein conserving effect of olive oil. Am J Clin Nutr 1993; 58:477-483.
18.Gillingham LG, Harris-Janz S, Jones PJ. Dietary monounsaturated fatty acids are protective against metabolic syndrome and cardiovascular disease risk factors. Lipids 2011;46:209-228.
19.Schwingshackl L, Strasser B, Hoffmann G. Effects of monounsaturated fatty acids on cardiovascular risk factors: a systematic review and meta-analysis. Ann Nutr Metab 2011;59:176-186.
20.Sofi F, Cesari F, Abbate R, Gensini GF, Casini A. Adherence to Mediterranean diet and health status: meta-analysis. BMJ 2008;337:a1344.
21.Buckland G, Gonzalez CA, Agudo A, Vilardell M, Berenguer A, Amiano P, et al. Adherence to the Mediterranean diet and risk of coronary heart disease in the Spanish EPIC Cohort Study. Am J Epidemiol 2009; 170:1518-1529.
22.Ceriello A, Falleti E, Motz E, Taboga C, Tonutti L, Ezsol Z, et al. Hyperglycemia-induced circulating ICAM-1 increase in diabetes mellitus: the possible role of oxidative stress. Horm Metab Res 1998;30:146-149.
23.Friedewald WT, Levy RI, Fredrikson DS. Estimation of the concentration of low-density lipoprotein cholesterol in plasma, without use of the preparative ultracentrifuge. Clin Chem 1972; 18:499-502.
24.Matthews DR, Hosker JP, Rudenski AS, Naylor BA, Treacher DF, Turner RC. Homeostasis model assessment: insulin resistance and beta-cell function from fasting plasma glucose and insulin concentrations in man. Diabetologia 1985;28:412-419.
25. Castro Cabezas M, Erkelens DW, Kock LA, De Bruin TW. Postprandial apolipoprotein B100 and B48 metabolism in familial combined hyperlipidaemia before and after reduction of fasting plasma triglycerides. Eur J Clin Invest 1994;24:669-678.
26. Gómez-Coronado Cáceres D. Salida celular y transporte reverso de colesterol. Clin Invest Arterioscl 2010;22:12-16.
27.Patsch W, Esterbauer H, Foger B, Patsch JR. Postprandial lipemia and coronary risk. Curr Atheroscler Rep 2000;2:232-242.
28.Bendtsen LQ, Lorenzen JK, Larsen TM, van Baak M, Papadaki A, Martinez JA, Handjieva-Darlenska T, Jebb SA, Kunešová M, Pfeiffer AF, Saris WH, Astrup A, Raben A.Associations between dairy protein in take and body weight and risk markers of diabetes and CVD during weight maintenance.Br J Nutr. 2014;111:944-953.
29. Hofman Z, van Drunen JD, de Later C, Kuipers H.The effect of different nutritional feeds on the postprandial glucose response in healthy volunteers and patients with type II diabetes. Eur J ClinNutr. 2004;58:1553-1556.
30. Vessby B, Karlstrom B, Ohrvall M, Jarvi A, Andersson A, Basu S. Diet, nutrition and diabetes mellitus. Ups J Med Sci 2000;105:151-160.
31.Bergouignan A, Momken I, Schoeller DA, Simon C, Blanc S. Metabolic fate of saturated and monounsaturated dietary fats: the Mediterranean diet revisited from epidemiological evidence to cellular mechanisms. Prog Lipid Res 2009;48:128-147.
32.Gallaher D SB. Fibra alimentaria. In: Ziegler EE, Filer LJ, (eds). Conocimientos actuales sobre nutrición. Ed. Washington; 1997. p. 95.
33. Sarmiento Mendez LM, Roca-CusachsColl A, Arroyo Diaz JA, Benet Gusta MT, Sole Villa MJ, Franco Peral M. Comparison of the definitions of the metabolic syndrome according to ATP III and IDF. Rev Clin Esp 2008;208:333-338.
34.Hauner H. Insulin resistance and the metabolic syndrome-a challenge of the new millennium. Eur J ClinNutr 2002;56:S25-29.
35.Weber MA, Schiffrin EL, White WB, Mann S, Lindholm LH, Kenerson JG, Flack JM, Carter BL, Materson BJ, Ram CV, Cohen DL, Cadet JC, Jean-Charles RR, Taler S, Kountz D, Townsend R, Chalmers J, Ramirez AJ, Bakris GL, Wang J, Schutte AE, Bisognano JD, Touyz RM, Sica D, Harrap SB.Clinical practice guide lines for the management of hypertension in the community a statement by the American Society of Hypertension and the International Society of Hypertension. J Hypertens. 2014; 32:3-15
36.De Caterina R, Liao JK, Libby P. Fatty acid modulation of endothelial activation. Am J Clin Nutr 2000; 71:213S-223S.
37.Perez-Jimenez F, Lopez-Miranda J, Pinillos MD, Gomez P, Paz-Rojas E, Montilla P, et al. A Mediterranean and a high-carbohydrate diet improve glucose metabolism in healthy young persons. Diabetologia 2001;44:2038-2043.
38.Tholstrup T, Sandstrom B, Bysted A, Holmer G. Effect of 6 dietary fatty acids on the postprandial lipidprofile, plasma fattyacids, lipoprotein lipase, and cholesterolester transfer activities in healthy young men. Am J Clin Nutr 2001 Feb;73(2):198-208.