REVISIÓN |
El concepto darwiniano de la allostasis. Epigénesis
Ana MĽ Pascual-Leone Pascual
Académica de Número de la Real Academia Nacional de Farmacia
e-mail: anamariapascualleone@gmail.com
Recibido el jueves 5 de octubre de 2014 An. Real Acad. Farm. Vol. 80, Nľ 3 (2014), pag. 466-499.
resumen
El concepto de allostasis fué establecido a finales del siglo pasado como el conjunto de respuestas de los organismos vivos, regidas por el cerebro, para conservar su equilibrio interno y, por tanto, su supervivencia. Pero todo ello tiene resonancias Darwinianas . Cuestiones establecidas en el siglo XX. El axis HPA – hipotálamo –pituitaria-adrenal- es el más importante entre todos los sistemas movilizados por la allostasis. Y este axis se programa en periodo gestacional en los mamíferos. Cuando circunstancias de estrés maternal activan su axis HPA, grandes cantidades de glucocorticoides (GC) pasan al feto, y su axis HPA se programa de forma anómala, e irreversible en periodo adulto, además, se reduce el peso al nacimiento. Y todo ello es factor de riesgo de posibles patologías adultas (diabetes 2, cardiovasculares o hipertensión crónica). La causa es la reducción de receptores de glucocorticoides (GR) en el hipocampo, ya que ellos ejercen una acción tónica en la retroalimentación negativa del axis HPA. Sin embargo, se desconocía, en el siglo XX, por qué mecanismo los GC reducen la expresión de GR en hipocampo. Cuestiones establecidas en siglo XXI. Se eligen y exponen una serie de trabajos publicados en el siglo XXI sobre esta vertiente que nos han llevado al conocimiento de que la reducción en hipocampo de los GR se produce por un mecanismo epigenético. Sucintamente, se enumeran los principales mecanismos epigenéticos conocidos.Finalmente, se enuncian las grandes posibilidades terapéuticas que abren estos mecanismos epigenéticos para el futuro y para la posible explicación de procesos evolutivos |
Palabras clave: Allostasis; periodo gestacional; axis HPA; epigénesis; Darwin.
abstract
The Darwinian concept of allostasis. Epigenetic programming
Keywords: Allostasis; gestational period; HPA axis; epigenetic programming; Darwin.
1. INTRODUCcióN
El concepto de allostasis, establecido a finales del siglo XX, recoge el conjunto de sistemas que se activan en los organismos vivos, regidos por el cerebro, para conservar el equilibrio interno y, por tanto, la supervivencia. Todo ello cuando factores externos al organismo, o internos a él, alteran su homeostasis provocando un estado de emergencia. Los factores internos que producen el desequilibrio pueden ser un aumento de pH, de temperatura, una infección, etc., y los externos pueden ser una alteración climática, falta de comida, o un depredador que nos ataca. Y todas las respuestas que los organismos habilitan, con fines de supervivencia, se han englobado hoy en el concepto de allostasis y se ha mostrado que están dirigidos y modulados a nivel cerebral (1). Los principales sistemas que el organismo activa son los siguientes:
Š El metabolismo o balance energético.
Š Se activa el axis HPA con salida masiva a plasma de glucocorticoides.
Š Aumenta el estrés oxidativo.
Š Se deprime el sistema inmune.
Š Se alteran procesos cognitivos o emocionales por la remodelación de estructuras hipocampales en colaboración con la amígdala.
Š Alteraciones del sueĖo.
Son movilizados a nivel cerebral. Pero, siendo todos muy importantes, el que ocupa un lugar central es la activación del axis hipotálamo ‑hipófisis- corteza suprarrenal (axis HPA en la bibliografía científica anglosajona), con la consiguiente salida a plasma de niveles altos de glucocorticoides. Cuestión ya denunciada por Selye en 1936 cuando habló del síndrome general de adaptación en un estado de emergencia o estrés, término, este último, también acuĖado por él (2).
Y todo este concepto de allostasis, recientemente establecido, tiene resonancias darwinianas y ha sido considerado así por diversos autores, algunos tan significativos como Mc Ewen (3).
Estamos queriendo destacar pues, que cuando Charles Darwin en el siglo XIX escribió con su gran inteligencia y dotes de observación, el Origen de las Especies, y estableció que la evolución se producía por una selección natural, no existía ningún conocimiento, en los seres vivos, ni a nivel fisiológico, ni a nivel molecular, para realizar y explicar dicha selección natural.
En el siglo XXI comenzamos a vislumbrar mecanismos, recientemente establecidos, con los cuales se podría realizar esa selección natural que tan creativamente concibió Darwin en el siglo XIX.
2. trabajos del siglo XX
Por trabajos realizados en el siglo XX, se estableció que el axis HPA se programa en periodo gestante en los mamíferos. Y que la malnutrición materna, el estrés de la madre, o ciertos desequilibrios hormonales de ella pueden ser la causa de una programación anómala del axis en periodo fetal y con consecuencias patológicas posteriores en periodo adulto (4,5).
Las principales cuestiones establecidas durante el siglo XX, fueron:
Š El axis HPA se programa durante la gestación de forma irreversible en periodo adulto.
Š La malnutrición de la madre gestante, su estres psico- social o una infección; activan el axis HPA maternal y pasan cantidades grandes de glucocorticoides de la madre al feto que retardan su crecimiento y programan mal su axis HPA.
Š Tanto los niĖos nacidos pequeĖos asi como un axis programado de forma anómala son un factor de riesgo de padecer en adulto las patologias comprendidas dentro del sindrome metabólico.
Š El denominador común de dichas alteraciones–retardo de crecimiento fetal y mal programación del axis- parece ser la llegada en grandes cantidades de glucocorticoides al feto.
Estas patologías posteriores de adulto son las comprendidas en el llamado síndrome metabólico, es decir, alteraciones cardiovasculares, diabetes 2 e hipertensión, y todas ellas son, además, muy frecuentes en las sociedades actuales.
Por otra parte, estudios clínicos de estas patologías así como estudios epidemiológicos en humano (6-8) han mostrado que una mala programación de dicho axis acompaĖa, en periodo adulto, a la manifestación de dichas patologías.
Pero, además, estudios epidemiológicos en humano (9,10) mostraron que los neonatos pequeĖos al nacimiento, los que son pequeĖos para su edad gestacional (llamados niĖos SAG o small for gestational age en la literatura anglosajona) sin ninguna causa que lo justifique son un factor de riesgo para padecer en adulto las mismas patologías comprendidas en el síndrome metabólico anteriormente descritas y esos niĖos se conoce y se ha establecido que tienen un axis HPA programado de forma anómala. Pero no son factor de dicho riesgo los niĖos nacidos pequeĖos porque sean prematuros niĖos AGA –appropiate for their gestational age- ni tampoco los niĖos nacidos pequeĖos por causas conocidas llamados en el mundo anglosajón niĖos IUGR (intrauterine growth retardation). Todo ello fue absolutamente establecido en el siglo XX por estudios epidemiológicos en humano, así como por investigaciones básicas de eminentes investigadores como Hales, Barker o Gluckman (10-13).
Pero, antes de seguir adelante y adentrarnos en las investigaciones sobre esta temática en el siglo XXI, cabe preguntarse en que consiste esta programación anómala del axis hipotálamo –hipósisis – adrenal (HPA).
Un axis HPA anómalo es aquel en el cual la retroalimentación negativa que las hormonas periféricas ejercen, en este caso corticoides, a nivel de hipotálamo y a nivel de hipófisis, se realiza mal. Y en ese caso hay una exagerada producción de hormonas periféricas, corticoides circulantes, en el HPA. Esta programación anómala fetal se produce cuando por malnutrición, estrés psicosocial o desequilibrios hormonales de la madre gestante pasan al feto masivamente corticoides maternales.
Todos los axis endocrinos funcionan igual. Las hormonas hipotalámicas descienden por el sistema porta a la hipófisis y Źsta, a su vez, envía a las glándulas periféricas la correspondiente hormona hipofisaria que, finalmente, estimula en la glándula periférica la hormona: gonadal, tiroidea o adrenal, según consideremos axis gonadal, tiroideo o HPA. Por ello, en todos los axis endocrinos es muy necesario dicho taponamiento o retroalimentación negativa a nivel hipotalámico e hipofisario para que el axis no funcione desmedidamente y suban de forma continuada y exagerada los niveles de hormonas gonadales, tiroideos o adrenales en plasma (figura 1).
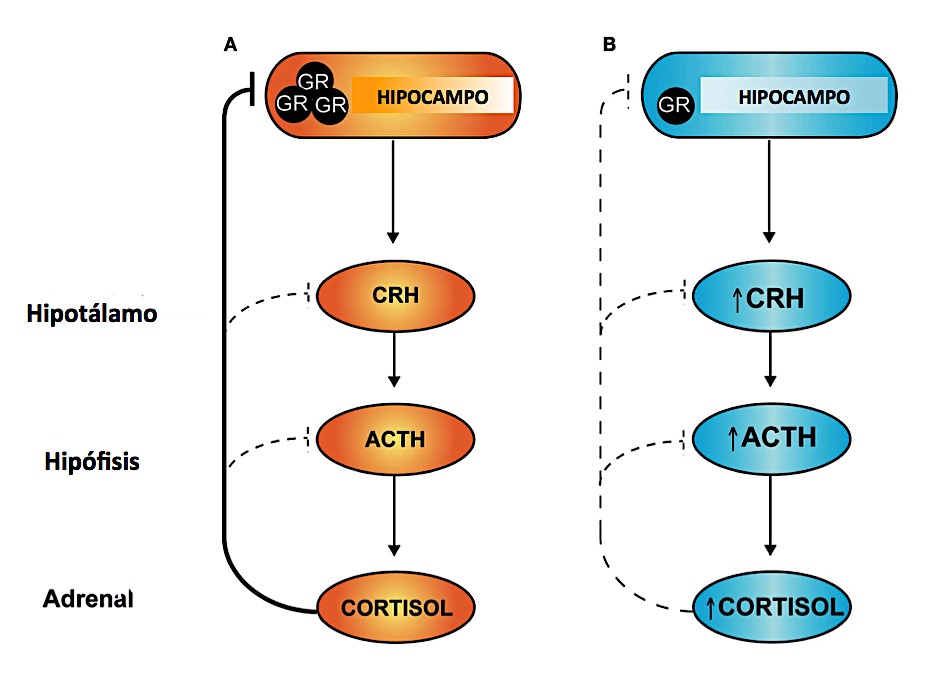
Figura 1.- Programación prenatal: A) axis bien programado con muchos receptores de glucocorticoides GR en hipocampo. B) axis anómalo con escasez de GR en hipocampo ver texto HPA (hipotálamo-pituitaria-adrenal).Esquema modificado de referencia (23).
Pero ello es muy importante en el axis HPA, ya que existe una gran cantidad de receptores de hormonas adrenales en órganos vitales del organismo: páncreas, hígado, sistema esquelético etc. y, ello podría tener efectos devastadores para el organismo. Las conclusiones de las investigaciones sobre esta temática durante el siglo XX establecieron, como se muestra en la figura1A, que un axis HPA bien programado es el que tiene cantidades grandes de receptores de corticoides GR, de cortisol en humano, en su hipocampo. Mientras un axis mal programado es el que tiene (figura 1B) escasez de receptores GR hipocampales, porque también se estableció en el siglo XX, que los receptores hipocampales tienen una acción tónica muy importante en la regulación del axis HPA, regulando la descrita retroalimentación negativa.
En la figura 2 puede verse cómo y porqué se programa de forma anómala el axis HPA según los conocimientos actuales.
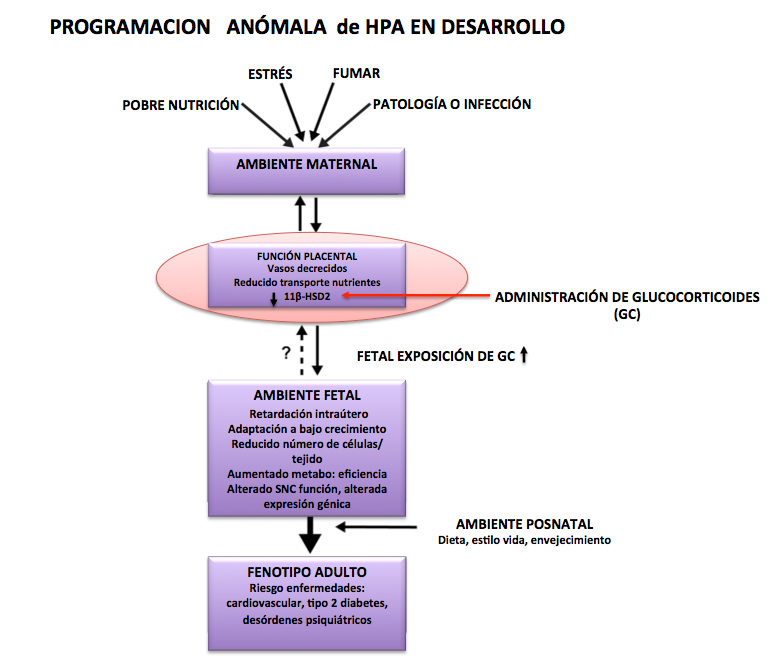
Figura 2.- Estrés, fumar, malnutrición maternal, activan el axis HPA de la madre gestante. Cantidad de glucocorticoides (GC) maternales modifican el ambiente placental: vasos decrecidos, poco paso de nutrientes, reducida secreción de actividad enzimática 11bHSD-2 que inactiva los GC maternales en placenta. Todo ello, altera el ambiente fetal: bajo crecimiento, adaptación a malas condiciones, alteración de SNC y finalmente alteraciones genéticas, como veremos. Lo mismo se produce por administración masiva de glucocorticoides a la madre que pasarán a la placenta, parte central de la gráfica. Ello producirá un fenotipo adulto con riesgo de enfermedades cuya aparición depende del estilo de vida del adulto, de su ambiente postnatal Esquema remodelado de referencia (23). Modificada de Cottrell, C. and Seckl, J. Frontiers in Behavioral Neuroscience, 3: 1 – 9. 2009.
ņPero cómo lo hacen?, ņpor qué mecanismo la llegada masiva de glucocorticoides maternales disminuye los correspondientes receptores en el hipocampo en periodo fetal ?
Y todo ello, dado el interés clínico de la cuestión, ha sido abordado e investigado durante el siglo XXI.
3. TRABAJOS REALIZADOS EN EL SIGLO XXI
A partir de 2004 -2005 comenzaron a publicarse muchos trabajos sobre esta temática bajo la luz de los conocimientos actuales y por la presión clínica que supone el hecho de que las patologías comprendidas en el síndrome metabólico se manifiestan con enorme frecuencia en las sociedades actuales.
Así pues, se reemprendió el estudio de la programación del axis HPA en periodos gestacionales ya que estaba claro que las causas de malnutrición o desequilibrios hormonales de la madre gestante tienen como denominador común la llegada masiva de glucocorticoides de la madre al feto, y como consecuencia se produce un mal crecimiento fetal. Pero, además, los estudios neonatológicos sobre el desarrollo de mamíferos muestran que durante la gestación el 80% de los glucocorticoides fetales son de origen maternal ya que hasta el final de ella el axis HPA fetal no es funcional. Sin embargo, al final de la gestación este axis fetal funciona activamente ya que los glucocorticoides fetales son necesarios para la preparación del parto y para estimular y finalizar la gran maduración y diferenciación de órganos fetales que van a ser imprescindibles al neonato en su vida extrauterina.
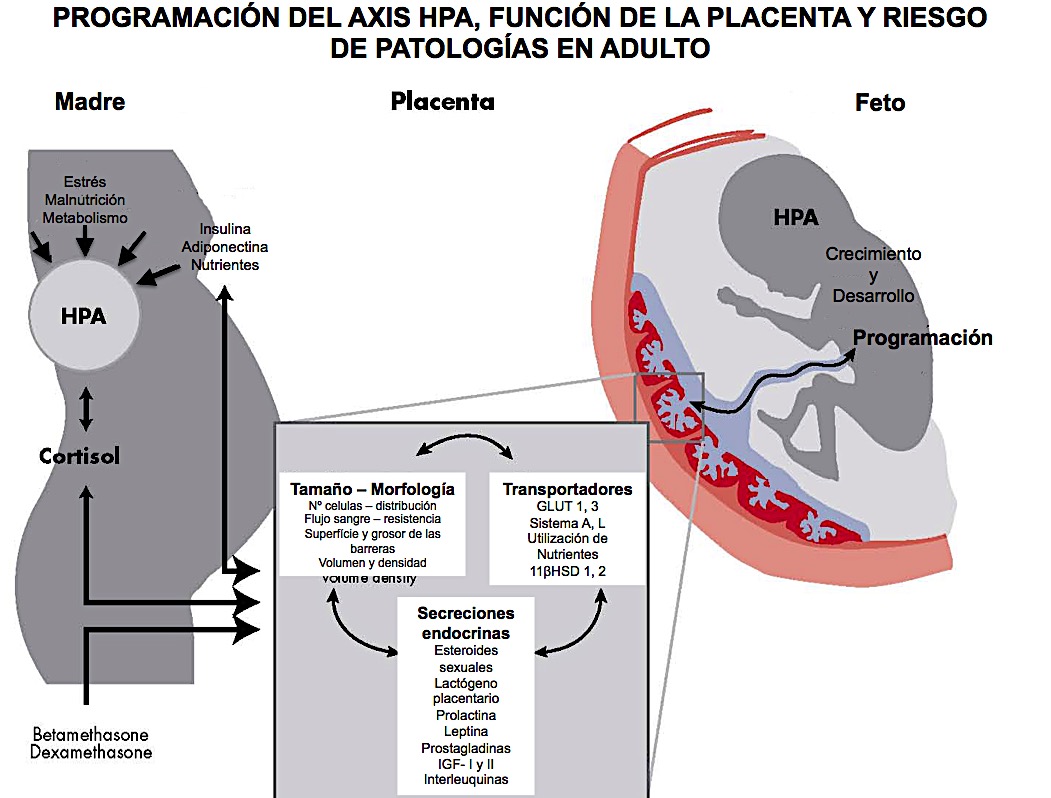
Para describir el nivel de conocimiento a que hemos llegado actualmente, en esta vertiente temática, en primer lugar, vamos a hablar de los trabajos publicados en 2013 por departamentos de obstetricia, y sus correspondientes grupos de investigación de Berlín, Australia y Canadá (14). Estos autores, partiendo de una visión fisiológica del tema estudian in vivo e in vitro, con tecnologías y conocimientos actuales, las causas y circunstancias por las cuales la malnutrición materna o su estrés psicosocial y sus desequilibrios hormonales provocan la programación de forma anómala del axis HPA, en los mamíferos, durante el periodo fetal. Todo ello debido a que dichas situaciones producen en la madre gestante una subida de los glucocorticoides maternales, por la activación de su propio axis HPA ante esas situaciones de emergencia, y esos glucocorticoides maternales pasan al feto, como ocurre, también en el caso de hiperinsulinemia maternal por diabetes gestacional (figura 3).
Estos autores, además, están motivados en sus investigaciones por su conocimiento de que en la clínica se siguen utilizando la dexametasona y la betametasona para la prevención de partos prematuros o en casos de asma maternal (15), así como por la sospecha de una hiperplasia adrenal congénita en los fetos hembra. Y, además, existen publicaciones que denuncian alteraciones cognitivas de aprendizaje y problemas de conducta, en niĖos cuya madre fue tratada con dichos glucocorticoides de síntesis en su gestación (16).
Figura 3.- Condiciones de estrés maternal activan el HPA de la madre. El cortisol maternal pasa a placenta y altera la morfología y el tamaĖo placental. Se modifican y reducen las secreciones en placenta que son muchas y todas dedicadas al crecimiento del feto. En placenta y en tejidos fetales hay desde el principio de la gestación cantidades de receptores de glucocorticoides GR. Modificada de referencia (14).
En este estudio utilizan un modelo en oveja in vivo (figura 4). La oveja nace más madura que el hombre en cuanto a su SNC, pero su corticoide fisiológico es el cortisol como en el hombre y no la corticosterona como en las ratas, por ello consideran la oveja muy adecuada para estos estudios.
En sus conclusiones, establecen que un subóptimo ambiente fetal está totalmente asociado a riesgo de patologías del síndrome metabólico: hipertensión, diabetes 2, obesidad y alteraciones cardiovasculares, además de peso reducido al nacimiento en los SAG –niĖos con pequeĖo peso para su edad gestacional –, como hemos dicho. Constatan que al final de la gestación existe, en todas las especies de mamíferos, una elevación en hipotálamo del mRNA de CRH –hormona corticotropa hipotalámica- y cuando se activa el axis HPA el mRNA de la molécula POMC (proopiomelanocortina) aumenta en hipófisis, ya que es la POMC la molécula de que deriva el ACTH, hormona hipofisaria corticotropa. A su vez, la llegada de ACTH a la corteza adrenal supone el aumento de secreción de cortisol en humano y en oveja en la corteza adrenal.

Figura 4.- Efecto del tratamiento antenatal con glucocorticoides en oveja. Inyección in vivo de cortisol, por vía intraperitoneal, a una oveja gestante donde se destacan las grandes alteraciones en la estructura placentaria y como consecuencia la reducción de la secreción de lactógeno placentario (PL) por disminución de células binucleares BNC –estudio histológico en el centro.-que son las que secretan PL. Modificada de referencia (14).
Estos autores seĖalan que es la llegada masiva de glucocorticoides maternales al feto lo que produce una programación anómala del axis HPA y también restricción de crecimiento en los fetos en los SAG, como hemos dicho. Son los glucocorticoides maternales en altos niveles los que por una parte programan mal el HPA y por otra producen una mala diferenciación de órganos y sistemas que llevaron a Hales en 2001 a lanzar la hipótesis del fenotipo ahorrativo en periodo adulto (6,10,11). Y el resultado de la llegada de altos niveles maternales de glucocorticoides al feto depende de la clase de glucocorticoide y del periodo gestacional en el que se produce.
En ese artículo se destaca grandemente la importancia de la placenta en estas cuestiones y, en general, para la regulación del crecimiento fetal (figura 3). Porque la placenta no es un mero órgano para transportar nutrientes, es una glándula secretora. En la placenta se secretan hormonas con estructura polipeptídica parecida a las hormonas hipotalámicas, y también hormonas, glicoproteínas, parecidas a las hormonas hipofisarias, como el lactógeno placentario (PL). Las células placentarias, los trofoblastos, fundamentalmente los sintiotrofoblastos tienen todas las características de células secretoras (17) También se expresan en la placenta transportadores de glucosa como el Clut 1 y 3 y se secreta la actividad enzimática 11-beta hidroxiesteroide deshidrogenasa 2 (11b-HSD-2), actividad capital para regular el paso de glucocorticoides activos al feto desde la madre (figura 3). Esta actividad es una barrera placentaria para inactivar los glucocorticoides activos a inactivos es una deshidrogenasa. Y existe una correlación positiva entre el peso fetal y dicha actividad enzimática en placenta y en tejidos fetales (4).
La placenta también secreta el factor de crecimiento similar a la insulina (IGF-1) que es considerado la hormona de crecimiento fetal. Existe una correlación positiva muy alta entre los niveles fetales de IGF-1 y el crecimiento fetal. En nuestro grupo de trabajo fue un tema muy estudiado (18-20)
Realmente, se puede decir que la placenta representa la unión del feto con el medio exterior y es capaz, por sus secreciones y por propiciar la llegada de nutrientes, de suplir al organismo fetal y regular su crecimiento en cuestiones que después del nacimiento harán los órganos ya formados del neonato, como riĖones, pulmones, glándulas endocrinas y tracto gastrointestinal neonatal. La placenta, de muchas formas, modula el ambiente de crecimiento del feto. y su homeostasis.
Estos autores destacan en su trabajo la necesidad de ahondar en el estudio placentar (figura 4).
En su modelo de oveja, inyectan intraperitonealmente in vivo a la madre gestante glucocorticoides (figura 4) y observan elevación de la presión arterial en la madre y la restricción del crecimiento en el feto, además de modificaciones en la regulación de su axis HPA, con alteraciones de la tolerancia a la glucosa en su etapa adulta. Aducen que ello ha sido probado en macacos, ovejas, ratas y humanos, y que todo ello llevó a la creación en 2003, en el Reino Unido, de la Sociedad Internacional durante el Desarrollo de la Salud y la Enfermedad–International Society for the Developmental Origin of Health and Disease ((DOHaD) (10).
En su trabajo resaltan el hecho de que a pesar de que durante el periodo gestante de los mamíferos el glucocorticoide circulante es de origen maternal, y sus niveles no son altos, ya que, solamente, al fin de la gestación se produce una gran elevación de glucocorticoides circulantes en el feto debido al funcionamiento del axis fetal (figuras 3 y 4 ). Sin embargo, durante toda la gestación existe una gran cantidad de receptores de glucocorticoides tanto en la placenta como en los tejidos fetales desde el principio hasta el fin del periodo gestacional. Hoy se sabe que los knock out, los animales que no expresan dichos receptores GR por manipulación genética, no crecen, no prosperan, y los transgénicos en los que se reduce el 30-50 por cien los GR tienen un axis HPA mal programado. En su trabajo destacan, en sus experimentos in vivo inyectando glucocorticoides a la oveja (figura 4), cómo la llegada de corticoides a la placenta, por una parte, modifica y desestructura la formación de tejidos y capas celulares placentarias y, por otra, disminuyen en placenta, secreciones como el lactógeno placentario (PL). El PL tiene, además, acciones en la madre gestante adaptando su metabolismo para que disponga de nutrientes. Y, en placenta estimula la secreción de IGF-I que, como hemos dicho, es la hormona de crecimiento fetal. El PL es somatotropo; estimula la toma de aminoácidos por la placenta y también la síntesis de glucógeno.
Pero el lactógeno placentario es producido en la placenta por células placentarias, trofoblastos binucleados, llamadas células BNC, y el número de ellas sube al final de la gestación. Sin embargo, la llegada masiva de glucocorticoides maternales a la placenta baja el número de BNC y remodela de forma anómala las capas celulares placentarias (figura 4) (14). Todo lo cual indica que la llegada de glucocorticoides maternales a la placenta, en grandes cantidades, tendrá como resultado, por una parte, una mala adaptación metabólica maternal, que impedirá que disponga la madre de los nutrientes necesarios para el feto por la disminución de secreción placentaria PL, y, por otra parte, disminuirá la secreción del IGF-I placentario que es estimulada en la placenta por dicha secreción PL, todo lo cual tendrá como consecuencia la disminución del crecimiento fetal. Por ello, estos autores remarcan, con sus resultados, el interés de aumentar las investigaciones placentarias en curso.
También en la placenta se secreta el CRH –hormona hipotalámica del axis HPA- la cual es regulada al alza por el cortisol y las citoquinas, y tiene acciones sobre el miometrio (14). Es un vasodilatador aumentando el paso de nutrientes por la placenta y tiene acciones en la amígdala porque existen sus receptores en ella Por ello, creen que el aumento en la placenta de CRH, por la llegada de glucocorticoides, parece implicar al CRH en las alteraciones emocionales que presentaran posteriormente los niĖos con axis HPA mal programado en etapa fetal (14), ya que la amígdala, en los mamíferos, controla las emociones y se le ha llamado cerebro emocional
Hay que remarcar antes de seguir adelante las grandes aportaciones de los autores de este trabajo a esta temática. Trabajos realizados, además, desde una perspectiva fisiológica y muchas veces clínica (21,22)
La concepción actual de cómo y de qué forma se programa de forma anómala el axis HPA en los mamíferos viene expuesta y explicada en la figura 2 (23).
Hoy se sabe que los receptores de glucorticoides GR se codifican en el exón 2-9 del promotor de GR y que la llegada masiva de glucorticoides baja los GR en el hipocampo, pero la gran pregunta es: ņpor qué mecanismo? ņcómo lo hacen?
Para contestar a estas cuestiones y muchas otras, ya en el siglo XX se enunció y se comenzó a hablar de la epigénesis, cuyos principales logros, fueron:
Š 1939 Waddington. “La epigenesis son las interacciones causales entre los genes y sus productos de los cuales resulta el fenotipo”.
Š 1995 Razin A. , Shemer R . DNA methylationin early development. Hum. Mol. Genet. 4:1751 -1755.
Š 1998 Razin A. CpG methylation, chromatine structure and gene silencing: three way connection. Embo.Journal 17:4905-08.
Š 1980 RazinA. DNA methylation and gene function. Science 210: 604-610.
4. EPIGÉNESIS
Waddington en 1939 definió la epigénesis como las interacciones causales entre los genes y sus productos de los cuales resulta el fenotipo. Y se publicaron importantes trabajos que aportaron un cúmulo de conocimientos sobre el tema (24-27).
Pero nosotros nos vamos a referir a los trabajos, absolutamente remarcables y rigurosos, del grupo de Michel Meaney en la Universidad Mc. Gill, en Montreal, Canadá, publicados ya en el siglo XXI, por la gran cantidad de conocimiento que han aportado tanto en sus trabajos del 2004 como los publicados en 2008 (28,29).
El Dr. Michell Meaney es Profesor de Medicina de Douglas Hospital Research Centre de la Universidad Mc Gill en Montreal, una de las más prestigiosas universidades de Canadá, y ha sido Director del Proyecto sobre “Neurodesarrollo, Vulnerabilidad y Adversidad Maternal”.
Ya en el aĖo 2000 (30) dicho grupo observó que había dos tipos de comportamiento de la madre en las camadas de rata. Existen madres que se comportan con cariĖo y con mimos y ayudan en la lactancia a sus crías con lamidas, etc., mientras otras rechazan a sus neonatos y los arrojan con patadas y sin ninguna caricia. Pero estos autores dejaron crecer hasta adulto a las crías procedentes de ambos tipos de madres y observaron que las ratas más mimadas por su madre eran más aptas, en periodo adulto, para el aprendizaje de cuestiones regidas a nivel de hipocampo como son los aprendizajes con un componente espacial (5). Entonces midieron la expresión de factores neurotróficos en dicho órgano y la activación de determinados receptores en el hipocampo y concluyeron que los animales que fueron cuidados por su madre tienen activada la sinaptogénesis hipocampal.
En el aĖo 2004 publicado en Nature Neuroscience (28) estudian, en este mismo modelo, el hecho de que los descendientes adultos de madres cuidadoras tienen un axis HPA bien regulado y no presentan, desde su nacimiento hasta el estadio adulto, cuadros de ansiedad ante el estrés. Mientras que sucede lo contrario en los descendientes de madre poco cuidadoras. Pero para que, entre ambas situaciones, haya dicha diferencia tiene que haberla en la programación del axis HPA. Imaginan que, quizá, el cuidado materno en la edad temprana, ha alterado el número de receptores de glucocorticoides (GR) en su hipocampo. Piensan que las caricias maternas han aumentado el número de receptores.
Lo primero que abordan es esclarecer si puede haber alguna diferencia genética entre las crías de ambos tipos de camadas trasmitida por vía maternal Para ello cruzan a las doce horas del nacimiento crías de una camada con la otra (figura 5).
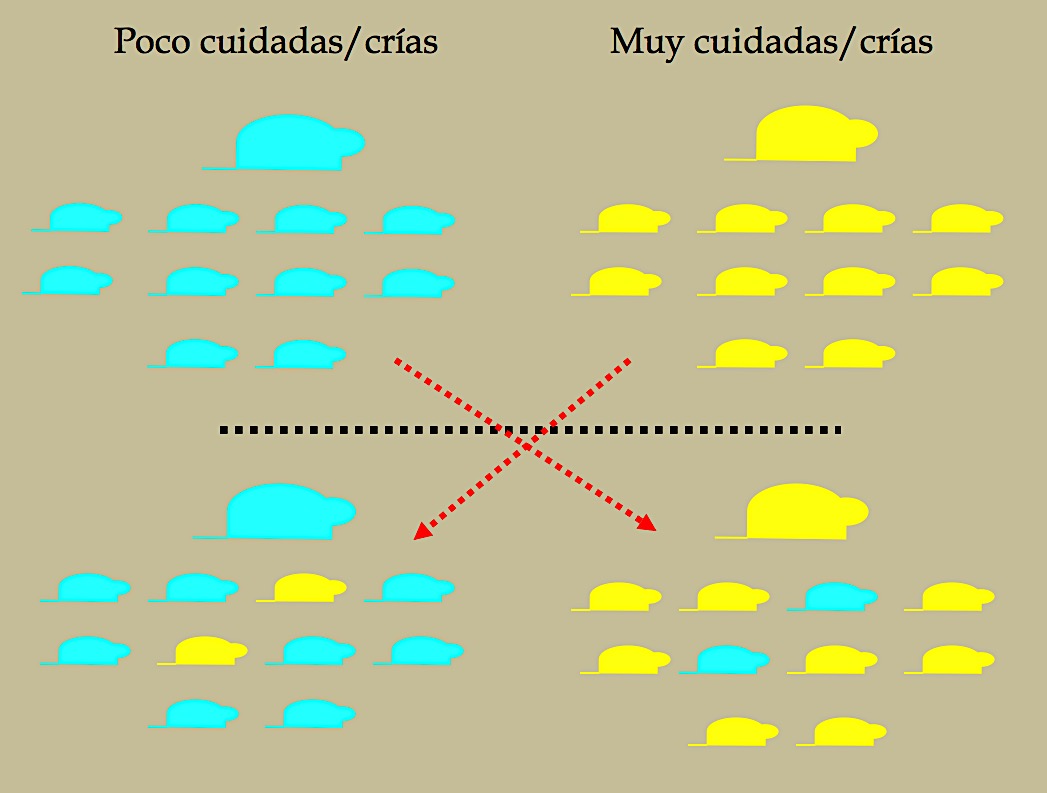
Figura 5.- Muestra de cómo a las 12 horas del nacimiento introducen crías de una camada en otra camada cuya madre se comporta de forma distinta, en periodo lactante, a su madre biológica. Comprueban que las diferencias encontradas en el funcionamiento del axis HPA y su comportamiento ante el estrés, es debido al trato recibido en la lactancia y no a ninguna transmisión genética hecha por su madre biológica.Gráfica sugerida y reformada de citas (28,29)
Introducen a las 12 horas del nacimiento crías nacidas de una madre en la otra, para que sean criadas en distintas condiciones en el periodo lactante. De esa forma comprueban que los adultos procedentes de una madre cuidadora se comportan todos igual en cuanto a su axis HPA y situaciones de estrés, teniendo un axis bien programado aunque, parte de ellos, hayan nacido de la madre arisca y, exactamente, lo mismo sucede con los criados por la madre no cuidadora. Descartando así, que la diferencia de programación del axis HPA fuera debida a alguna transmisión genética diferencial hecha por su madre biológica.
Estos autores basándose en conceptos epigenéticos, recientemente establecidos (figura 6) piensan que son los estímulos sensoriales de las caricias de la madre los que han producido una alteración química en dinucleótidos del ADN en el gen que expresa receptores de glucocorticoides en el hipocampo.
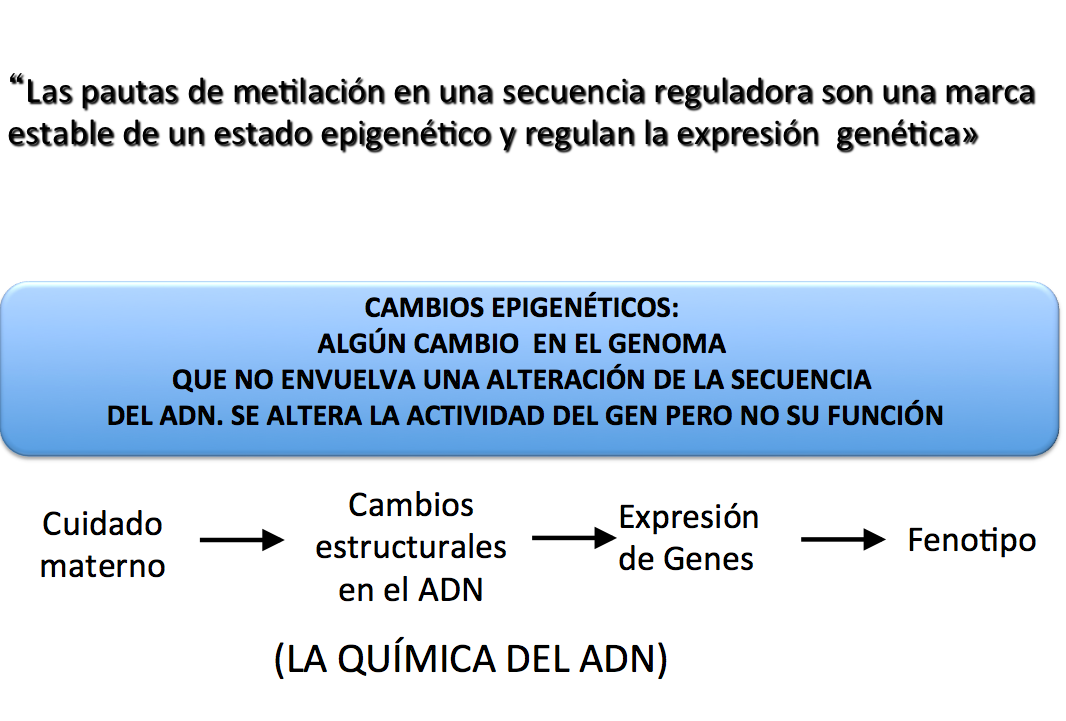
Figura 6.- En la parte superior: enunciado de cuestiones epigenéticas establecidas desde finales del siglo XX. En la parte inferior: hipótesis de trabajo de Meaney y colaboradores: las caricias de la madre lactante o las no caricias, parecen producir cambios estructurales en el ADN de determinados genes en sus crías, lo que llaman la química del ADN.
En trabajos anteriores del grupo de Meaney (31,32) habían concluido que solamente quince minutos de manoseo y caricias a las crías a partir de los seis primeros días de vida, durante aproximadamente dos semanas, aumentaba, permanentemente, los receptores de glucocorticoides hipocampales GR, lo que potenciaba la sensibilidad de la retroalimentación negativa en el axis HPA y bajaba, en trabajos in vivo, el nivel de glucocorticoides circulantes cuando se activa dicho axis. Es decir da como resultado un axis programado de forma normal. También, en trabajos por manoseo y caricias de ratas neonatales los primeros días de vida habían encontrado implicada en estas cuestiones a la serotonina y su receptor tipo 2 con la regulación de la expresión en hipocampo del receptor de glucocorticoides GR. pero siempre en presencia de hormonas tiroideas(33). Y todo ello había sido hallado in vivo en neuronas hipocampales neonatales y adultas por otros autores (34) Por último hoy también se sabe (14) que la dexametasona incrementa en el cerebro de rata el transportador de serotonina.
Con todos estos antecedentes ellos, in vitro, inducen la expresión en neuronas hipocampales de la expresión del receptor de GR con serotonina. La inducción de serotonina requiere la presencia de hormonas tiroideas (figura 7) que se elevan por el manoseo de las crías en ratas y cobayas (34).
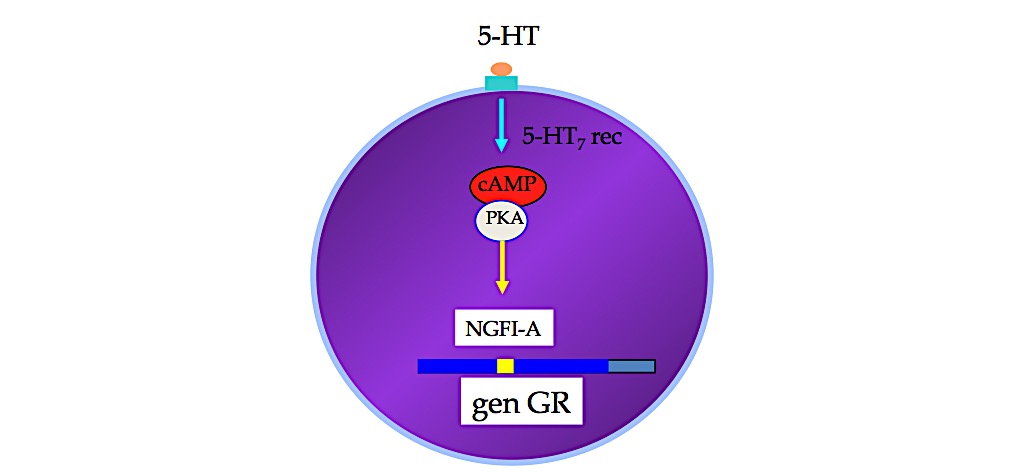
Figura 7.- Efecto in vitro de 5-HT sobre la expresión de GR en el cultivo de neuronas hipocampales. El efecto de 5-HT es completamente bloqueado por inhibir la unión de NGFI-A. Esquema extraído y modificado de los trabajos in vitro del grupo de Meaney, referencias (28 y 30) que ratifican sus estudios in vivo. En cultivo de neuronas hipocampales la introducción de serotonina (5-HT) induce un receptor de serotonina acoplado a c-AMP y sus asociadas protein quinasas (PKA)que reclutan un factor de transcripción NGFI-A el cual debe fijarse al gen que expresa receptores de glucocorticoides (GR) en el hipocampo para expresar o no expresar GR.
En esta activación serotoninérgica está implicado un subtipo de receptor serotoninergico que actúa acoplado al cAMP y con las enzimas protein quinasas dependientes de cAMP (acido adenosin monofosfórico). Por ello el efecto de la serotonina puede ser mimetizado por el cAMP o sus análogos.
In vivo, observan que el manoseo estimula el cAMP, el cual recluta un factor de transcripción específico el NGFI-A, factor de crecimiento nervioso inductor de proteína A, y también otro factor de transcripción el AP-2, los cuales se tienen que unir a la secuencia consenso del promotor del gen del receptor de glucocorticoides GR para que tenga lugar la transcripción y, por tanto, la expresión del gen del receptor de glucocorticoides con el consiguiente aumento de dichos receptores GR en el hipocampo (28).
Así que lo que ellos establecen es que las caricias de la madre rata ascienden por vía serotoninérgica desde el nucleo raphe cerebral, donde se segrega la serotonina, al hipocampo. La inducción de serotonina, para aumentar la transcripción en el promotor del gen que expresa receptores de GR, require la presencia de hormonas tiroideas y, en la acción serotoninérgica, actúa un subtipo de receptor de serotonina regulado por corticoides. Por ello la transcripción o no en el gen que expresa receptores de glucocorticoides depende de la fijación o no del factor de transcripción NGFI-A a su secuencia consenso en el promotor del gen de GR.
Estos investigadores supusieron que dicha fijación parece producirse de forma diferente en las crías procedentes de madres cuidadoras con respecto a las no cuidadoras, ya que son las crías de madre cuidadora las que parecen tener muchos receptores de glucocorticoides en el hipocampo por lo que funciona bien su axis HPA, incluso en periodo adulto, cosa que no sucede en los adultos que proceden de madre no cuidadora. Entonces, dados los conocimientos y axiomas establecidos por los estudios epigéneticos piensan que la fijación o no del factor de transcripción NGFI-A a su secuencia consenso en el promotor parece estar regulada por estados epigenéticos distintos en ambas camadas. Creen que las caricias maternas producen alteraciones epigenéticas de tipo químico en la estructura del DNA del gen de GR pero sin cambiar la secuencia de sus dinucleótidos. Se basan en conocimientos establecidos en epigénesis, que posteriormente comentaremos, que se pueden resumir en el siguiente esquema y figura 8, donde se enuncian cuestiones epigenéticas hoy totalmente aceptadas:
1. ņMetilación del ADN marca estable en la transcripción de un gen.?
2. Estructura cromática activa Hipometilación de citosinas del dinucleótido CpG de regiones reguladoras de la expresión de un gen activación transcripción.
3. Estructura cromática inactiva Hipermetilación de citosinas del dinucleótido en CpG de regiones reguladoras de la expresión de un gen inactivación de transcripción.

Figura 8.- Esquema de metilación del ADN extraído y modificado de citas (35 y 36). La metilación del ADN ocurre en el dinucleótido CpG (¨citosina–guanina) La metilación está asociada con silenciación de genes.
La metilación del ADN es una marca estable, irreversible, de un gen se pone con interrogante porque está en discusión. Pero está completamente aceptado que la estructura cromática de un gen modula la metilación o no de su ADN. Si está activada la cromatina producirá hipometilación del ADN que finalmente activará la transcripción del gen. Si está desactivada producirá metilación del ADN y finalmente bloqueo de la transcripción del gen (figura 8).
Y partiendo de estos conceptos, y con el conocimiento de que la secuencia consenso donde se fija el factor de transcripción NGFI-A está en el exón 7 del promotor del gen de receptores de glucocorticoides (GR), mapean dicha región buscando una diferencia en ella con respecto a la metilación del dinucleótido CpG entre las crías procedentes de madre cuidadora y las procedentes de madre no cuidadora. Encuentran efectivamente que en dichas regiones está mucho más metilado el dinucleótido CpG en las crías procedentes de madre no cuidadora, con lo cual se silenciará dicha transcripción, y el gen de GR se expresará menos y por tanto habrá menos receptores de glucocorticopides en su hipocampo que en las crías hipometiladas que procedes de madre cuidadora.
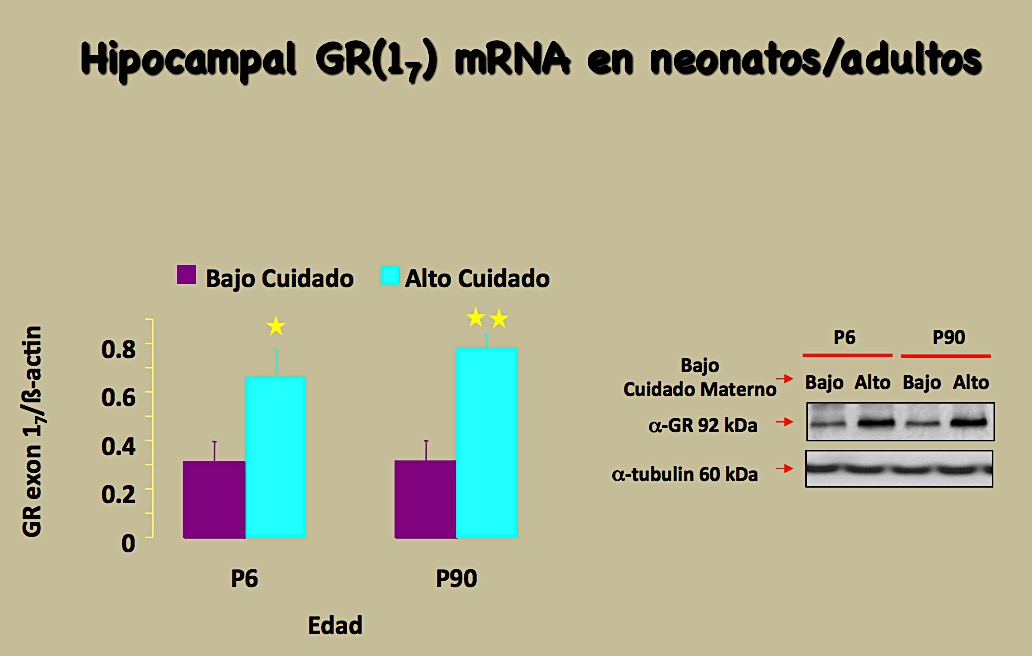
Figura 9.- Estudio de mRNA -ARN mensajero- del receptor hipocampal de crías procedentes de madre con bajo cuidado –prisma oscuro- y de alto cuidado –prisma verde – a la derecha se muestra la foto del análisis correspondiente. Siempre las crías procedentes de madre con bajo cuidado tienen, estadísticamente significativo, mucho más bajo el mRNA del receptor de glucocorticoides GR tanto a seis como a 90 días de vida en relación a las crías cuidadas. Modificada de citas (28, 29).
Así que mapearon diferencias de metilación de las citosinas en el dinucleótido CpG (citosina –guanina) en el exon7 del promotor de GR en el tejido hipocampal de las crías adultas procedentes de madre muy cuidadora y poco cuidadora en etapa neonatal. Lo hicieron utilizando bisulfito sódico y con un particular interés alrededor de la secuencia consenso del factor de transcripción NGFI-A. Encontraron que esa secuencia consenso esta siempre metilada en las crías que fueron poco cuidadas, y raramente lo está en las que fueron muy cuidadas. Los efectos del cuidado maternal incluyen neuronas y células gliales del hipocampo.
Pero para ratificar que efectivamente existen más receptores GR en el hipocampo de las crías cuidadas, ellos procedieron, en células de hipocampo, a medir la expresión del mRNA de los receptores GR de glucocorticoides en ambas crías procedentes de madre cuidadora o no cuidadora y lo hicieron a 6 o a 90 días de vida (figura 9) encontrando en ambas etapas de vida mucha más expresión de receptores GR en las crías procedentes de madre cuidadora.
5. SUCINTA RELACIÓN DE LOS CONOCIMIENTOS ACTUALES SOBRE LA MAQUINARIA EPIGENÉTICA
No es la intención de este trabajo, ni puede ser por razones de extensión, hacer una detallada reseĖa de los contenidos de la abrumadora cantidad de publicaciones que existen actualmente tratando de desentraĖar y establecer conocimientos rigurosos acerca de la maquinaria epigenética. Esta gran cantidad y su interés científico están estimulados, en gran parte durante el siglo XXI, por el hecho clínico de las aberrantes metilaciones encontradas en el ADN de células de tumores cancerosos.
En los tejidos cercanos al tumor se encuentran células con sus genes muy metilados en las citosinas del dinucleótido CpG de su ADN, lo cual bloquea su transcripción. Pero se ha visto que esos genes si se expresaran, por no estar metilados, darían lugar a proteínas que impedirían la formación del tumor, o bien expresarían proteínas que bloquearían la angiogénesis alrededor de él. O sea, en ambos casos, de alguna manera, se podría detener el proceso canceroso.
Es por ello que esta vertiente de investigación, actualmente, ha sido muy estudiada buscando, en vertiente terapéutica, el bloqueo de enzimas que impidan la metilación, y todo ello está aportando cantidades enormes de conocimiento acerca de los procesos epigenéticos y su maquinaria.
Hoy podemos definir la epigénesis como el conjunto de alteraciones químicas capaces de actuar sobre el ADN activando la expresión o no del gen, pero sin alterar la secuencia de sus dinucleótidos.
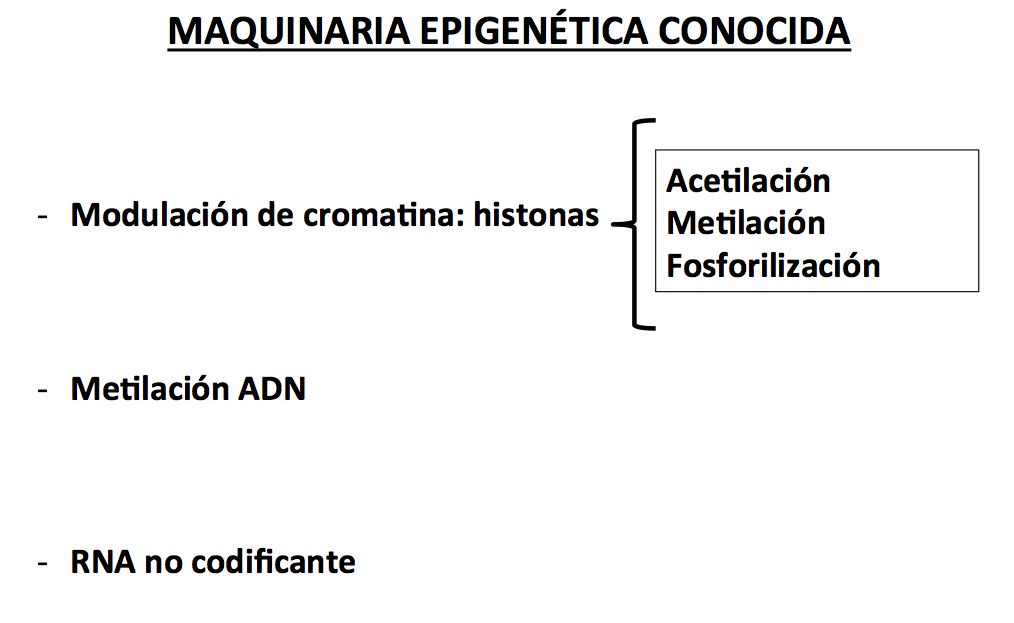
En el esquema1, se sintetiza la principal maquinaria epigenética conocida (en la figura 8 se muestra donde se produce la metilación del ADN).
La cromatina compuesta de histonas es enormemente modulable por acetilación, metilación o fosforilización. A su vez el estado cromático modula la metilación del ADN del gen. De dicha metilación del gen depende su transcripción. Las acciones de RNA no codificantes son mucho menos conocidas.
La epigenética determina la accesibilidad a la maquinaria de transcripción de un gen tal como hemos expuesto anteriormente.
Esquema 1. Maquinaria epigenética conocida.
En los genes, además del ADN, constituido por la secuencia de dinucleótidos, existe la cromatina.
La cromatina es un complejo multiproteico muy dinámico que fue descubierto hace unos 130 aĖos, pero las investigaciones sobre cromatina se reemprendieron hace unos 20-25 aĖos (37). La construcción básica de la cromatina es el nucleosoma que está constituido por un octámero de histonas (38). Las histonas reparan el ADN y de alguna manera remodelan y activan los genes. En el gen el ADN se enrolla alrededor de los nucleosomas. Actualmente, se cree que las histonas modulan la metilación o no del ADN por un código de histonas no totalmente conocido.
La cromatina muy dinámica se modula por acetilación, metilación y fosforilización. Siendo esta última modulación la menos conocida.
La acetilación da lugar a una cromatina activada que a su vez propende a una demetilación en el ADN y todo ello activa la transcripción. Sin embargo, la cromatina no activada, no acetilada, propende a la metilación del ADN y ello impide la transcripción del gen, según se muestra en el esquema 2.
La cromatina activada por acetilación propende a la demetilación del gen en su ADN. Ambas cosas se hacen reclutando las correspondientes enzimas histona acetil transferasa (HAT) para la cromatina y la ADN-demetilasa para la demetilación del ADN. La cromatina no activa, deacilada, propende a la metilación del ADN del gen utilizando respectivamente las enzimas histona deacilasa (HDAC) y ADN-metiltransferasa (DNMTs). La metilación del ADN se produce por reclutamiento de la enzima ADN metiltransferasa y la demetilación por la enzima ADN demetilasa. Las modulaciones de la cromatina se realizan reclutando las correspondientes enzimas conocidas de las histonas, según lo mostrado en el esquema 3.

Esquema 2. Mecanismos epigenéticos.
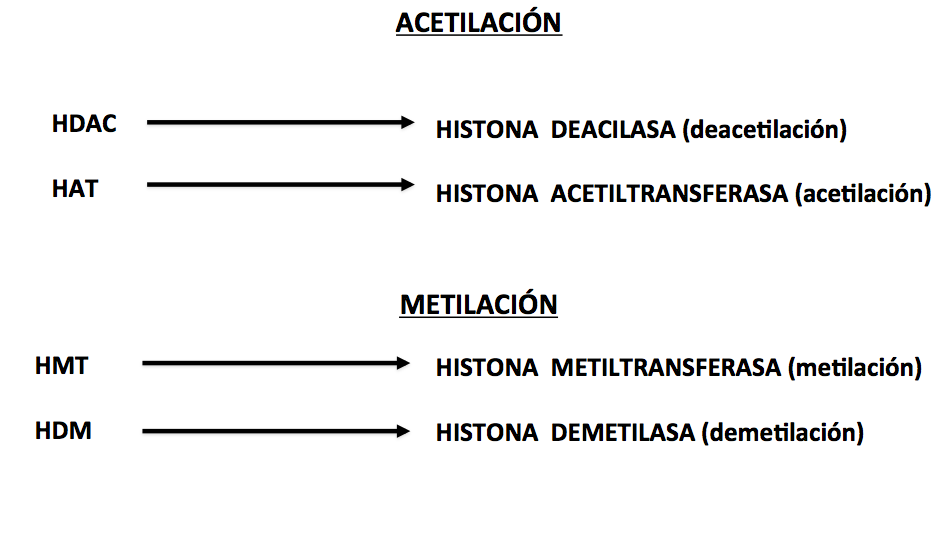
La metilación del ADN silencia genes mediante dos mecanismos fundamentales: a) metilando en sitios críticos (Fig.8), que inhiben la unión de factores de transcripción a su secuencia consenso, tal como hemos expuesto en el anterior trabajo del Dr. Meaney, y b) reclutando proteínas unidas a grupos metilo, fundamentalmente S-adenosil metionina (SAM). Finalmente, la metilación silencia genes por bloquear su transcripción, tal como hemos expuesto anteriormente y a su vez desactiva la cromatina reclutando la enzima histona deacilasa (HDAC) produciendo un efecto o cambio parecido a un polimorfismo o a una ablación del gen tal como se sintetiza en el esquema 4.

Esquema 4. Acciones de metilación del ADN.
Pero existe una diferencia fundamental las alteraciones genéticas se producen en todas las células del organismo porque todas tienen el mismo ADN y son irreversibles, pero las alteraciones epigenéticas se producen solamente en determinadas células de determinados tejidos y como veremos parece que pueden revertirse.
Estableciéndose entre la activación de la cromatina (acetilación) y metilación del ADN un equilibrio bidireccional del cual hablaremos posteriormente.
Con todo lo expuesto, podemos concluir que actualmente existen cuestiones en epigénesis absolutamente establecidas y sintéticamente reseĖadas en los esquemas anteriores (1-4; figuras 6 , 8 y 10). El último mecanismo reseĖado en el esquema 1, la existencia de mRNA no codificantes, se ha descubierto muy recientemente. Se ha estudiado sobre todo, en vertiente cancerígena. También se llaman micro RNA y parece que actúan degradando el mRNA (RNA mensajero), también, bloqueando la traslación, y silenciando, desactivando, la cromatina, aunque de ello se conoce poco.
Hay que seĖalar que como vamos a exponer más adelante, actualmente existe una controversia acerca de si, como se ha pensado durante más de 20 aĖos, la metilación del ADN es realmente una marca estable o es reversible,y el mundo científico parece cada vez más inclinarse por la reversibilidad.
Figura 10.- Equilibrio metilación-demetilación de ADN respectivamente modulado por inactivación –activación de la cromatina. En la parte central, arriba, ADN metilado (muchos CH3) y bajo demetilado (pocos CH3). Parte izquierda: la demetilación del ADN, por ADN demetilasa, se produce cuando la cromatina está activada (flechas blancas). Parte derecha: la metilación del ADN, por la ADN metiltransferasa, se produce cuando la cromatina esta desactivada (flechas negras). La activación de la cromatina –acetilación- requiere la enzima histona acetil transferasa (HAT) y la desactivación – deacilación- la enzima histona deacilasa (HDAC). Estos equilibrios parecen ser bidireccionales. Modificado de cita (39).
6. POSIBLE REPROGRAMACIóN EPIGENéTICA Y CONSIDERACIONES ACTUALES
En el aĖo 2008 (29) el grupo de Meaney recoge y expone experiencias ya comenzadas en el 2004 (28), en las cuales tratan de averiguar, en el modelo descrito de camadas con madres cuidadoras o no, si la metilación o no metilación de las citosinas en el exón 7 del promotor del gen que expresa receptores de glucocorticoides(GR)que ellos habían encontrado, respectivamente, en las crías no cuidadas por su madre – metiladas- o en las muy cuidadas –demetiladas-son procesos reversibles o si no lo son.
Para ello dejan crecer a las crías de madre cuidadora y de madre no cuidadora hasta etapa adulta. Primero, comprueban que las primeras tienen un axis HPA-hipotálamo-pituitaria- adrenal- programado de forma ajustada y normal, mientras que no lo tienen las provenientes de madre no cuidadora. Ello supone que en las primeras se ha producido una demetilacion alrededor de la secuencia consenso del promotor que a su vez ha aumentado la transcripción del gen, elevando, finalmente, el número de receptores de glucocorticoides en su hipocampo.
Para comprobar si dicha marca epigenética se puede revertir en periodo adulto, les suministran, por inyección cerebro-ventricular, S-adenosil metionina (SAM), el metil donor, y observan que su axis HPA responde entonces como el de las ratas provenientes de madre no cuidadora. Concluyen que se han metilado las citosinas en la secuencia consenso donde se fija el factor de transcripción con la consiguiente disminución de la transcripción y la baja de receptores GR (parte izquierda de la figura 11).
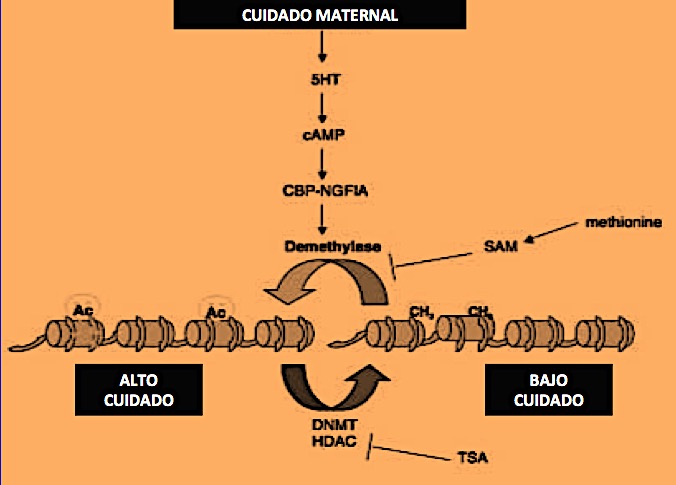
Figura 11.- Reprogramación epigenética. En la parte alta de la gráfica: el cuidado maternal recluta serotonina (5-HT) que llega al hipocampo se fija a un receptor de serotonina acoplado a c-AMP y se actúa a través del factor de transcripción NGFI-A-(ver texto) Parte izquierda (alto cuidado): la fijación de NGFI-A a la secuencia consenso del promotor del gen de GR se produce más en las crías de madre de alto cuidado cuando se demetila allí el ADN por ADN demetilasa porque la cromatina está acetilada (AC en gráfica). En parte derecha (bajo cuidado): el factor de transcripción NGFI-A se fija menos a su secuencia consenso porque se recluta ADN metiltransferasa que metila dicha secuencia (CH3 en gráfica). Reprogramación: si en periodo adulto se inyecta por vía cerebro-ventricular, a las de alto cuidado maternal, SAM (un metil donor) se metila el ADN en la secuencia consenso y los animales se comportan ante el estrés como las crías de bajo cuidado, por tener menor expresión final de GR. Y la reprogramación también ocurre en las de bajo cuidado si se inyecta TSA (un inhibidor de histonas deacilasas HDAC) que activará la cromatina, la acetilará, como en las de alto cuidado, ello reclutará ADN demetilasas y se demetilará la secuencia consenso fijándose más el factor de transcripción como ocurría con las de alto cuidado. Cosa que comprueban porque dichas ratas pasan a comportarse ante estrés como las de alto cuidado por aumentar en hipocampo los receptores de glucorticoides GR. Gráfica reformada referencia(29). NGFI-A (factor de transcripción inductor de proteína A), c-AMP (ácido adenosin monofosfórico-) SAM– (S-adenosil metionina-) DNMT (ADN metil transferasa) TSA –inhibidor de histona deacilasa (HDAC), GR(receptor de glucocorticoides) Ac (cromatina acetilada o activada), CH3 (ADN metilado). Modificada desde citas (28,29).
Sin embargo, a las ratas adultas provenientes de madre no cuidadora que tienen un axis HPA mal programado por poseer metilada dicha secuencia consenso les dan inyección cerebro- ventricular de TSA (una droga inhibidora de la enzima histona deacilasa (HDAC)), enzima que produce la deacilación de la cromatina, y sin la cual la cromatina deacilada piensan que se convertirá en cromatina activa acetilada por faltar dicha enzima. En consecuencia, dicha modificación cromática a su vez demetilará la secuencia consenso, con el consiguiente aumento de la transcripción y, por tanto, del número de receptores de glucocorticoides en el hipocampo (parte derecha de la figura 11) Es decir se comportaran como las crías procedentes de madre muy cuidadora.
Y obtienen así, una reprogramación en periodo adulto del proceso epigenético provocado por las caricias, o por las no caricias, en periodo neonatal de ambas camadas.
Los resultados hallados en este trabajo muestran, además, experimentalmente, el equilibrio bidireccional, hoy totalmente establecido por los estudios sobre el cáncer (39), que parece existe entre modulación cromática, activando o no la cromátina por acetilación, y la demetilación o no del ADN del mismo gen (figura 10)
Pero en este trabajo (29) que ellos titulan “El Ambiente social y el epigenoma” expresan, además, toda una serie de sugerencias y conclusiones. Se hacen preguntas todavía no contestadas para incitar y hacer reflexiones proyectadas al futuro.
Comienzan por establecer que la atención sobre la metilación del ADN se focalizó, en principio, finales siglo XX, en el estudio de las pautas seguidas durante el desarrollo (25,27) y por ello se asentó el principio de que las marcas en el ADN durante el desarrollo permanecían estables (27), cuya creencia ha durado por espacio de veinte aĖos. De la reprogramación que ellos consiguen en periodo adulto, que acabamos de exponer, deducen que las enzimas necesarias para las demetilaciones y metilaciones, en las ratas cuidadas o no cuidadas, se mantienen en etapa adulta, sin lo cual, dicen, no se podría producir la reversibilidad encontrada en dicho periodo. Afirman, pues, que actualmente se puede postular que la metilación del ADN puede producirse a lo largo de la vida y por tanto ello supone que se puede modular el genoma y afectar el fenotipo a lo largo de ella. Advierten y pronostican que si los cambios epigenéticos ocurren en células germinales entonces se transferirán a futuras generaciones.
Piensan que la maquinaria genética parece permanecer activa a través de la vida también en células postmitóticas. Prosiguen que hay pautas y seĖales, también en células maduras, que unen exposición extracelular a variaciones del ambiente y maquinaria genética, y para dicha aseveración aducen la reprogramación encontrada en sus camadas en el periodo adulto y también los trabajos de Miller y Sweatt en 2007 (40).
Estos autores muestran que los procesos de metilación–demetilación en el ADN de células hipocampales regulan procesos de aprendizajes adultos. Y, además, realizan sus experimentos provocando en las ratas situaciones de miedo. Con todo ello, afirman que la metilación de ADN es dinámica en células postmitóticas en el cerebro y en neuronas in vitro (41). Y estos experimentos (40,41) son un modelo en el cual el factor ambiental que produce el cambio epigenético, no es químicos, sino un factor ambiental psicosocial, miedo, exactamente igual que las caricias maternales en los experimentos del grupo de Meaney (29).
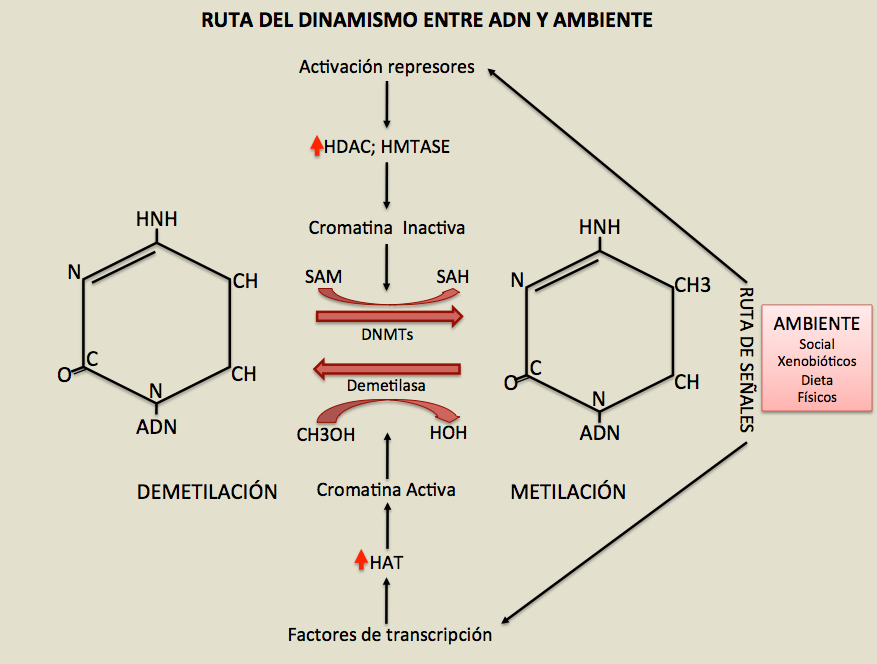
Figura 12.- Las seĖales exteriores que recibe el organismo por mal ambiente psicosocial, xenobióticos, malnutrición o físicos, pueden actuar como represores, o bien, actúan reclutando factores de transcripción que, finalmente, aumentarán la expresión de determinados genes. En la parte de arriba los represores, según los conocimientos actuales, reclutaran histona deacilasa (HDAC) en determinados genes de determinados tejidos, ello inactivará la cromatina de ellos, porque la deacilará, y como consecuencia se metilará el ADN de ese mismo gen, por acción de las ADN metil transferasas (DNMTs). La flecha horizontal, hacia la derecha, seĖala la metilación, en el carbono 5, de las citosinas del dinucleótido CpG. En la parte baja de la gráfica la seĖal actúa vía seĖales de factores de transcripción, y reclutará histona acetil transferasa (HAT) que activará la cromatina de determinados genes en determinados tejidos, que a través de demetilasas, demetilaran el ADN de esos mismos genes. La flecha horizontal, hacia la izquierda,, seĖala la demetilación de la citosina en el carbono 5, (CH3OH pasa a HOH). También se seĖala la posible reprogramación de estos procesos en las flechas curvas: arriba,, dando SAM, metil donor, las citosinas parte izquierda DEMETILACION pasaran a METILACION parte derecha. En la parte baja la otra flecha curva seĖala la demetilación de la citosina de estado METILADO en el carbono 5 de la citosina CH3OH a DEMETILADO CHOH - en la parte izquierda de la figura. Ello se hace dando un inhibidor, a las crías de madre cuidadora, de la enzima histona deacilasa (HDAC), el compuesto TSA, ver figura 11. Modificado de cita (29).
Por ello sugieren que una cosa importante a definir, en el futuro, es si los factores ambientales que pueden producir alteraciones epigenéticas son limitados a factores de tipo químico como la dieta, drogas y toxinas o si una alteración de ambiente psicosocial también lo hace. Y ello es muy importante porque establece un vínculo entre ambiente psicosocial y salud. Otra cuestión es si las alteraciones epigenéticas pueden llegar a alterar la conducta, por ejemplo la de aprendizaje (40) y también si ello se produce solamente en el desarrollo, o también a lo largo de la vida.
Hoy la neuroepigénesis está en sus comienzos, pero se está investigando intensamente y, sin duda, se perfila como muy importante para poder establecer terapéuticas eficaces en enfermedades neurodegenerativas como el Alzheimer.
Finalmente, intentan, sucintamente, exponer en un cuadro, con los conocimientos actuales de la maquinaria epigenética y las enzimas respectivas conocidas, junto con los factores ambientales, cómo se articula la ruta de seĖales. Y establecen que las seĖales de los factores ambientales pueden actuar como represores o bien reclutar factores de transcripción, lo que da como resultado un bloqueo de la trascripción del gen o bien una buena transcripción de él, respectivamente (figura 12).
En la parte de arriba de la gráfica, una ruta de seĖales activa represores inactivando la cromatina de determinados genes, lo que provocará la metilación en su ADN que, a su vez, bloqueará la transcripción. En la parte de bajo dichas seĖales provocan una activación de la cromatina de los genes que a su vez producirá la demetilación del ADN que propicia la fijación a su secuencia consenso de factores de transcripción que aceleran la transcripción.
Hay que remarcar que a pesar del gran acúmulo de conocimientos conseguido sobre la maquinaria epigenética, sobre todo en lo que llevamos de siglo XXI, quedan, no obstante, muchas lagunas de conocimiento. En esta ruta del dinamismo entre ADN y ambiente ņqué hace que una seĖal de un factor ambiental sea represora o por el contrario reclute factores de transcripción?ņ ņEn qué circunstancias y porqué ocurren ambas cosas? ņqué cuestiones propician y qué circunstancias producen una u otra vertiente y por qué?
Es indudable que estamos en el camino de encontrar las respuestas y también que ello propiciará el hallazgo de terapéuticas, hoy muy necesarias, para enfermedades autoinmunes, cáncer o patologías neurodegenerativas.
Lo que si hemos llegado a establecer y es totalmente aceptado en el mundo científico es que, diferencias interindividuales en marcas epigenéticas darán como resultado diferencias interindividuales en el fenotipo, tal como afirma Meaney (29). Y dicha aseveración ha venido a esclarecer, científicamente, el modelo vivo humano de los gemelos homocigóticos. Cualquiera que los haya tenido cerca sabe que tienen el mismo ADN pero, ya desde su nacimiento, su vulnerabilidad a determinadas enfermedades es distinta, y, lo que es más sutil son personalidades diferentes y de forma aún más clara si su biografía no es la misma. Dicho de otro modo, hoy está aceptado que el fenotipo es el producto de continuas interacciones entre el genoma y el ambiente (42).
La biología, en general, ha sido genocéntrica en las pasadas nueve décadas, sin embargo, actualmente, parece claro que el destino de un gen no está definido por la secuencia de su ADN, por si misma, sino también por la manera según la cual un gen es marcado y programado por modificaciones cromáticas, metilación de ADN y por no codificantes ARN(29).
Otra cuestión que es muy importante en biología: ņse transmiten generacionalmente los cambios epigenéticos?
Aunque actualmente existe bastante controversia al respecto y realmente falta investigación rigurosa sobre este tema, vamos, sin embargo, a tratarlo a continuación.
7. POSIBLE TRANSMISIÓN TRANSGENERACIONAL DE MARCAS EPIGENÉTICAS
Antes de seguir adelante seĖalaremos la gran importancia biológica que entraĖa esta pregunta para dos vertientes de investigación actuales.
La primera vertiente nos hace volver al principio de este trabajo.
Situaciones ambientales adversas durante el desarrollo programan de forma anómala, en periodo fetal, el axis HPA -.hipotálamo –hipofisis –adrenal- con la consiguiente mala respuesta al estrés durante toda la vida, y además reduce el peso al nacimiento. Ambas cuestiones son un factor de riesgo de padecer patologías, en periodo adulto, comprendidas en el síndrome metabólico ‑alteraciones cardiovasculares, diabetes 2, o hipertensión- como expusimos. Desde finales del siglo XX está claro que la mala programación del axis HPA y la reducción del crecimiento se producen por la llegada masiva de glucocorticoides maternales al feto y a la placenta, que finalmente reducen el número de receptores de glucocorticoides GR, pero todo ello, que fue investigado en el siglo XX, dejaba una pregunta pendiente que formulamos al principio: ņpor qué mecanismo los glucocorticoides disminuyen los receptores de glucocorticoides GR en hipocampo y quizá en la placenta?
Y para contestar a ella ha habido en el siglo XXI, como venimos exponiendo, que profundizar en los mecanismos epigenéticos. Y hoy existen resultados que indican que el mecanismo utilizado en dicha anómala programación por los glucocorticoides es un proceso epigenético.
Al principio de este trabajo remarcamos la importancia de la placenta, y de la necesidad de su buen funcionamiento para el crecimiento fetal. Y a partir de 2011 han comenzado a publicarse trabajos que demuestran que la restricción del crecimiento al nacimiento en humano está asociada con pautas anómalas de metilación de ADN en sus placentas, cuando se las compara con la metilación de placentas de niĖo con un peso normal al nacimiento. Hay que hacer notar que en alguno de estos trabajos, muy rigurosos, se han utilizado alrededor de 206 placentas humanas (43). Pero, además, también, en otros trabajos se ha encontrado correlación muy alta, en humano, entre la metilación del ADN en el promotor del receptor de glucocorticoides GR en placenta y el bajo peso al nacimiento, habiendo utilizado alrededor de 406 placentas humanas procedentes de niĖos de bajo peso y de sus controles, niĖos de peso normal al nacimiento y los cuales no tenían metilada la misma zona en el promotor del gen que expresa GR (44). Es decir, comenzamos a poder con rigor establecer que la llegada masiva de glucocorticoides, por una parte reduce el peso fetal y, por otra, programa mal el axis HPA de forma irreversible, y ambas cosas se realizan por el mismo mecanismo epigenético. Provocando, finalmente, la disminución de receptores GR en placenta o en el hipocampo por metilación del ADN en el promotor del gen que expresa estos receptores de glucocorticoides en placenta y en hipocampo fetal según hemos expuesto en los trabajos de Meaney (28, 29)
Decíamos al principio que la llegada de glucocorticoides maternales al feto programaba mal el axis HPA y ello era un factor de riesgo de enfermedades en periodo adulto. Pero si dicha mala programación se realiza por un mecanismo epigenético y, este se trasmite a lo largo de generaciones, la mala programación del HPA en periodo fetal, se convierte en un factor de riesgo, no solamente en periodo adulto sino un factor de riesgo en su descendencia y a través de generaciones. Es decir, es un problema mucho mayor en vertiente sanitaria y para la raza humana. Por ello, a partir de 2010, existe una literatura abundante, aunque no suficiente, intentando establecer si las marcas epigenéticas se trasmiten por vía generacional. Ya que ello es ahora de máxima importancia biológica y sanitaria.
La otra vertiente de no menos importancia que la reseĖada, contempla una deriva evolutiva.
También al principio se enunció el concepto darwiniano de la allostasis y se afirmó que si la allostasis abarca los mecanismos que los organismos poseen para adaptarse a una situación de emergencia y sobrevivir, en todo ello había una reminiscencia darwiniana. Dijimos que cuando en el siglo XIX Charles Darwin escribió el Origen de las Especies y expuso su teoría sobre la selección natural, por la cual según él evolucionaban las especies, no se conocía ningún mecanismo, en aquella época, por el que se pudiera realizar dicha selección natural. Pero como anunciamos en el siglo XXI comenzamos a conocer algún mecanismo para ello. Pues bien, ese mecanismo parece que son los procesos epigenéticos, pero, como anteriormente dijimos, siempre que consigamos demostrar que las marcas epigenéticas se trasmiten a través de las generaciones.
No obstante, y a pesar de que se está investigando intensamente, aún no existen suficiente bagaje de conocimiento para poder afirmarlo, sobre todo, si no hablamos de células germinales
Hay que seĖalar que esta vertiente de investigación fue movilizada por la publicación de Anway en el 2005 cuyo trabajo está siendo ampliamente citado (45).
Estos autores comienzan por plantear que los efectos transgeneracionales de toxinas ambientales solamente pueden producirse por una alteración cromosómica o epigenética en la línea germinal.
En su trabajo eligen dar vinclozolin (un antiandrógeno, ya que se fija a los receptores de andrógenos) o methoxychlor (un compuesto estrogénico que se fija a los receptores de estrógenos). El vinclorozolin es un fungicida usado en la industria del vino y el methoxychlor es un pesticida como el DDT. Eligen para el experimento el periodo en que, en la rata, se produce la diferenciación sexual, que es en los fetos rata de 12 a 15 días de gestación, lo que en humano seria a mitad de su gestación.
En dicha etapa inyectan, por vía intraperitoneal, a madres gestantes de camadas distintas, uno de los dos compuestos. Actuando, en ambos casos, sobre embriones de 8 días de gestación y continuando hasta embriones de 15 días. De los dos compuestos inyectan 200 mg por kg de peso y día.
Hay que recordar que la diferenciación sexual se produce en los machos mamíferos por la diferenciación de los testículos, cuyo acontecimiento más evidente es la diferenciación de las células de Sertoli. Es, además, ese un momento en que existen en el embrión cantidades enormes de receptores de andrógenos (AR) y de estrógenos (ER beta). Hay que recordar, también, que dicha diferenciación sexual, en los mamíferos, se produce en los machos ya que, a pesar de su dotación genética de XY, se diferenciarían como hembras, en vertiente neuroendocrina y de conducta, si en un determinado momento, específico para cada especie, no surgieran los testículos y la secreción enormemente alta de testosterona fetal (46).
Estos autores dejan crecer a las crías hasta periodo adulto y en ambas camadas, las inyectadas con vinclozolin y las inyectadas con methoxychlor, encuentran en los machos una gran infertilidad con disminución del número de los espermatozoides y también su movilidad, además, de alteraciones histológicas en los testículos. Todo ello en un porcentaje del 90% de la población de crías machos analizadas. En periodo adulto cruzan estos machos, más bien el 20% de ellos que parecen normales sus testículos, con hembras normales. Y encuentran hasta la cuarta generación que sus crías machos presentan las mismas anormalidades y en igual proporción.
Estudian las pautas de metilación del ADN en células de los testículos de estos animales adultos y las encuentran anórmalmente metiladas con respecto a machos de la misma edad cuya madre no fue tratada en periodo gestante. Y hallan una correlación positiva entre su infertilidad y las pautas de metilación de ADN en células testiculares. Comprobando que todo ello encierra a nivel genético un mecanismo epigenético. Es interesante consignar que las crías hembra de madres tratadas parecen, en principio, no presentar alteraciones, aunque fueron menos estudiadas.
Es un trabajo muy riguroso y que sigue siendo, como hemos dicho, enormemente citado. Estos autores dicen literalmente al final de su trabajo: la habilidad de un factor ambiental (por ejemplo un disrupto endocrino, como ellos llaman a esas drogas)para reprogramar la línea germinal y para promover un estado patológico tiene implicaciones para la biología evolucionista y para la etiología de enfermedades. Y así es, evidentemente.
Su trabajo muestra que los procesos epigenéticos en momentos claves del desarrollo, por irrupción de factores ambientales externos y que alteran la aparición o la secuencia normal de acontecimientos, son transmitidos a las nuevas generaciones. Dada la importancia de estas cuestiones se está trabajando intensamente en esta vertiente
A partir del 2010 se están publicando muchos trabajos, sobre todo de transmisión generacional por vía paterna, mostrando que situaciones psicopatológicas sufridas por crías macho en su periodo de desarrollo parecen provocar metilaciones de ADN en determinados genes, algunos de ellos a nivel cerebral (47) y ya en 2007 (48) se encuentran trabajos interesantes con respecto a la transmisión intergeneracional por agentes químicos que son llamados en lenguaje anglosajón endocrine –disrupting chemicals (químicos- disruptores- endocrinos) del tipo de los utilizados por Anway(45). Pero en todos estos trabajos la trasmisión es por vía paterna y cuando el factor ambiental, psicológico o químico, ha irrumpido en periodos de desarrollo.
Es mucho más difícil encontrar trabajos rigurosos actualmente de trasmisión por vía materna; sin embargo, en 2010 hay que citar un trabajo de Matthews (49), por el esquema que incluye de transmisión de un axis HPA anómalo por vía maternal, aunque para aceptar su hipótesis de trasmisión por vía materna habrá que esperar a más y más rigurosas y abundantes investigaciones (figura 13) (49).
Es evidente y ampliamente aceptado por el mundo científico que las alteraciones epigenéticas cuando se producen en momentos de desarrollo parecen trasmitirse a través de generaciones, aunque en este momento falta profundizar en esta vertiente.
Está totalmente establecido y ampliamente aceptado en el mundo científico que los mecanismos epigenéticos modulas y alteran la expresión genética por supuesto en periodos de desarrollo pero parece que también en células postmitóticas, en tejidos envejecidos se han encontrado enzimas como la histona deacilasa pero aún existe cierta controversia sobre otras enzimas de la maquinaria epigenética.

Figura 13.- Posible trangsgeneracional programación del axis HPA. Se intenta mostrar cómo por vía materna se podría hacer un paso transgeneracional de las modificaciones epigenéticas que provocan la programación anómala del axis HPA. En la parte izquierda se seĖala que un mal ambiente fetal por estrés maternal, por darle glucocorticoides a la madre gestante o por su malnutrición producen cambios epigenéticos, descritos a lo largo de este texto, que conforman mal su axis HPA. Y esas modificaciones epigenéticas aparecerán en las crías de la primera generación en machos y hembras, como se ha expuesto, y su axis se programará de forma anómala, todos estos sucesos están englobados en la figura en el amplio recuadro llamado “Transgeneracional transmisión”. Pero en la segunda generación las crías hembras, cuando vayan a ser madres, lo harán con un axis programado en la primera generación de forma anómala, entonces, ante cualquier situación de emergencia, su axis HPA responderá desmedidamente y de nuevo sus crías sufrirán “trans generacional trasmisión” por el gran número de glucocorticoides que pasaran de la madre al feto y así sucesivamente a través de generaciones. Pero en el momento actual faltan número y rigor, en las pocas publicaciones sobre este tema que hay, para poder sustentar y defender dicha hipótesis por vía materna. Gráfica reformada de cita (49).
Es evidente el gran aporte de conocimiento realizado, prácticamente todo en el siglo XXI, sobre la maquinaria epigenética pero antes de concretar y enunciar conclusiones quiero seĖalar que en su magnífico libro Genética del Profesor. Lacadena (50) afirma que existe una genética anterior al descubrimiento del ADN y otra posterior a él, y en el momento actual parece que estamos asistiendo a un nuevo cambio de paradigma.
También para hacer justicia a la creatividad de la mente humana hemos confeccionado el esquema 5 desde el siglo XVIII al siglo XXI. El médico francés Jean-Baptiste Lamarck nacido en 1744 concibió y habló ya de la evolución de las especies, sin más tecnología que su cerebro y su observación. Decía, simplificando mucho, que las adaptaciones adquiridas, propiciadas por el ambiente con fines de supervivencia, se mantendrían a través de las generaciones y así se produciría la evolución. Probablemente sus escritos los conocería Charles Darwin (1809). Las teorías de Lamarck han sido muy rebatidas e incomprendidas más aún que las de Darwin. Han tenido que pasar casi dos siglos para que nuevas mentes humanas hayan encontrado los mecanismos epigenéticos con los cuales podrían los organismos evolucionar. Pero también en historia de la ciencia reciente hay que recordar con humildad, que es lo que la Ciencia enseĖa, que en 1957 Waddington que había sido el primero que definió la epigenesis, lanzó su The Waddingtonęs epigenic landscape (El paisaje epigenético de Waddington) (51) cuyo postulado se ha mantenido en la ciencia por muchos aĖos y que niega la posibilidad de reprogramación y transdiferenciación celular. Pero el aĖo 2006, S. Yamanaka publicó su trabajo en el cual con sus cuatro factores de transcripción llamados factores de Yamanaka consigue reprogramar fibroblastos embrionarios y adultos a células madre pluripotentes o células iPS (induces pluripotent stem cells), que echa por tierra la teoría de Waddington y establece la reprogramación celular y por lo cual Yamanaka recibió en 2012 el Premio Nobel de Fisiología. Actualmente, podemos decir, que hemos entrado en la posibilidad de transdiferenciación celular.
DESDE EL SIGLO XVIII AL SIGLO XXI
- Jean-Baptiste Lamarck (1744)
- Charles Darwin (1809)
-Waddington 1957 «The Waddington ęs epigenetic landscape»
-S. Yamanaka (2006) Premio Nobel de Fisiología y Medicina 2012
Esquema 5.
8. CONCLUSIONES
1. En el momento actual parece establecido el gran dinamismo que existe en la expresión genética a través de procesos químicos y, la gran aplicabilidad terapéutica, si se consigue revertirlos, que pueden tener estos descubrimientos en el futuro; en cáncer, enfermedades autoinmunes o neuropatologías.
2. Las modificaciones cromáticas, de cuyo conocimiento estamos al comienzo, son, sin duda, una interfase entre las variaciones ambientales y el genoma, en un proceso, por medios químicos, de adaptación dinámica. Todo ello podría abrir, en el futuro, enormes expectativas en vertiente evolucionista.
3. La neuroepigénesis está en sus comienzos pero puede tener gran aplicabilidad terapéutica en patologías neurodegenerativas como el Alzheimer.
9. referencias
