ARTęCULO |
Estudio de la actividad neuroprotectora de diterpenos aislados del gŽnero Sideritis
Elena M» Gonz‡lez Burgos, M» Emilia Carretero Accame, M» Pilar G—mez-Serranillos Cuadrado*
Departamento de Farmacolog’a, Facultad de Farmacia, Universidad Complutense de Madrid, Ciudad Universitaria 28040– Madrid, Espa–a
*e-mail: egonzalezburgos@hotmail.com
An. Real Acad. Farm. Vol. 80, NĽ 2 (2014), pag. 362-376.
Resumen de la Tesis Doctoral premiada con el premio ŇAntonio Doadrio L—pezÓ en el Concurso Cient’fico 2013 de la Real Academia Nacional de Farmacia.
resumen
El estrŽs oxidativo, definido como un desequilibrio entre la producci—n de especies reactivas de ox’geno (ROS) y la capacidad del sistema defensivo del organismo (enzim‡tico y no enzim‡tico) para hacer frente a las mismas, est‡ implicado en la fisiopatolog’a de varias enfermedades neurodegenerativas incluidas la enfermedad de Alzheimer, la enfermedad de Parkinson, la enfermedad de Huntington y la Esclerosis Lateral Amiotr—fica. En este contexto, la bśsqueda de compuestos antioxidantes que permitan disminuir o neutralizar el da–o oxidativo constituye un importante campo de investigaci—n. En este trabajo de Tesis Doctoral se ha evaluado la actividad neuroprotectora frente a estrŽs oxidativo de los diterpenos andalusol, conchitriol, foliol, lagascatriol, linearol y sidol aislados de especies del gŽnero Sideritis. |
Palabras clave: diterpenos; Sideritis; neuroprotecci—n.
abstract
Oxidative stress, defined as a disturbance in the equilibrium between reactive oxygen species (ROS) production and the capacity of the defense system of the organism (enzymatic and non-enzymatic) to protect against them, is involved in the physiopathology of several neurodegenerative diseases including Alzheimer's disease, Parkinson's disease, Huntington's disease and Amyotrophic Lateral Sclerosis. In this context, the search of antioxidant compounds is an interesting research field. In this Doctoral Thesis, it has been evaluated the neuroprotective activity against oxidative stress of the diterpenes andalusol, conchitriol, foliol, lagascatriol, linearol and sidol isolated from Sideritis spp. |
Keywords: diterpenes; Sideritis; neuroprotection.
1. INTRODUCci—N
Las enfermedades neurodegenerativas como la enfermedad de Alzheimer, la enfermedad de Parkinson, la Esclerosis Lateral Amiotr—fica y la enfermedad de Huntington son procesos cr—nicos caracterizados por la pŽrdida progresiva de las neuronas y la consiguiente alteraci—n de las funciones motora, sensorial y cognitiva. Estas enfermedades constituyen un problema de salud pśblica a nivel mundial, que crece d’a a d’a debido al vertiginoso envejecimiento de la poblaci—n. La investigaci—n b‡sica y cl’nica aśna esfuerzos para conocer mejor la fisiopatolog’a de estas enfermedades as’ como para desarrollar nuevas estrategias terapŽuticas tanto para paliar como para frenar la progresi—n de las mismas (1, 2).
Durante las śltimas dŽcadas, numerosos estudios experimentales in vitro e in vivo, as’ como estudios post mortem en tejidos cerebrales humanos, apoyan la implicaci—n del estrŽs oxidativo en la patogenia de diversas enfermedades neurodegenerativas, incluidas las anteriormente mencionadas (3, 4). El estrŽs oxidativo, definido como una alteraci—n de la homeostasis —xido-reducci—n intracelular consecuencia de una excesiva producci—n de ROS y/o de una deficiencia en los mecanismos antioxidantes end—genos de tipo enzim‡tico y/o no enzim‡tico, puede conllevar un da–o celular irreversible e irreparable por mecanismos como son la peroxidaci—n lip’dica en las membranas celulares, la modificaci—n de las bases de los ‡cidos nucleicos, la inactivaci—n de las enzimas y la oxidaci—n de las prote’nas; incluso conducir a la muerte celular, principalmente por apoptosis (5, 6).
El uso de antioxidantes ex—genos se presenta como una de las estrategias terapŽuticas m‡s prometedoras para disminuir o neutralizar el da–o oxidativo ocasionado por las especies reactivas de ox’geno (ROS) (7). Los mecanismos de acci—n descritos que definen la capacidad antioxidante de un compuesto son diversos: a) interacci—n directa con especies reactivas o actividad "scavenger" de radicales libres, v’a "transferencia de un solo electr—n" (SET) o v’a "transferencia de un ‡tomo de hidr—geno" (HAT), b) quelaci—n de metales de transici—n (hierro, cobre) que pueden iniciar reacciones de oxidaci—n, c) inducci—n o activaci—n de las enzimas antioxidantes (catalasa, super—xido dismutasa, glutation peroxidasa, glutation reductasa, hemooxigenasa-1, entre otras), lo que se traduce en un mayor equilibrio redox celular y d) inhibici—n de la actividad, expresi—n o s’ntesis de enzimas prooxidantes como NADPH-oxidasa, mieloperoxidasa, —xido n’trico sintasa y xantina-oxidasa, implicadas en la generaci—n de especies reactivas (8). En este contexto, los productos naturales constituyen una fuente inagotable de principios activos con potencial antioxidante. De hecho, recientes investigaciones han demostrado la capacidad antioxidante de diversos compuestos de origen natural, siendo entre ellos relevantes el grupo de los diterpenos (9).
El gŽnero Sideritis, perteneciente a la familia de las Lamiaceae, comprende aproximadamente 150 especies distribuidas por la vertiente mediterr‡nea europea, africana y parte de la asi‡tica, extendiŽndose desde las islas Canarias y Madeira hasta el C‡ucaso (10). Distintas especies de Sideritis se han usado tradicionalmente para preparar infusiones, como agentes saborizantes as’ como con fines terapŽuticos por sus propiedades antiinflamatorias, antioxidantes, antiulcerosas, digestivas, antimicrobianas, vulnerarias, analgŽsicas y carminativas (11). M‡s de 160 diterpenos, incluidos en al menos 9 grupos de estructuras diferentes, han sido identificados y aislados de las partes aŽreas de Sideritis spp. (12). Los compuestos sideridiol y siderol fueron los primeros diterpenos aislados y su estructura se elucid— durante la segunda mitad del siglo XX (13, 14).
Este trabajo de Tesis Doctoral se ha planteado como el estudio de la actividad neuroprotectora, frente al estrŽs oxidativo, de los diterpenos andalusol, conchitriol, lagascatriol, foliol, linearol y sidol aislados de especies del gŽnero Sideritis y su posible aplicaci—n en aquellos procesos neurodegenerativos que cursen con da–o celular.
2. material y mŽtodos
2.1. Diterpenos
El diterpeno de tipo labdanoandalusol se aisl— de la especie Sideritis arborescens Salzm. (15). Tanto el diterpeno de tipo beyerano, conchitriol, como el de tipo rosano, lagascatriol, se aislaron de Sideritis angustifolia Lag. (16-18). Los diterpenos derivados del kaurano, foliol, linearol y sidol se obtuvieron de Sideritis linearifolia Lam. (18).
2.2. L’neas celulares
2.2.1. L’neas celulares utilizadas en los estudios de estrŽs oxidativo y disfunci—n mitocondrial. Tratamiento celular.
L’nea celular PC12 (Neuronas)
La l’nea celular PC12 se adquiri— de la colecci—n de cepas American Type Culture Collection (ATCC). El medio de cultivo utilizado es DulbeccoŐs Modified EagleŐs Medium (DMEM) (Gibco, Invitrogen Corporation) suplementado con 0,5% de gentamicina (Gibco, Invitrogen Corporation) y 0,2% de piruvato (Sigma-Aldrich). Las cŽlulas se mantienen a 37ĽC en atm—sfera de aire al 95% y de CO2 al 5%.
L’nea celular U373-MG (Astrocitos)
La l’nea celular U373-MG se adquiri— desde Sigma-Aldrich procedente de la Colecci—n Europea de Cultivos Celulares Animales (ECACC). El medio de cultivo empleado es DulbeccoŐsModifiedEagleŐs Medium (DMEM) (Gibco, Invitrogen Corporation) suplementado con 0,5% de gentamicina (Gibco, Invitrogen Corporation) y suero fetal bovino (FBS) (Gibco, Invitrogen Corporation).Las cŽlulas se mantienen en condiciones de temperatura y atm—sfera hśmeda de 37ĽC, 95% de aire y 5% de CO2.
Tratamiento celular
Las cŽlulas U373-MG y PC12 se tratan con los diterpenos objeto de estudio (diferentes concentraciones segśn el propio desarrollo de la Tesis) durante 24 h, y posteriormente con H2O2 (1 mM para las cŽlulas U373-MG y 0,1 mM para las cŽlulas PC12) durante 30 minutos.
2.2.2. L’neas celulares utilizadas en los estudios de paso a travŽs de Barrera Hemato Encef‡lica (BHE)
L’nea celular RBE4
Las cŽlulas RBE4 fueron cedidas por el Dr. Pierre Olivier Couraud del Instituto Cochin del Instituto Nacional de la Salud y de la Investigaci—n MŽdica (INSERM) de Par’s (Francia).Las cŽlulas RBE4 crecen en frascos de cultivo tapizados durante al menos 3 horas con 3 mL de una soluci—n de col‡geno obtenida a partir del tend—n de cola de rata. Las cŽlulas se mantienen en una atm—sfera de 95% de aire y 5% de CO2, saturada de humedad a 37ĽC. El medio de cultivo empleado es Hams F-10/α-Minimum Essential Medium (α-MEM) (1:1) (Gibco, Invitrogen Corporation), suplementado con Glutamax (Sigma-Aldrich), 10% de suero fetal de ternero (Gibco, Invitrogen Corporation), geneticina (300 μg/mL) (Sigma-Aldrich) y factor b‡sico de crecimiento de fibroblastos (bFGF, 1 ng/mL) (Boehringer).
L’nea celular ECV304/C6
La l’nea celular ECV304 corresponde a cŽlulas endoteliales de cord—n umbilical humano. Esta l’nea celular se obtuvo de la Colecci—n Europea de Cultivos Celulares Animales (ECACC).
La l’nea celular C6, procedente de cŽlulas de glioma de rata, se adquiri— de la Colecci—n Europea de Cultivos Celulares Animales (ECACC).
En este trabajo, se emplearon sistemas de cocultivos entre las l’neas celulares ECV304 y C6.Estas cŽlulas crecen en medio M199 (Sigma) suplementado con Glutamax (Sigma-Aldrich), 10% de suero fetal de ternero (Gibco, Invitrogen Corporation) y penicilina/estreptomicina (100 U/mL; 100 μg/mL) (Gibco, Invitrogen Corporation). Las cŽlulas se mantienen en atm—sfera hśmeda de 5% CO2/95% aire a 37ĽC.
2.3. MŽtodos para el estudio de estrŽs oxidativo y disfunci—n mitocondrial
En el presente resumen de Tesis Doctoral se muestra una peque–a parte de los mŽtodos empleados en el estudio de estrŽs oxidativo y disfunci—n mitocondrial.
- Medida de la generaci—n intracelular de radicales libres: TŽcnica de diclorofluoresce’na (DCFH-DA) (19). Tras los tratamientos, se a–aden 200 μL/pocillo de una mezcla de una soluci—n de 0,01 mM DCFH-DA con PBS glucosado (180 mg glucosa/100 mL PBS estŽril) y se mantiene la placa en incubaci—n durante 30 minutos a 37ĽC. DespuŽs de este tiempo, las cŽlulas se lavan con 200 μL/pocillo de PBS glucosado y se procede a la lectura utilizando un Fluor’metro Lector de microplacas FLx800, BioTek, Instruments, Inc., en las condiciones de lectura de excitaci—n 480 nm y de emisi—n 510 nm.
- Determinaci—n de la peroxidaci—n lip’dica (20). Para la cuantificaci—n de la peroxidaci—n lip’dica se miden los niveles de MDA presentes en cada muestra mediante cromatograf’a l’quida de alta eficacia (HPLC), siguiendo un protocolo modificado de Grotto et al. (2007).
- Determinaci—n de la actividad y expresi—n de enzimas antioxidantes. Las enzimas estudiadas han sido aquellas implicadas en los principales procesos de detoxificaci—n de ROS: catalasa (21), super—xido dismutasa (22), glutati—n reductasa (23) y glutati—n peroxidasa (24). Se ha determinado tanto la actividad por tŽcnicas espectofotomŽtricas as’ como la expresi—n proteica de cada una de ellas mediante Western blot.
- Determinaci—n de los niveles de calcio mitocondrial. La concentraci—n de calcio mitocondrial se determina midiendo la fluorescencia de Rhod-2.DespuŽs de los tratamientos, las cŽlulas se lavan con medio de Krebs con calcio y sin sonda fluorescente, y a continuaci—n se incuban durante 40 minutos a 37ĽC en oscuridad con medio de Krebs con calcio y con la sonda fluorescente. DespuŽs de la incubaci—n, las cŽlulas se lavan 2 veces con medio de Krebs sin calcio y sin sonda fluorescente y se dejan incubar durante 30 minutos a la misma temperatura para permitir la hidr—lisis completa del Žster. La fluorescencia se mide a 37ĽC durante 5 minutos a una λexcitaci—n de 552 nm y a una λemisi—n de 581 nm a 37ĽC en un fluor’metro Spectramax Gemini EM (Molecular Devices). A continuaci—n, se adiciona el ion—foro A23187 (5 μM) y se mide la fluorescencia durante 15 minutos en las mismas condiciones descritas anteriormente (25).
2.4. MŽtodos para el estudio de paso a travŽs de BHE
- Estudios de permeabilidad. El experimento de transporte se inicia con la adici—n de los diterpenos en un volumen de 0,5 mL en el compartimento apical (para el transporte apical a basal) y en un volumen de 1,5 mL en el compartimento basal (para el transporte basal a apical). Las placas se incuban a 37ĽC en agitaci—n durante 6 h. Una vez finalizado el transporte, se toman al’cuotas de los lados apical y basal, para su posterior an‡lisis y cuantificaci—n por HPLC (26).
3. resultados y discusi—n
En el presente trabajo de Tesis, se ha evaluado la actividad neuroprotectora de seis diterpenos andalusol, conchitriol, lagascatriol, foliol, linearol y sidol aislados del gŽnero Sideritis frente al estrŽs oxidativo inducido por exposici—n a H2O2 en los modelos celulares PC12 (modelo neuronal) y U373-MG (modelo de astrocitoma).
Para llevarlo a cabo hemos establecido, en primer lugar, las condiciones de da–o oxidativo para pasar posteriormente a determinar si las molŽculas en estudio protegen frente al mismo. En el estudio sobre protecci—n celular se ha evaluado el efecto sobre la viabilidad celular, los cambios sobre la morfolog’a celular, el nivel de ROS intracelular, los cambios sobre los marcadores de estrŽs oxidativo (peroxidaci—n lip’dica y ratio GSH/GSSG) y sobre la actividad y expresi—n de las prote’nas de las principales enzimas antioxidantes implicadas en el sistema de defensa. El efecto de los diterpenos sobre diferentes marcadores de disfunci—n mitocondrial como son los niveles de calcio citos—lico y mitocondrial, el potencial de membrana mitocondrial y los niveles de ATP tambiŽn han sido evaluados. Los posibles mecanismos implicados en la protecci—n de los diterpenos en estudio frente al da–o celular inducido por H2O2 han sido asimismo elucidados. Finalmente, se ha realizado el estudio y posible mecanismo de paso de los diterpenos a travŽs de la BHE.
En el presente resumen de Tesis Doctoral se muestra s—lo una peque–a parte de los resultados obtenidos.
El H2O2 ha sido la molŽcula utilizada como agente generador de estrŽs oxidativo. La formaci—n de elevadas concentraciones de H2O2 se ha descrito en las fibrillas de amiloide formadas por la prote’na beta-amiloide en la enfermedad de Alzheimer y, por la prote’na alfa-sinucle’na en la enfermedad de Parkinson, implic‡ndose a esta especie reactiva de ox’geno como posible mecanismo causal en la muerte celular que ocurre en ambas enfermedades neurodegenerativas (27, 28).Teniendo en cuenta que el principal mecanismo de da–o celular inducido por H2O2 implica la v’a del estrŽs oxidativo (29), procedimos a estudiar el efecto de la exposici—n a H2O2 sobre el nivel de ROS intracelular mediante el ensayo de la diclorofluoresce’na.
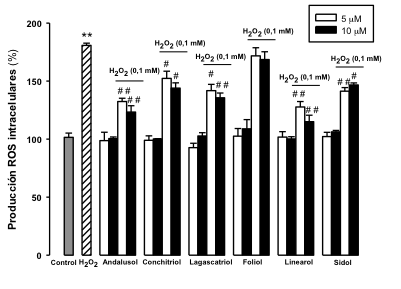
Como se muestra en la Figura 1, los niveles intracelulares de ROS se ven aumentados de manera significativa en comparaci—n con las cŽlulas control, lo que confirma que el H2O2, en las condiciones experimentales establecidas, es un inductor de estrŽs oxidativo. El pretratamiento de las cŽlulas PC12 y U373-MG con los diterpenos ocasiona una inhibici—n de la producci—n de ROS intracelular, de manera significativa para andalusol, lagascatriol, linearol y sidol en los astrocitos y adem‡s para conchitriol, en las neuronas a las concentraciones de 5 y 10 μM.
A)
B)
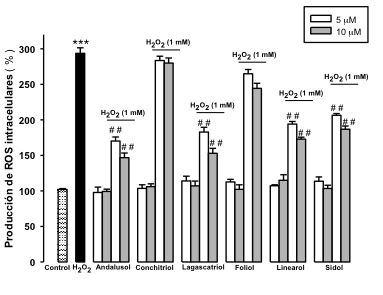
Figura 1.- Efecto sobre la producci—n de ROS intracelular. A) CŽlulas PC12. B) CŽlulas U373-MG. Los resultados se expresan como % de producci—n de ROS intracelulares respecto al control. Los resultados se expresan como media ± Desviaci—n Est‡ndar (n=9) de tres experimentos independientes. ** p < 0,01 versus control; # p < 0,05 y ## p < 0,01 versus H2O2
Una vez demostrada la capacidad de inducci—n de ROS por H2O2, se ha evaluado el efecto protector sobre los l’pidos, componentes fundamentales de las membranas y una, y quiz‡s la primera, diana biol—gica de los radicales libres. El da–o en la membrana se ha determinado midiendo los niveles del producto final de la peroxidaci—n lip’dica malonildialdehido (MDA), ampliamente utilizado como biomarcador de estrŽs oxidativo en varias enfermedades neurodegenerativas (30, 31). Los resultados de este estudio (Figura 2) indican que la exposici—n a H2O2 en cŽlulas PC12 y U373-MG produce una peroxidaci—n lip’dica significativa comparado con las cŽlulas control. El pretratamiento celular con los diterpenos objeto de estudio, en concreto andalusol y linearol (en cŽlulas PC12) y, andalusol y lagascatriol (en cŽlulas U373-MG) protege frente a la peroxidaci—n de l’pidos de membrana inducida por H2O2, lo que por un lado confirma que estos compuestos son capaces de inhibir el da–o oxidativo inducido por especies reactivas como ROS y por otro lado, se demuestra la capacidad de estos compuestos para interaccionar y penetrar las bicapas lip’dicas, lo que le confiere valor a–adido a su actividad protectora.

Figura 2.- Efecto sobre la peroxidaci—n lip’dica. El grado de peroxidaci—n lip’dica se cuantifica midiendo los niveles de MDA en los extractos celulares totales por HPLC. Los resultados se expresan como nmoles/mg prote’na. Los resultados se expresan como media ± Desviaci—n Est‡ndar de tres experimentos independientes. * p < 0,05 y ** p< 0,01 versus control; #p< 0,05 y ##p< 0,01 versus H2O2.
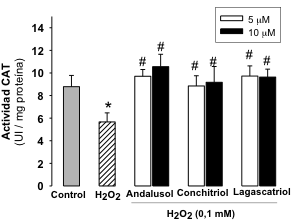
La activaci—n de las enzimas antioxidantes es otro de los mecanismos que explica la acci—n de los compuestos antioxidantes. Cambios en los patrones enzim‡ticos de catalasa (CAT), super—xido dismutasa (SOD), glutation peroxidada (GPx), glutation reductasa (GR) y hemooxigenasa-1 (HO-1), entre otras, se traducen en variaciones del balance redox celular, constituyendo, por tanto, un biomarcador esencial del estrŽs oxidativo (32, 33). As’, con objeto de profundizar en el/los mecanismos de acci—n de los diterpenos del presente trabajo, procedimos a estudiar el papel de estos compuestos en la actividad y expresi—n de las enzimas antioxidantes, mediante tŽcnicas espectrofotomŽtricas y de Western-blot, respectivamente. En nuestro trabajo, el tratamiento de las cŽlulas con H2O2 produce una significativa disminuci—n tanto en la actividad como en la expresi—n de las enzimas anteriormente mencionadas. El pretratamiento celular con los diterpenos de Sideritis produce un aumento de la actividad y de la expresi—n de las enzimas antioxidantes end—genas evaluadas (excepto foliol en cŽlulas PC12 y conchitriol y foliol en cŽlulas U373-MG), comparado con las cŽlulas expuestas a H2O2 como śnico tratamiento. En la Figura 3, se muestra como ejemplo la actividad y la expresi—n para la enzima catalasa y los compuestos andalusol, conchitriol y lagascatriol.
Modelos in vitro e in vivo han demostrado de forma evidente una asociaci—n entre estrŽs oxidativo y disfunci—n mitocondrial. El aumento de los niveles de calcio mitocondrial puede llevar a un desacoplamiento de la funci—n de la fosforilaci—n oxidativa, y la consecuente disfunci—n mitocondrial. En la Figura 4, se muestra que ninguno de los diterpenos, a las concentraciones y tiempo de tratamiento ensayados, aumentan la concentraci—n de calcio mitocondrial. Por otro lado, el H2O2 produce una significativa acumulaci—n de calcio en la mitocondria. Cuando las cŽlulas se tratan durante 24 h con los diterpenos objeto de estudio, previo a la exposici—n a H2O2, se observa una disminuci—n en los niveles de calcio mitocondrial; concretamente, este efecto es significativamente marcado para linearol, andalusol (5 y 10 µM) y conchitriol (10 µM) en cŽlulas PC12 y andalusol, lagascatriol y linearol (5 y 10 µM) y sidol (5 µM) en cŽlulas U373-MG.
Una vez demostrado el potencial neuroprotector de los diterpenos en estudio, procedimos a evaluar si estos compuestos son capaces de atravesar la BHE. El estudio de permeabilidad (Tabla 1) revela que los valores de permeabilidad aparente de todos los diterpenos son menores que los del compuesto de referencia positivo, propranolol, y mayores que los del compuesto de referencia negativo, atenolol. Estudios previos han establecido que valores de permeabilidad (Papp) mayores de 3 x 10-6 cm/s indican que los compuestos pueden penetrar eficientemente la BHE (34). Por tanto, el valor de Papp de los diferentes diterpenos sugiere que Žstos pueden atravesar la BHE v’a transcelular por mecanismos de difusi—n pasiva. Andalusol y lagascatriol presentan los valores m‡s altos de Papp, linearol y sidol tienen valores moderados y foliol y conchitriol, los m‡s bajos.
A)
10 |
(mM) |
5 |
Control |
H2O2 |
5 |
Andalusol |
Conchitriol |
Lagascatriol |
H2O2 |
5 |
10 |
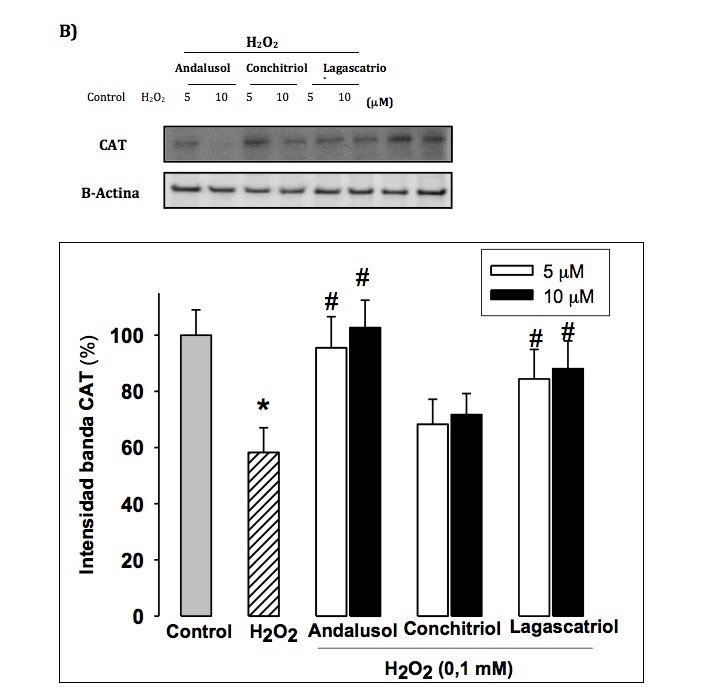
Figura 3.- Efecto en la actividad y expresi—n de la enzima CAT en cŽlulas PC12. A) La actividad de la enzima CAT se cuantifica por mŽtodos espectrofotomŽtricos en extractos celulares totales. Los resultados de la actividad enzim‡tica se expresan como UI/mg prote’na. B) La expresi—n de prote’nas se determina mediante Western blot en extractos celulares totales. Los resultados de la expresi—n de prote’nas se expresan como % de intensidad de la banda, consider‡ndose como 100% las cŽlulas control. La §-actina se utiliza como normalizador de carga. Se muestra una membrana representativa de la expresi—n de CAT (n=3). Los resultados se expresan como media ± Desviaci—n Est‡ndar de tres experimentos independientes. * p < 0,05 y ** p< 0,01 versus control; #p< 0,05 y ##p< 0,01 versus H2O2.
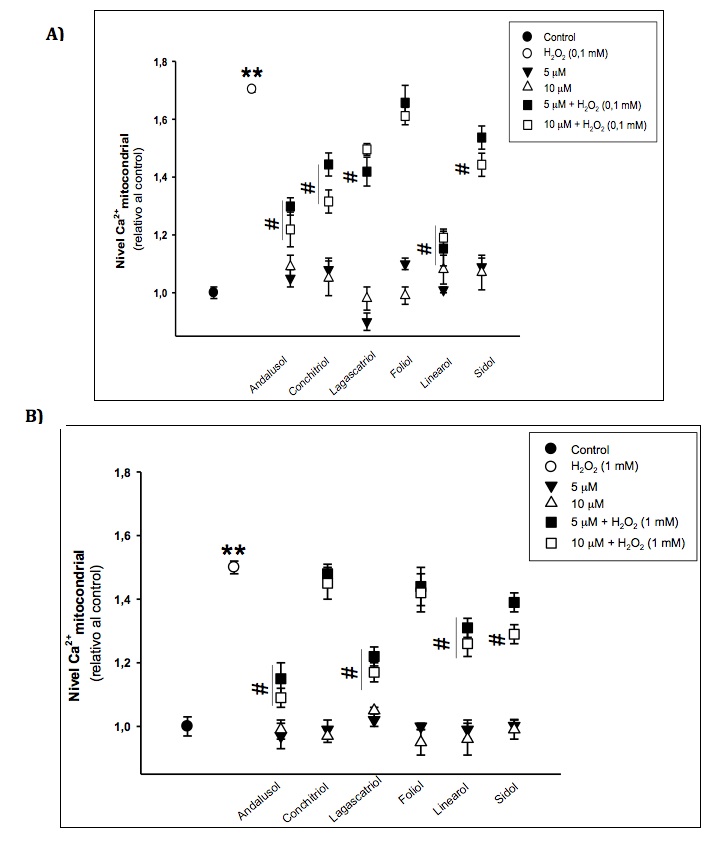
Figura 4.- Efecto sobre los niveles de calcio mitocondrial. Los cambios en los niveles de calcio mitocondrial se determinan por fluorescencia empleando el cati—n lipof’lico fluorescente Rhod-2. Los resultados se expresan como media ± Desviaci—n Est‡ndar (n=9) de tres experimentos independientes. * p < 0,05 y ** p< 0,01 versus control; #p< 0,05 y ##p< 0,01 versus H2O2.
Tabla 1.- Estudios de permeabilidad. El transporte de los diferentes diterpenos se ha evaluado durante 6 horas en las direcciones absortiva(A-B) y secretora (B-A). Los compuestos de referencia propranolol y atenolol se utilizan como control positivo y negativo, respectivamente. El ratio se determina como Papp(B-A)/Papp(A-B). El porcentaje de recuperaci—n se calcula como 100 – McŽlulas, siendo McŽlulas la cantidad de compuesto retenido en las membranas. ) [McŽlulas = MD0 – (MDt + ΣMR)] (ver material y mŽtodos 2.3.2.4.). Los datos se expresan como media ± Desviaci—n Est‡ndar.
Compuesto |
Papp(x 10-6 cm/s) |
Pappcorregido(x 10-6 cm/s) |
Ratio |
Ratiocorregido |
% Recuperaci—n |
||
A-B |
B-A |
A-B |
B-A |
||||
Andalusol |
9,1 ± 1,1 |
9,5 ± 2,8 |
11,4 ± 2,1 |
11,6 ± 2,6 |
0,9 |
1,0 |
78,8 ± 3,1 |
Conchitriol |
4,6 ± 0,9 |
4,8 ± 1,4 |
4,8 ± 1,1 |
4,9 ± 1,6 |
0,9 |
1,0 |
88,1 ± 2,2 |
Foliol |
3,8 ± 1,3 |
3,7 ± 1,9 |
4,0 ± 1,2 |
4,2 ± 1,5 |
0,9 |
0,9 |
90,5 ± 2,3 |
Lagascatriol |
8,8 ± 0,3 |
8,9 ± 0,5 |
10,7 ± 1,8 |
10,8 ± 1,5 |
1,0 |
1,0 |
81,5 ± 2,9 |
Linearol |
6,3 ± 0,5 |
6,6 ± 1,1 |
8,2 ± 1,1 |
8,3 ± 0,9 |
0,9 |
1,0 |
83,6 ± 3,3 |
Sidol |
6,9 ± 1,4 |
7, 2± 0,5 |
8,5 ± 1,7 |
8,6 ± 0,9 |
0,9 |
1,0 |
84,5 ± 2,8 |
Propranolol |
14,3 ± 1,1 |
14,8 ± 0,7 |
15,1 ± 1,3 |
15,6 ± 1,5 |
0,9 |
1,0 |
95,6 ± 1,9 |
Atenolol |
0,7 ± 0,4 |
0,8 ± 0,3 |
0,7 ± 0,6 |
0,8 ± 0,5 |
0,9 |
0,9 |
98,4 ± 2,1 |
4. Conclusiones
Los diterpenos estudiados ejercen un efecto neuroprotector frente al estrŽs oxidativo inducido por per—xido de hidr—geno, inhibiendo la producci—n de ROS, aumentando la actividad y la expresi—n de enzimas antioxidantes y atenuando los cambios derivados del estrŽs oxidativo a nivel mitocondrial.
De forma global, al comparar la eficiencia protectora de los 6 diterpenos de Sideritis spp. frente al estrŽs oxidativo inducido por H2O2, se observa un patr—n de actividad similar pero no idŽntico para todos estos compuestos en las dos l’neas celulares estudiadas. As’, en la l’nea celular PC12, los diterpenos andalusol y linearol han sido los m‡s activos, seguidos de sidol, lagascatriol y conchitriol, y por śltimo, el compuesto menos activo ha sido foliol. En los estudios realizados sobre la l’nea celular U373-MG, los diterpenos que han ejercido el mayor efecto citoprotector han sido andalusol y lagascatriol, seguidos de linearol y sidol, y por śltimo, de conchitriol y foliol.
5. agradecimientos
Este trabajo ha sido realizado en el Departamento de Farmacolog’a de la Facultad de Farmacia de la Universidad Complutense de Madrid gracias a una beca predoctoral de Formaci—n de Profesorado Universitario (FPU) del Ministerio de Ciencia e Innovaci—n.
6. referencias
1. Ehrnhoefer, D.E.; Wong, B.K.; Hayden, M.R. Convergent pathogenic pathways in Alzheimer's and Huntington's diseases: shared targets for drug development. NatureReviewsDrug Discovery10, 853-867 (2011).
2. Katsuno, M., Tanaka, F., Sobue, G. Perspectives on molecular targeted therapies and clinical trials for neurodegenerative diseases. Journal of Neurology, Neurosurgery, and Psychiatry83, 329-335 (2012).
3. Barnham, K.J., Masters, C.L., Bush A.I. Neurodegenerative diseases and oxidative stress Nature Reviews Drug Discovery3, 205–214 (2004).
4. Hayashi, M., Miyata, R., Tanuma, N. Oxidative stress in developmental brain disorders.Advances in Experimental Medicine and Biology724, 278-290 (2012).
5. Valko, M., Morris, H., Cronin, M.T. Metals, toxicity and oxidative stress. Current Medicinal Chemistry12, 1161–1208 (2005).
6. Avery, S.V. Molecular targets of oxidative stress. Biochemical Journal434, 201–210 (2011).
7. Floyd, R.A. Antioxidants, oxidative stress, and degenerative neurological disorders. Proceedings of the Society for Experimental Biology and Medicine222, 236–245 (1999).
8. Ndhlala, A.R., Moyo, M., Van Staden, J. Natural antioxidants: fascinating or mythical biomolecules? Molecules 15, 6905-6930 (2010).
9. Gonz‡lez-Burgos, E., G—mez-Serranillos, M.P. Terpene compounds in nature: A review of their potential antioxidant activity. Current Medicinal Chemistry19, 5319-5341 (2012).
10. Loğoğlu, E., Arslan, S., …ktemer, A., Şakiyan, İ. Biological activities of some natural compounds from SideritissipyleaBoiss. Phytotherapy Research20, 294-297 (2006).
11. Gonz‡lez-Burgos, E., Carretero, M.E., G—mez-Serranillos, M.P. Sideritis spp.: Uses, chemical composition and pharmacological activities- A review. Journal ofEthnopharmacology135, 209-225 (2011).
12. Piozzi, F., Bruno, M., Rosselli, S., Maggio, A. The diterpenoids from the genus Sideritis. En: Atta-ur-Rahman (Ed) Studies in natural products chemistry 33, 493-540 (2006). Bioactive Natural Products. Elservier.
13. Venturella, P., Bellino, A. Constituents of Stachysitalica. Atti de llŐAccademiaNazionale di ScienzeArti Palermo IV 24, 95-99 (1965).
14. Piozzi, F., Venturella, P., Bellino, A., Mondelli, R. DiterpenesfromSideritissiculaUcria. Tetrahedron24, 4073-4081 (1968).
15. vonCarstenn-Lichterfelde, C., Valverde, S., Rodriguez, B. Studies on diterpenes from genus Sideritis. XIII two new stachene derivatives from Sideritisangustifolia (Labiatae). AustralianJournal of Chemistry27, 517–529 (1974).
16. Mart’n Panizo, F., Rodriguez, B., Valverde, S. Lagascatriol, a new diterpenoidfromSideritis angustifoliaLag. (Labiateae). Anales de Qu’mica 68, 1463-1465 (1972).
17. Mart’n Panizo, F., Rodr’guez, B., Valverde, S. Estructura total revisada del lagascatriol, nuevo diterpeno de ŇSideritis angustifoliaÓ Lag. Anales de Qu’mica 70, 164-171 (1974).
18. Garc’a de Quesada, T., Rodr’guez, B., Valverde, S. Six new diterpenesfromSideritisleucanthaCav. and Sideritislinearifolia Lam. TetrahedronLetter22, 2187-2190 (1972).
19. LeBel, C.P., Ischiropoulos H., Bondy S.C. Evaluation of the probe 2',7'-dichlorofluorescin as an indicator of reactive oxygen species formation and oxidative stress. Chemical Research in Toxicology5, 227-231 (1992).
20. Grotto, D., Santa Maria, L.D., Boeira, S., Valentini, J., Char‹o, M.F., Moro, A.M., Nascimiento, P.C., Pomblum, V.J., Garcia, S.C. Rapid quantification of malondialdehyde in plasma by high performance liquid chromatography-visible detetion. Journal of Pharmaceutical and Biomedical Analysis 43, 619-624 (2007).
21. Aebi, H. Catalasein vitro. Methods in Enzymology105, 121-125 (1984).
22. Marklund, S., Marklund, G. Involvement of the superoxide anion radical in the autoxidation of pyrogallol and a convenient assay for superoxide dismutase. European Journal of Biochemistry47, 469-474 (1974).
23. Barja de Quiroga, G., Perez-Campo, R. L—pez-Torres, M. Anti-oxidant defences and peroxidation in liver and brain of aged rats. Biochemical Journal 272, 247-250 (1990).
24. Paglia, D.E., Valentine, W.N. Studies on the quantitative and qualitative characterization of erythrocyte glutathione peroxidase. Journal of Laboratory and Clinical Medicine 70, 158- 169 (1967).
25. Deniaud, A., Sharaf el dein, O., Maillier, E., Poncet, D., Kroemer, G., Lemaire, C., Brenner, C. Endoplasmic reticulum stress induces calcium-dependent permeability transition, mitochondrial outer membrane permeabilization and apoptosis. Oncogene 27, 285–299 (2008).
26. G—mez-Serranillos, P., Carretero, E., Slowing, K., Palomino, O. M., Villarrubia, A. I., Villar, A. HPLC Quantitative analysis of diterpenoids in Sideritis (Labiatae) species. Phytotherapy Research. 72, S101-S103 (1998).
27. Tabner, B.J., Turnbull, S., El-Agnaf, O., Allsop, D. Production of reactive oxygen species from aggregating proteins implicated in Alzheimer's disease, Parkinson's disease and other neurodegenerative diseases. Current Topics in Medicinal Chemistry1, 507-517 (2001).
28. Tabner, B.J., Turnbull, S., El-Agnaf, O.M., Allsop, D. Formation of hydrogen peroxide and hydroxyl radicals from A(beta) and alpha-synuclein as a possible mechanism of cell death in Alzheimer's disease and Parkinson's disease. Free Radical Biology and Medicine. 32, 1076-1083 (2002).
29. Halliwell, B. Reactive oxygen species and the central nervous system. Journal of Neurochemistry 59, 1609-1623 (1992).
30. Reed, T.T. Lipid peroxidation and neurodegenerative disease. Free Radical Biology and Medicine 51, 1302-1319 (2011).
31. Hayashi, M., Miyata, R., Tanuma, N. Oxidative stress in developmental brain disorders. Advances in Experimental Medicine and Biology 724, 278-290 (2012).
32. Wang, J.Y., Wen, L.L., Huang, Y.N., Chen, Y.T., Ku, M.C. Dual effects of antioxidants in neurodegeneration: direct neuroprotection against oxidative stress and indirect protection via suppression of glia-mediated inflammation. Current Pharmaceutical Design 12, 3521-333 (2006).
33. Jazwa, A., Cuadrado, A. Targeting heme oxygenase-1 for neuroprotection and neuroinflammation in neurodegenerative diseases. Current Drug Targets 11, 1517-1531 (2010).
34. Madgula, V.L., Avula, B., Yu, Y.B., Wang, Y.H., Tchantchou, F., Fisher, S., Luo, Y., Khan, I.A., Khan, S.I. Intestinal and blood-brain barrier permeability of ginkgolides and bilobalide: in vitro and in vivo approaches. PlantaMedica76, 599-606 (2010).