REVISIÓN |
Perfiles de pacientes diabéticos que sufren reacciones adversas a medicamentos. Identificación y caracterización a través de minería de datos
María Isabel Jiménez Serranía1*, Ramona Mateos1
1Departamento de Medicina Preventiva y Salud Pública. Facultad de Farmacia. Universidad de Salamanca. Campus Miguel de Unamuno s/n.; 37007 Salamanca
*e-mail: mabel.j.serrania@gmail.com
An. Real Acad. Farm. Vol. 80, Nľ 2 (2014), pag. 274-321.
Premio CINFA del Concurso Científico 2013 de la Real Academia Nacional de Farmacia
resumen
El análisis estadístico tradicional de las notificaciones de reacciones adversas a medicamentos en pacientes diabéticos ha sido complejo y escaso. Las técnicas de minería de datos –modelo de red de enlaces, modelo de redes de Kohonen- permiten identificar perfiles de pacientes diabéticos tratados con fármacos que sufren reacciones adversas. Son perfiles característicos los trastornos del metabolismo graves no mortales por insulina glargina en mujeres en CataluĖa; y los trastornos gastrointestinales no graves por metformina en mujeres de 65-74 aĖos en Aragón. Los pacientes en tratamiento con tres o más agentes orales presentan mayor riesgo de sufrir una reacción adversa. |
Palabras clave: Reacción adversa a medicamento; diabetes; minería de datos.
abstract
Profiles of diabetic patients who suffer adverse drug reactions. Identification and characterization through data mining.
The traditional statistical analysis of notifications of adverse drug reactions in diabetic patients was complex and sparse. The data mining techniques –web graph and Kohonen networks model- allow us to identify drug-treated diabetic patients who suffer adverse reactions. Nonfatal severe metabolic disorders due to insulin glargine in women in Catalonia, and non-serious gastrointestinal metformin disorders in women between 65 and 74 years in Aragon are two characteristics profiles. Patients treated with three or more oral agents are at increased risk of suffering an adverse reaction. |
Keywords: Adverse drug reaction, diabetes, data mining.
1. aNTecedentes
Las fuentes de datos en farmacovigilancia se generan a partir de estudios específicos sobre una población expuesta, de las historias clínicas o de los sistemas estables de recogida de reacciones adversas (RAs). Estos últimos aglutinan mayor número de reacciones y son de gran utilidad para estudiar los problemas de seguridad de los medicamentos, siendo el Sistema de Notificación Espontánea de Reacciones Adversas a Medicamentos (RAM) el más extendido internacionalmente (1). Las sospechas de RAM son notificadas por los profesionales sanitarios a los Centros Regionales de Farmacovigilancia donde se codifican y evalúan (2).
A partir de las notificaciones espontáneas se generan alertas sobre una posible relación causal entre la administración de un fármaco y la aparición de un determinado acontecimiento adverso, normalmente desconocido o poco documentado (3). Estas alertas son el origen de las hipótesis sobre las que se pueden realizar estudios de farmacovigilancia tales como ensayos clínicos u otros estudios epidemiológicos específicos (2, 4).
A pesar de ello, los estudios sobre notificaciones espontáneas son escasos para algunos grupos de fármacos muy utilizados, como es el caso de los antidiabéticos (5). Sus efectos adversos conocidos aparecen recogidos en la literatura (ver Tabla 1), mientras que otros van apareciendo por nuevas inclusiones o combinaciones.
Existen características conocidas en el perfil de pacientes diabéticos tales como el grupo de edad más numeroso –entre 70 y 80 aĖos- (6), las proporciones de pacientes diabéticos mayores de 80 aĖos -24,2%- y de 40 o menos aĖos -3,5%- (7) o el porcentaje de mujeres diabéticas -52%- (6). A través de notificación espontánea, también se conocen detalles sobre los pacientes que sufren RAM, como que las mujeres presentan con frecuencia más RAM que los hombres (57% vs. 41%) (8), o que Galicia presenta el mayor número de notificaciones en 2005 y Cantabria en 2009 (9). En cambio, no se dispone de perfiles definidos de pacientes diabéticos que sufren RAM.
Para identificar estos perfiles a partir de los registros de sospechas de RAs, los métodos estadísticos tradicionales no son suficientes. Hay que recurrir a las técnicas de minería de datos (‘data mining’) para manejar de forma eficiente el volumen de información disponible en cada caso (10).
Tabla 1a.- Efectos adversos de los fármacos antidiabéticos presentes en la terapéutica 2000-2008.
EFECTOS ADVERSOS |
INS |
BI |
SU |
I-αG |
Alteraciones gastrointestinales (náuseas, vómitos, diarrea, dolor abdominal) |
- |
x diarrea dosis dependiente, acidez, sabor metálico, pérdida de apetito |
x |
x flatulencia dosis, dieta y tiempo dependientes; tolerancia |
Hipoglucemia |
Leve: todas Graves: inhalada>humana rápida>análogos rápida |
- |
glibenclamida, clorpropamida> glimepirida>gliclazida |
terapia combinada |
SNC |
…….-……. |
cefaleas |
x |
x |
Aumento de peso |
NPH > detemir |
…….-……. |
x |
…….-……. |
Hepatotoxicidad |
- |
- |
Alteración pruebas hepáticas |
x |
Alteraciones del sistema inmunológico |
- |
- |
Neumonitis |
Infecciones urinarias y respiratorias |
Alteraciones en el lugar de administración y reacciones cutáneas |
Lipohipertrofia localizada, lipoatrofia. Hipersensibilidad. Análogos lenta>humana lenta |
- |
Rash cutáneo, púrpura, prurito, dermatitis exfoliativa, eritema nodoso, fotosensibilidad. |
- |
Edema |
(insulínico) |
- |
…….-……. |
- |
Hemáticas |
- |
Anemia, reducción de absorción de ácido fólico y vit. B12 |
Anemia hemolítica, agranulocitosis, leucopenia, trombocitopenia |
- |
Cardiovasculares |
- |
- |
- |
- |
Musculo-esqueléticas |
- |
- |
- |
- |
Visuales |
- |
- |
- |
- |
Pancreatitis aguda |
- |
- |
- |
- |
Específicas de grupo |
I.inhalada: tos irritativa remitente, disminución progresiva de función pulmonar, riesgo de cáncer de pulmón en fumadores |
Acidosis láctica |
Colestasis, hipotiroidismo subclínico transitorio. Hiponatremia, efecto diurético |
- |
Adaptado de (19-26). INS, insulina; BI, biguanidas; SU, sulfonilureas; I-αG, inhibidores de α-glucosidasas.
Tabla 1b.- Efectos adversos de los fármacos antidiabéticos presentes en la terapéutica 2000-2008 (continuación)
EFECTOS ADVERSOS |
TZD |
I-DPP4 |
GLIN |
A-GLP1 |
Alteraciones gastrointestinales (náuseas, vómitos, diarrea, dolor abdominal) |
- |
x |
x |
x |
Hipoglucemia |
raras ocasiones |
- |
repaglinida > nateglinida |
- |
SNC |
- |
cefaleas |
--- |
cefaleas |
Aumento de peso |
ligero |
- |
(con repaglinida) |
- |
Hepatotoxicidad |
x |
- |
Alteración pruebas hepáticas |
- |
Alteraciones del sistema inmunológico |
Nasofaringitis, rinorrea |
Síndrome pseudogripal |
x |
|
Alteraciones en el lugar de administración y reacciones cutáneas |
- |
- |
Reacciones de hipersensibilidad cutánea |
- |
Edema |
Retención hidrosalina |
x |
- |
- |
Hemáticas |
Anemia dilucional leve |
- |
- |
- |
Cardiovasculares |
Aumento del riesgo de insuficiencia cardiaca. Rosiglitazona: aumento del riesgo de infarto |
- |
Síndrome coronario |
- |
Musculo-esqueléticas |
Fracturas óseas en mujeres |
Mialgias, artralgias |
- |
- |
Visuales |
(Pioglitazona: edema macular diabético) |
- |
x |
- |
Pancreatitis aguda |
- |
x |
- |
x |
Específicas de grupo |
Hiperlipidemia e hipotrigliceridemia |
Pérdida de peso |
- |
Reacción anafiláctica |
Adaptado de (19-26). TZD, tiazolidindionas; I-DPP4, inhibidores de la dipeptidilpeptidasa 4; GLIN, Glinidas; A-GLP1, análogos de GLP-1.
2. objetivo
Identificar perfiles de pacientes diabéticos que sufren reacciones adversas a medicamentos.
3. material y método
3.1. Material
Todas aquellas notificaciones espontáneas de sospechas de reacciones adversas donde están registrados fármacos antidiabéticos para el periodo 2000-2008 en EspaĖa. Según la clasificación Anatómica Terapéutica Química -Anatomical Therapeutic Chemical Classification, ATC- (11), los principios activos de referencia pertenecen al Subgrupo Terapéutico A10 ‘Fármacos usados en Diabetes’ que incluye los subgrupos farmacológicos ‘A10A Insulinas y análogos’ (Tabla 2) y ‘A10B Agentes hipoglucemiantes orales, excluyendo insulinas’ -AHOs- (Tabla 3).
Tabla 2.- A10A Insulinas y análogos. Principios activos y código ATC.
Código ATC |
Principio activo |
A10AB01 |
I. regular |
A10AB04 |
I. lispro |
A10AB05 |
I. aspart |
A10AB06 |
I. glulisina |
A10AC01 |
I. NPH o isofánica |
A10AC01 |
I. zinc 70% |
A10AC04 |
I. lispro protamina |
A10AC30 |
I. bovina+porcina zinc 70% |
A10AD01 |
I. regular + NPH |
A10AD04 |
I. lispro + lispro protamina |
A10AD05 |
I. aspart + aspart protamina |
A10AE01 |
I. zinc 90% |
A10AE04 |
I. glargina |
A10AE05 |
I. detemir |
A10AF01 |
I. inhalada |
Tabla 3.- A10B Agentes hipoglucemiantes, excluyendo insulinas (AHOs). Principios activos y código ATC.
Código ATC |
Principio activo |
A10BA02 |
Metformina |
A10BA03 |
Buformina |
A10BB01 |
Glibenclamida |
A10BB02 |
Clorpropamida |
A10BB03 |
Tolbutamida |
A10BB07 |
Glipizida |
A10BB08 |
Gliquidona |
A10BB09 |
Gliclazida |
A10BB12 |
Glimepirida |
A10BB00 |
Glisentida |
A10BD03 |
Metformina y rosiglitazona |
A10BD04 |
Glimepirida y rosiglitazona |
A10BD05 |
Metformina y pioglitazona |
A10BD07 |
Metformina y sitagliptina |
A10BD08 |
Metformina y vildagliptina |
A10BF01 |
Acarbosa |
A10BF01 |
Miglitol |
A10BG02 |
Rosiglitazona |
A10BG03 |
Pioglitazona |
A10BH01 |
Sitagliptina |
A10BH02 |
Vildagliptina |
A10BX01 |
Goma guar* |
A10BX02 |
Repaglinida |
A10BX03 |
Nateglinida |
A10BX04 |
Exenatida |
La base de datos FEDRA® 2.0 (Farmacovigilancia EspaĖola, Datos de Reacciones Adversas), perteneciente al Sistema EspaĖol de Farmacovigilancia de la Agencia EspaĖola del Medicamento, contiene la información sobre las RAs detectadas y notificadas por los profesionales sanitarios y por los laboratorios farmacéuticos, tras el inicio de comercialización de medicamentos y productos sanitarios (12).
El material se solicitó en forma de consulta abierta, previo permiso de la Agencia EspaĖola del Medicamento (13), y fue facilitado por el Instituto de Farmacoepidemiología de la Universidad de Valladolid en archivos Excel.
Para el tratamiento de la información de sospechas de RAM, hemos respetado los ‘Criterios para la utilización de los datos de la Base de Datos FEDRA del Sistema EspaĖol de Farmacovigilancia’ -SEFV/1/CT- (14) y las ‘Normas para la correcta interpretación y utilización de los datos del SEFV’ -SEFV/2/CT- (15). A este respecto, hemos tenido en especial consideración que, para cualquier notificación, no hay certeza de que el fármaco sospechoso haya causado la RA comunicada.
PROCESADO DE LA INFORMACIÓN. La fecha de inicio de la reacción (campo obligatorio) es la referencia para la búsqueda.
Cada caso queda identificado por la combinación de las variables ‘número de notificación’, ‘aĖo’ y ‘Comunidad Autónoma (CC.AA.)’ (ya que hay casos donde coinciden los números de notificación y Comunidad). Las operaciones más relevantes realizadas en la base de datos, a efectos de interpretación, han sido: i) codificar la variable continua ‘edad’ en grupos acordes con los establecidos en la Encuesta Nacional de Salud (ENSE) (16), ii) definir el 5ľ nivel del código ATC para cada principio activo o producto notificado -3.929 entradas- según la especialidad farmacéutica registrada, y iii) codificar las RAs y las indicaciones terapéuticas de los medicamentos asociados a dichas reacciones según la terminología del diccionario MedDRA (Medical Dictionary for Regulatory Activities)(17, 18). FEDRA® 2.0 emplea la versión en espaĖol del diccionario MedDRA (5). Su traducción incluye –manteniendo el orden jerárquico- los términos de bajo nivel (Low Level Term, LltRAM) para la indicación terapéutica; y los términos preferentes (Preferred Term, PtRAM), los términos de alto nivel (High Level Term, HltRAM), y el órgano o sistema correspondiente (System Organ Class, SOC) para la reacción adversa (18, 27). De este modo se codificaron 185 términos de bajo nivel, 380 términos preferentes, 236 términos de alto nivel y 25 órganos o sistemas afectados.
3.1. Método
Cada notificación presenta, al menos, un fármaco antidiabético registrado, pudiendo acompaĖarse de otros antidiabéticos u otros fármacos diferentes. Por ello, las notificaciones se pre-clasifican según: i) el número de fármacos registrados por notificación en ‘notificaciones con un fármaco’ (siempre será un antidiabético) y ‘notificaciones con varios fármacos’ (al menos uno de ellos es antidiabético), y ii) el subgrupo farmacológico: Insulinas, Agentes hipoglucemiantes excluyendo insulinas –AHOs- o combinaciones de Insulinas+AHOs. Se dispone de un total de 1.253 casos, de los que se excluyen 8 casos sin grupos farmacológicos definidos.
En el grupo ‘AHO/s y otros fármacos no antidiabéticos’ se observa un elevado número de notificaciones que presentan un fármaco no antidiabético en primera posición –orden establecido según el grado de sospecha-. Se realiza una segunda subdivisión en función de la posición del fármaco antidiabético, resultando las categorías: ‘posición 1’ y ‘otras posiciones’.
La gravedad (mortal, grave, moderada o leve) (4) y la causalidad de las notificaciones (definitiva, probable, posible, condicional, improbable o inclasificable) (2, 28) son examinadas y evaluadas en cada Centro Regional de Farmacovigilancia.
Como se indica en la Figura 1, para cada uno de los grupos definidos se realiza un estudio consistente en la obtención de un Gráfico de red (Análisis de red de enlaces) y un Análisis de perfiles de pacientes diabéticos (Modelo de segmentación).

Figura 1.- Clasificación de notificaciones espontáneas de RAM en pacientes diabéticos, según el/los fármaco/s antidiabético/s registrados. * con subgrupo farmacológico definido. ( ) número de notificaciones incluidas en el grupo.
ANÁLISIS DE RED DE ENLACES. Ofrece una imagen previa de las situaciones más frecuentes y características de cada grupo de pacientes diabéticos. Este análisis explora la frecuencia de asociación entre objetos de diferentes tipos. Una de sus aplicaciones más conocidas es la evaluación de los efectos adversos de los medicamentos en su etapa de vigilancia post-comercialización, permitiendo determinar si un efecto adverso particular puede ‘enlazarse’ (o correlacionarse) con uno o con varios medicamentos (29). Se visualiza mediante un resumen gráfico de frecuencias de co-ocurrencia o Gráfico de red entre valores de dos o más variables categóricas, donde las líneas más gruesas indican que los términos enlazados están fuertemente relacionados (30). Las variables incluidas en este análisis son los principios activos sospechosos (o sospechosos por interacción) y las reacciones adversas (términos preferentes de RAM -MedDRA-), respetando el orden de notificación de mayor a menor sospecha y gravedad respectivamente. Las frecuencias de correlación más altas también se extraen en tablas (ver Apéndice).
En los casos de monoterapia exploramos las correlaciones entre el principio activo sospechoso -‘PRINCIPIO ACTIVO’- y la reacción adversa de mayor gravedad -‘reacción adversa (término Preferente MedDRA), posición 1’-. En los casos de politerapia, debido a una mayor incidencia de RAM con el aumento de los fármacos administrados, se exploran las correlaciones entre los dos principios activos más sospechosos -‘PRINCIPIO ACTIVO, POSICIÓN 1’ y ‘PRINCIPIO ACTIVO, POSICIÓN 2’- y las dos reacciones adversas de mayor gravedad -‘reacción adversa (Término Preferente MedDRA), posición 1’ y ‘reacción adversa (Término Preferente MedDRA), posición 2’-.
MODELOS DE SEGMENTACIÓN. Permiten identificar registros similares y clasificarlos según el grupo al que pertenecen. Este procedimiento se realiza sin ningún conocimiento previo de los grupos y sus características. Sólo puede aplicarse en casos en los que el resultado específico se desconoce, como ocurre cuando se quieren identificar nuevos patrones o grupos de interés (31, 32). Se basan en la medida de las distancias entre los registros (casos) y entre los grupos. Los casos se asignan a los grupos de tal manera que se tiende a minimizar la distancia entre los casos pertenecientes al mismo grupo (31). Este tipo de aprendizaje no supervisado, no dispone de una referencia externa con la que juzgar la clasificación realizada por el modelo, sino que su la validez se determina según su capacidad de recoger agrupamientos interesantes de los datos y proporcionar descripciones útiles de esos grupos (31, 32). Dentro de este tipo de modelos se incluye el modelo de redes de Kohonen.
Modelo de redes de Kohonen. Basado en un modelo preliminar denominado mapa auto-organizado (Self-Organizing Map, SOM) (33), en el actual modelo de redes de Kohonen se genera un tipo de red neuronal que agrupa los registros de una base de datos en diferentes grupos cuya existencia no se conoce al inicio. El mapa de salida es una red o cuadrícula bidimensional de neuronas, sin conexiones entre las unidades (31, 32).
La técnica para construir estos modelos se denomina aprendizaje o modelado automático (10), y consiste en una presentación de cada registro en la capa de entrada y una propagación competitiva hacia el mapa de salida (Figura 2). Esto se repite con cada registro y cuando la red está completamente ‘entrenada’, los registros de dentro de un grupo se consideran similares y deben aparecer más cercanos en el mapa de salida, mientras que los registros entre grupos se consideran diferentes y aparecen alejados. Las agrupaciones más fuertes serán aquellas que resumen muchos registros (31, 32).
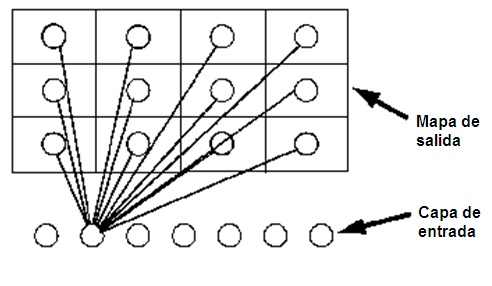
Figura 2.- Estructura de un modelo de red de Kohonen. Todas las neuronas de la capa de entrada están conectadas a todas las neuronas del mapa de salida. En la figura mostramos las conexiones que establecería una de las neuronas de la capa de entrada. Adaptado de (31).
Para el presente estudio se selecciona un modelo de análisis con datos particionados y un mapa de salida de 3x2 neuronas, que genera tres perfiles por grupo. La información obtenida para cada perfil a partir de las variables de entrada se recoge en una ficha-resumen estructurada (Tabla 4; ver Apéndice).
El procesamiento de la base de datos se ha realizado con Microsoft Office Excel v2007 e IBM PASW® Statistics 18, y el modelado con Clementine® SPSS v12.0.
Tabla 4.- Modelo de ficha-resumen de los perfiles de pacientes diabéticos que sufren RAM. Se registran los resultados con mayor porcentaje atribuible (%) respecto del total notificado para cada variable.
PERFIL |
|||||
DATOS DE LA NOTIFICACIÓN |
|||||
nľ notificaciones (principio activo) |
Género: |
(%) |
Gravedad: |
(%) |
|
Edad (aĖos): |
(%) |
Mortal: |
(%) |
||
CC.AA.: |
(%) |
||||
AĖo: |
(%) |
||||
PRINCIPIOS ACTIVOS (PAs) |
|||||
PA* |
ATC 1: |
(%) |
|||
ATC 2: |
(%) |
||||
ATC 3: |
(%) |
||||
ATC 4: |
(%) |
||||
ATC 5: |
(%) |
||||
Sospecha: |
(%) |
||||
Indicación terapéutica: |
(%) |
||||
REACCIONES ADVERSAS A MEDICAMENTOS (RAMs) |
|||||
RAM* |
Órgano |
(%) |
|||
HltRAM |
(%) |
||||
PtRAM |
(%) |
||||
RELACIÓN CAUSAL- Algoritmo de Karch y Lasagna: |
% |
||||
*se incluyen tantos apartados de principio activo (PA) y reacción adversa a medicamento (RAM) como requiera cada perfil.
4. resultados
GRUPO 1: Notificaciones con Insulina en monoterapia.
Perfil 1.1 (52 notificaciones): Mujer de más de 75 aĖos, procedente de CataluĖa, que en el aĖo 2006 sufre RA considerada no grave y probable. El fármaco sospechoso es insulina de acción prolongada detemir, indicada para el tratamiento de diabetes, que puede producir, en primer lugar, trastornos generales y alteraciones en el lugar de administración y, en segundo lugar, prurito.
Perfil 1.2 (1 notificación): caso aislado de un hombre de edad desconocida, procedente de las Islas Baleares, que en el aĖo 2007 sufre RA considerada no grave y probable. El fármaco sospechoso es insulina de acción prolongada glargina, indicada para el tratamiento de diabetes, que puede producir trastornos del metabolismo y de la nutrición.
Perfil 1.3 (46 notificaciones): mujer de edad no definida de CataluĖa que en el aĖo 2008 sufre RA considerada grave (aunque no mortal) y posible. El fármaco sospechoso es insulina de acción prolongada glargina, indicada para el tratamiento de diabetes, que puede producir trastornos del metabolismo y de la nutrición, que pueden acompaĖarse de trastornos generales y alteraciones en el lugar de administración. En caso de aparecer 3 o más RAs podría notificarse edema, fallo de dispositivo médico, fármaco ineficaz, insuficiencia de válvula tricúspide o fetopatía diabética.

Gráfico 1.- Red de enlaces de sospechas de RAs con insulina en monoterapia. Este grupo consta de 99 notificaciones. Se observa un predominio de la relación entre insulina aspart + aspart-protamina y la RA hiperglucemia (7 casos). Otras relaciones interesantes son detemir con ‘reacción en la zona de inyección’, insulina isofánica con ‘hipoglucemia’ e insulina glargina con ‘hiperglucemia’ (todos ellos con 5 casos cada uno).
GRUPO 2: Notificaciones con AHO en monoterapia.
Perfil 2.1 (125 notificaciones): mujer de más de 75 aĖos, procedente de CataluĖa, que en el aĖo 2004 sufre RA considerada grave (aunque no mortal) y probable. El fármaco sospechoso es la biguanida metformina, indicada para el tratamiento de diabetes, que puede producir trastornos del metabolismo y de la nutrición, trastornos renales, e incluso, pueden acompaĖarse de trastornos respiratorios. En caso de aparecer 4 o más RAs podría llegar a notificarse aspartato aminotransferasa elevada, diarrea, vómitos, alucinación o alteración del equilibrio.
Perfil 2.2 (13 notificaciones): mujer de más de 75 aĖos, de Galicia, que entre los aĖos 2006 y 2007 sufre RA considerada no grave y posible. El fármaco sospechoso es la sulfonilurea glibenclamida, indicada para el tratamiento de diabetes, que puede producir trastornos del sistema nervioso, trastornos psiquiátricos y trastornos respiratorios, torácicos y mediastínicos. En caso de aparecer 4 RAs podría notificarse estados disociativos.
Perfil 2.3 (388 notificaciones): mujer entre 65 y 74 aĖos, de Aragón, que en 2008 sufre RA considerada no grave y probable. El fármaco sospechoso es la biguanida metformina, indicada para el tratamiento de diabetes, que puede producir trastornos gastrointestinales diversos como diarrea. En caso de aparecer 5 o más RAs podrían notificarse palpitaciones y vómitos.
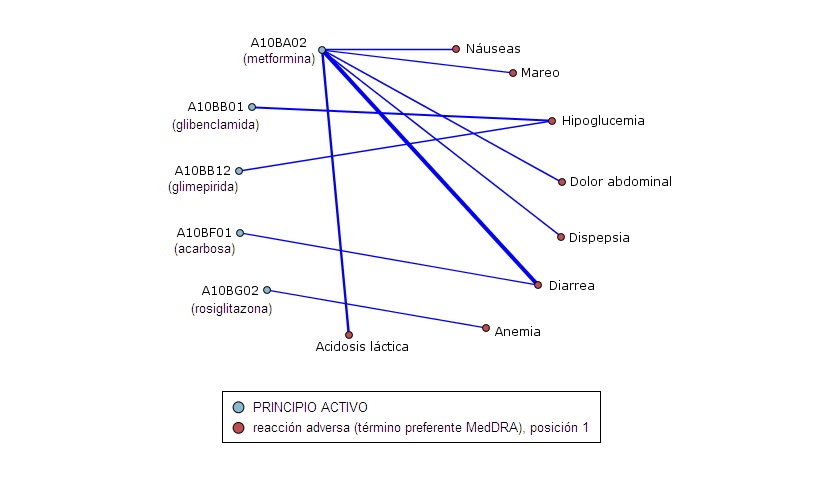
Gráfico 2.- Red de enlaces de sospechas de RAs con AHO en monoterapia. Este grupo consta de 526 notificaciones. Se observa una fuerte relación entre metformina y las RAs ‘Diarrea’ (60 casos) y ‘Acidosis láctica’ (28 casos), además de ‘dolor abdominal’, ‘dispepsia’ y ‘náuseas’. La ‘hipoglucemia’ se relaciona con las sulfonilureas glibenclamida (20 casos) y glimepirida (9 casos). En menor grado, rosiglitazona en monoterapia se relaciona con ‘anemia’ y acarbosa con ‘diarrrea’.
GRUPO 3: Notificaciones con Insulina/s y principios activos no antidiabéticos.
Perfil 3.1 (39 notificaciones): mujer entre 25 y 34 aĖos, de las Comunidades de Valencia o Madrid, que en 2008 sufre RA considerada grave (aunque no mortal) y posible. Presenta combinaciones de hasta 7 fármacos sospechosos, siendo el primero insulina de acción prolongada glargina y los siguientes hasta cuatro insulinas diferentes (rápida, intermedia o prolongada)-, y puede producir trastornos generales y alteraciones en el lugar de administración. En caso de aparecer 3 o más RAs podría notificarse edema de la boca, eritema, hiperglucemia, prurito o hiperhidrosis.
Perfil 3.2 (5 notificaciones): hombre de 16 aĖos en adelante, de Andalucía, Canarias, Castilla-León, CataluĖa o Madrid, que en el aĖo 2006 sufre RA grave (aunque no mortal) y probable. El fármaco sospechoso es insulina de acción intermedia ‘regular + isofánica’ o insulina de acción prolongada detemir -combinada con hasta 3 fármacos no sospechosos (otra insulina, vitaminas o agentes modificadores de lípidos)-, que puede producir trastornos de la piel y del tejido subcutáneo, trastornos generales y alteraciones en el lugar de administración, y trastornos del metabolismo y de la nutrición (hiperglucemia). En caso de aparecer 3 o más RAs puede notificarse eritema nudoso, temblor, hiperhidrosis, hipersensibilidad, palidez o prurito.
Perfil 3.3 (24 notificaciones): hombre o mujer de 75 o más aĖos, procedente de Andalucía, CataluĖa o Comunidad Valenciana; que en el aĖo 2004 sufre RA grave (aunque no mortal) y considerada posible/probable. El fármaco sospechoso es la insulina de acción prolongada glargina -combinada hasta con 6 fármacos no sospechosos (una o dos insulinas adicionales y agentes antitrombóticos)-, que puede producir trastornos del metabolismo y de la nutrición (hipoglucemia). En caso de aparecer 3 o más RAs puede darse efecto farmacológico o respuesta terapéutica disminuida, presencia de anticuerpos a un fármaco, retención urinaria, lagrimeo aumentado o acaloramiento.
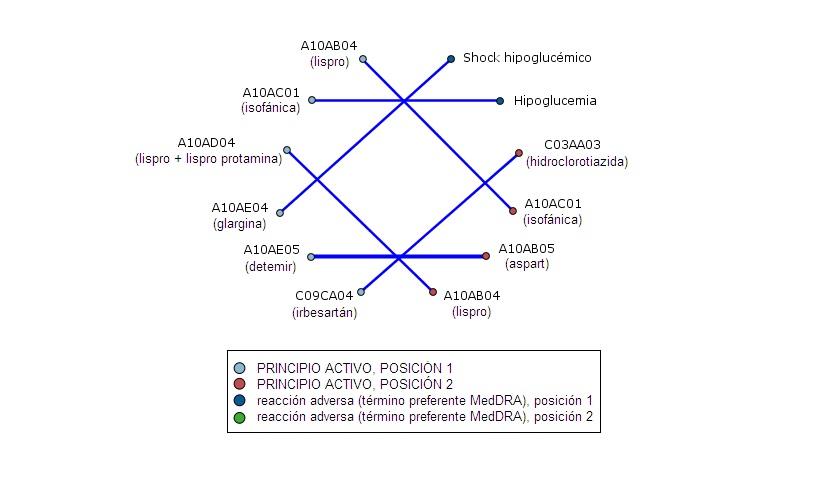
Gráfico 3.- Red de enlaces de sospechas de RAs con Insulina/s y principios activos no antidiabéticos. Este grupo consta de 68 notificaciones. Se refleja la relación entre el análogo de acción prolongada detemir –posición 1- y el análogo de acción rápida aspart -posición 2- (3 casos). La insulina rápida lispro aparece relacionada en posición 1 con insulina de acción intermedia isofánica (2 casos); y en posición 2 con el análogo de acción bifásica lispro+lispro protamina (2 casos). Existen casos de politerapia con antihipertensivos (irbesartán) y diuréticos (hidroclorotiazida) donde la insulina aparece en posiciones menos relevantes. Existe una correlación similar (2 enlaces) entre insulina isofánica y la RA ‘Hipoglucemia’, así como entre insulina glargina y la RA ‘Shock hipoglucémico’. No destaca ninguna RA en posición 2.
GRUPO 4: Notificaciones con AHO/s y principios activos no antidiabéticos. AHO en primera posición.
El primer principio activo sospechoso puede ser o no un antidiabético oral. En este grupo analizamos los que presentan AHO en primera posición.
Perfil 4.1 (190 notificaciones): mujer entre 65 y 74 aĖos, procedente de Galicia, que en el aĖo 2006 sufre RA no grave y posible/probable. Presenta combinaciones de hasta 7 fármacos sospechosos, siendo el primero metformina. Los 6 restantes están relacionados con tratamientos de la sangre y órganos hematopoyéticos, sistema cardiovascular, sistema nervioso y preparados hormonales sistémicos (excluyendo hormonas sexuales e insulinas); e incluso en casos con nueve o más fármacos administrados se notifican pantoprazol, captopril o glibenclamida (tratamiento de diabetes). Estas combinaciones pueden producir trastornos gastrointestinales, del sistema nervioso, generales y alteraciones en el lugar de administración, trastornos musculoesqueléticos y del tejido conjuntivo, renales y urinarios.
Perfil 4.2 (60 notificaciones): mujer entre 55 y 64 aĖos, procedente de CataluĖa, que en el aĖo 2007 sufre RA grave no mortal y probable. El fármaco sospechoso es la biguanida metformina combinada con hasta 10 fármacos no sospechosos -relacionados con tratamientos del tracto alimentario y metabolismo, sistema cardiovascular y sistema nervioso-. El fármaco sospechoso puede producir trastornos del metabolismo y de la nutrición, trastornos gastrointestinales y del sistema nervioso.
Perfil 4.3 (167 notificaciones): mujer entre 65 y 74 aĖos, procedente de CataluĖa, que en el aĖo 2008 sufre RA no grave y probable. El fármaco sospechoso es la biguanida metformina combinada hasta con 11 fármacos no sospechosos -relacionados con tratamientos del tracto alimentario y metabolismo (incluyendo vitaminas) y del sistema cardiovascular-. Se pueden producir trastornos gastrointestinales, del sistema nervioso, generales y alteraciones en el lugar de administración.
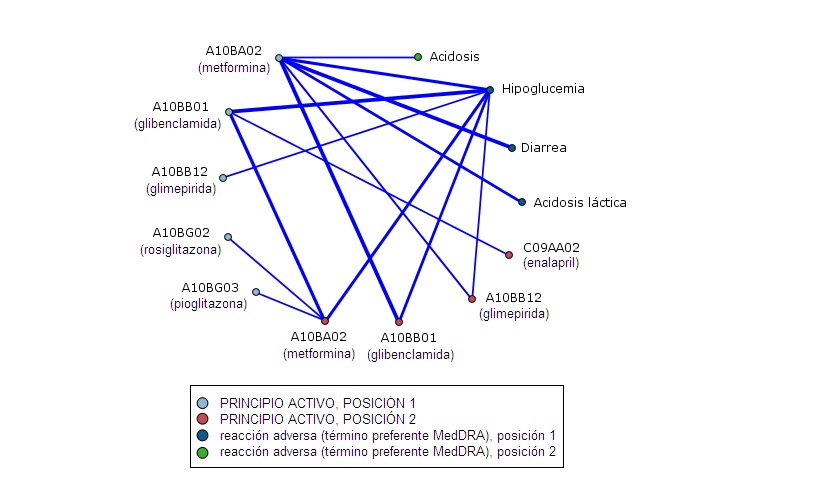
Gráfico 4.- Red de enlaces de sospechas de RAs con AHO/s y principios activos no antidiabéticos. AHO en primera posición. Este grupo consta de 417 notificaciones. Se detecta una fuerte relación entre metformina y glibenclamida (20 casos). También existen enlaces entre metformina y glimepirida (4 casos), y entre glibenclamida y el antihipertensivo enalapril (3 casos). Se observa la combinación de tiazolidindionas (rosiglitazona o pioglitazona) en primera posición y metformina en segunda posición. La RA ‘Hipoglucemia’ se relaciona fuertemente con metformina (16 casos), glibenclamida (18 casos) y glimepirida (6 casos) independientemente de sus posiciones. Metformina se relaciona con ‘Diarrea’ (11 casos), ‘Acidosis láctica’ (7 casos) y ‘Acidosis’ –no láctica- (3 casos).
GRUPO 5: Notificaciones con AHO/s y principios activos no antidiabéticos. Principio activo no antidiabético en primera posición.
Perfil 5.1 (36 notificaciones): hombre o mujer entre 65 y 74 aĖos, procedente de Galicia, que en el aĖo 2003 sufre RA no grave y posible. Presenta combinaciones de hasta 8 fármacos sospechosos, siendo el primero del sistema cardiovascular. Los 7 restantes son antidiabéticos orales no especificados. Estas combinaciones pueden producir trastornos de la piel y del tejido subcutáneo y trastornos gastrointestinales. En caso de aparecer 3 o más RAs podría llegar a notificarse malestar general, diarrea o dispepsia.
Perfil 5.2 (22 notificaciones): hombre entre 65 y 74 aĖos, procedente de CataluĖa, que en el aĖo 2008 sufre RA grave (aunque no mortal) y posible. Presenta combinaciones de hasta 10 fármacos sospechosos (o sospechosos por interacción), siendo el primero del sistema cardiovascular y los restantes antidiabéticos orales –principalmente-, antiácidos, bloqueantes de canales de calcio, modificadores de lípidos, psicolépticos y psicoanalépticos. Estas combinaciones pueden producir trastornos del metabolismo y de la nutrición, de la sangre y del sistema linfático, trastornos psiquiátricos, respiratorios, torácicos y mediastínicos. En caso de presentarse 3 o más RAs podría notificarse diarrea, dolor abdominal, hipoglucemia, insuficiencia renal aguda, acaloramiento, taquicardia, nerviosismo, rubefacción y retención urinaria.
Perfil 5.3 (35 notificaciones): mujer mayor de 75 aĖos, procedente de CataluĖa, que en los aĖos 2005 o 2007 sufre RA grave (aunque no mortal) y probable. Presenta combinaciones de 2 fármacos sospechosos, donde el primero es del sistema cardiovascular y el segundo un antidiabético oral, administrados concomitantemente con hasta 10 fármacos no sospechosos. Dichas combinaciones pueden producir trastornos del metabolismo y de la nutrición, y en caso de presentarse 3 o más RAs podría notificarse anemia, bradifrenia, disnea, niveles de fármaco elevados, apetito disminuido, edema de lengua o de cara, peso disminuido y disgeusia.
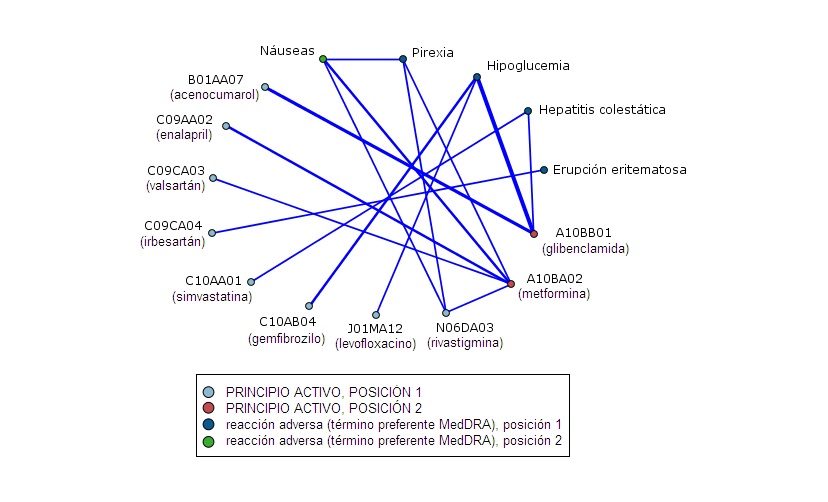
Gráfico 5. Red de enlaces de sospechas de RAs con AHO/s y principios activos no antidiabéticos. Principio activo no antidiabético en primera posición. Este grupo consta de 93 notificaciones. En el Gráfico 5, aparece una fuerte relación entre el agente antitrombótico acenocumarol y la sulfonilurea glibenclamida (4 casos). Destaca la presencia de metformina como segundo principio activo relacionado con diversos fármacos, tales como antihipertensivos (enalapril -3 casos-), antagonistas de angiotensina 2 (valsartán -2 casos-) y medicamentos antidemencia (rivastigmina -2 casos-). Se relaciona la RA ‘Hipoglucemia’ con gemfibrozilo en posición 1 (3 casos), con glibenclamida en posición 2 (5 casos), y con levofloxacino en posición 2 (2 casos). Se observa una estructura que relaciona rivastigmina, metformina, ‘pirexia’ y ‘náuseas’. Es llamativa la RA ‘Hepatitis colestásica’ relacionada con glibenclamida o simvastatina (2 casos en ambos), así como la ‘Erupción eritematosa’ enlazada exclusivamente con irbesartán (2 casos).
GRUPO 6: Notificaciones con combinaciones de Insulina/s y AHO/s.
Perfil 6.1 (15 notificaciones): mujer entre 45 y 64 aĖos o mayor de 75 aĖos, procedente de Extremadura, que en el aĖo 2008 sufre RA no grave y posible. El fármaco sospechoso sería la biguanida metformina combinada con hasta 13 fármacos no sospechosos y muy diversos (insulinas de acción bifásica, enalapril, bloqueantes de canales de calcio, ácido acetilsalicílico). El único fármaco considerado sospechoso puede producir trastornos en la piel y tejido subcutáneo, y a partir de la segunda RA podría notificarse edema, estado confusional, insomnio, masa en la zona de inyección, mialgia y respuesta terapéutica disminuida.
Perfil 6.2 (3 notificaciones): hombre entre 55 y 64 aĖos, que sufre RA no grave y posible. El fármaco sospechoso sería la insulina de acción prolongada glargina, la biguanida metformina o la glinida repaglinida; y combinado hasta con 4 fármacos no sospechosos (insulinas de acción intermedia, agentes antitrombóticos, metformina, enalapril, paracetamol, agentes urológicos o glibenclamida). El fármaco sospechoso puede producir trastornos gastrointestinales, trastornos vasculares o exploraciones complementarias (elevación de niveles de enzimas hepáticos).
Perfil 6.3 (24 notificaciones): mujer entre 65 y 74 aĖos, procedente de Galicia, que en 2007 o 2008 sufre RA no grave y posible. Presenta combinaciones de hasta 7 fármacos sospechosos siendo el primero insulina de acción prolongada glargina, y los restantes sospechosos -paracetamol, tramadol, ibuprofeno y diclofenaco- o sospechosos por interacción -metformina, ácido acetilsalicílico, sulpirida, glipizida, atorvastatina, diazepam-. Estas combinaciones pueden producir trastornos del metabolismo y de la nutrición, y a partir de la segunda RA, bloqueo auriculoventricular, cefalea, edema de la zona de inyección, error de medicación, hipoglucemia, insuficiencia cardiaca, mareo, reacción en la zona de inyección, síncope o visión borrosa.
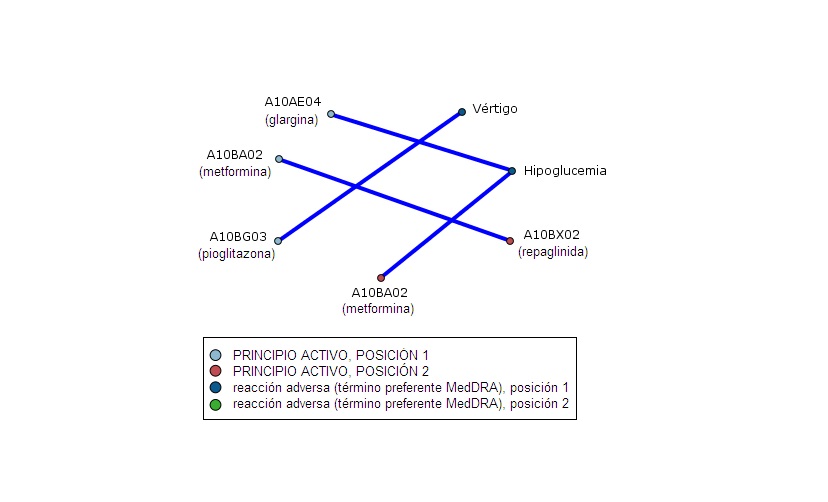
Gráfico 6.- Red de enlaces de sospechas de RAs con combinaciones de Insulina/s y AHO/s. Este grupo consta de 42 notificaciones. La relación más fuerte es la combinación de la biguanida metformina y la glinida repaglinida (2 casos), mientras que la insulina se localiza en posiciones inferiores. Respecto a las RAs, se localizan enlaces de ‘Hipoglucemia’ con insulina glargina en posición 1 y con metformina en posición 2 (2 casos en ambos). Con igual frecuencia aparece la relación entre ‘Vértigo’ y pioglitazona en primera posición. No destaca ninguna RA en posición 2.
5. discusión
Manteniendo la clasificación inicial de las notificaciones, analizamos las características de cada grupo y perfil, con especial interés en las combinaciones fármacos-reacciones adversas.
INSULINAS EN MONOTERAPIA
Análogos de insulinas e hiperglucemia. La relación que hemos observado mayoritariamente en pacientes que sólo utilizan insulina es la existente entre aspart+aspart protamina e hiperglucemia. Según la bibliografía existente, la hiperglucemia no se contempla como RA, sino como efecto derivado de la interacción entre insulina y fármacos (como clonidina, corticosteroides, diazóxido o fenitoína) (19, 20, 26). En nuestra base de datos, el único caso en el que aparece como sospechoso por interacción es junto a insulina rápida aspart.
También es conocida la indicación a modo de precaución, de la posibilidad de producirse hiperglucemia matutina, siendo importante distinguir entre los tipos de hiperglucemia posibles ya que el tratamiento no es el mismo para todos (34). Debido a ello, habría que diferenciar entre los casos en los que la hiperglucemia matutina se debe al efecto Somogyi y aquellos en los que se produce hiperglucemia sin antecedente hipoglucémico alguno conocido como fenómeno del alba. El tratamiento de la hiperglucemia de rebote consistiría en reducir las dosis de insulina y/o tomar una fuente de carbohidrato antes de acostarse, mientras que en el otro caso debería ajustarse la dosis de insulina nocturna para favorecer que las necesidades de insulina entre las 4 y las 7 de la maĖana queden cubiertas (34). Creemos que este último caso podría ser más acertado para la insulina aspart+aspart protamina en nuestro estudio, debido a que presenta también relación con la RA ‘Respuesta terapéutica disminuida’. Ya que el hecho de confundir entre los tipos de hiperglucemia matutina podría resultar en una hipoglucemia nocturna aún más grave, sería interesante que se diferenciase entre estos tipos de hiperglucemia en la codificación y que se incluyesen como RAs en las fichas técnicas de insulina.
Otras relaciones mayoritarias entre usuarios de insulina en monoterapia son detemir-reacción en la zona de inyección y glargina-hiperglucemia. Cada uno de ellos aparece también reflejado en perfiles diferentes -perfil 1.1 y perfil 1.3, respectivamente-, que se caracterizan por ocurrir en mujeres en la segunda mitad del periodo de estudio y en las que se notifican como sospechosas las insulinas de acción prolongada.
Por su parte, la insulina glargina se asocia más en nuestro estudio a casos de hiperglucemia que de hipoglucemia, coincidiendo así con el perfil 1.3 que se caracteriza por no presentar una edad mayoritaria de aparición de la RA y que además esta última se considera grave –aunque no mortal- en el 100% de los casos.
Adicionalmente, la insulina isofánica es la que presenta mayor relación con hipoglucemia. Según estudios en los que se comparan glargina e isofánica (35), la insulina glargina es igual de efectiva que la insulina isofánica en el control glucémico, especialmente en diabetes tipo 2, y se asocia con menos episodios nocturnos de hipoglucemia sintomática.
Esto apoya que los casos de hiperglucemia con insulinas análogas se deben más a un fenómeno de alba o a disminución del nivel de insulina que a una hiperglucemia de rebote. A su vez, la aparición del fenómeno de alba se conoce que es menor si la insulinización del paciente ha sido adecuada (36) y que es más frecuente que el efecto Somogyi.
Estas hiperglucemias de insulinas en monoterapia pueden derivarse de una insulinización de novo o un cambio de insulina humana a análogo realizados inadecuadamente. Por tanto, en los casos en los que se realicen estos cambios, debería considerarse el diagnóstico de estos fenómenos recomendando un control de glucemia entre las 3 y las 5 de la madrugada durante varias noches (37).
Análogos de acción prolongada y reacción en la zona de inyección. Se podría decir que una RA específica del grupo de insulinas de acción prolongada (detemir, glargina) es la reacción en el lugar de administración (dolor, enrojecimiento, ronchas, hinchazón, picor) por presentar una mayor frecuencia de aparición que con insulina isofánica, aunque es generalmente transitoria y desaparece al continuar el tratamiento (38, 39). Estos datos concuerdan con el perfil 1.1, que se produce predominantemente en mujeres y en edades de 75 o más aĖos.
Aunque cualquier terapia insulínica puede producir reacciones en el lugar de inyección, la gran afinidad de los análogos de acción prolongada tanto por la albúmina tisular subcutánea como por la plasmática, así como la fuerte asociación de las propias moléculas de insulina en el lugar de inyección condiciona sus características de absorción lenta y acción prolongada (40, 41); y es a su vez responsable de estas reacciones del tejido subcutáneo.
La aparición de RAs en la zona de inyección puede ser sinónimo de una administración inadecuada, ya que las recomendaciones de rotación del punto de inyección dentro de la misma zona -dadas específicamente para reducir o prevenir estas reacciones- no parecen considerarse en estos casos.
El perfil 1.2 consta de un único caso aislado que no concuerda con los datos de ningún otro perfil definido, por lo que demuestra la validez del modelo aplicado tanto para detectar características comunes entre los casos como para detectar casos atípicos.
Dentro del perfil 1.3 se localiza el único caso de fetopatía diabética presente en la base de datos. Esta RA es considerada como posible tras la administración de insulina detemir. Existen estudios que demuestran que en mujeres con diabetes gestacional, el uso de análogos de acción rápida no produce efectos adversos ni en la madre ni en el feto. La insulina prolongada glargina no está recomendada durante el embarazo aunque ha demostrado no producir mayor incidencia de malformaciones congénitas comparada con la insulina humana, mientras que no existen suficientes datos para la valoración de detemir (42). El hecho de que muchas mujeres diabéticas que estén utilizando análogos de acción prolongada tengan embarazos no planificados aumentaría la posibilidad de RAs en el embarazo.
AHOS EN MONOTERAPIA
Las observaciones mayoritarias van dirigidas a metformina y sulfonilureas debido a su frecuencia de aparición. Destaca el uso de rosiglitazona asociada a anemia.
Aunque en el periodo de estudio el uso de metformina no supera al de sulfonilureas, algunas investigaciones utilizan este tipo de resultados para justificar que metformina, en la década posterior al estudio UKPDS, ha ejercido más un papel de complemento de las sulfonilureas -o de otras combinaciones de AHOs-, que de fármaco de primera línea (43). Además se aĖade que la terapia combinada de sulfonilureas y metformina esté tan extendida (más del 67% de los usuarios de AHOs a nivel internacional) indica que los efectos adversos de metformina no son una gran barrera para su uso ni explican su menor uso en monoterapia.
Esto contrasta con nuestra observación de un mayor número de notificaciones de casos en monoterapia con metformina (220) que con sulfonilureas (91), por lo que consideramos que, al menos en EspaĖa, las RAs que genera la metformina sí pueden ejercen limitaciones para su perfil de uso.
Metformina y acidosis láctica. La acidosis láctica asociada a metformina (MALA en sus siglas en inglés) es una complicación metabólica grave que ocurre habitualmente por acumulación de metformina en pacientes que alcanzan estados de deshidratación o que desarrollan fallo renal agudo. También hay casos debidos a exposiciones agudas a este principio activo. Mientras que MALA no es común, su morbilidad y mortalidad asociadas pueden ser elevadas (en el 50% de los casos se produce la muerte). Secundariamente a esta reacción, el paciente puede experimentar cambios en su sistema nervioso central, colapso cardiovascular, fallo renal, y muerte en la mitad de los casos (44).
Varios de estos síntomas quedan reflejados en el perfil 2.1, especialmente la afectación del sistema nervioso central (alucinaciones, alteraciones del equilibrio) y trastornos renales. Este perfil se da mayoritariamente en mujeres, en edades de 75 o más aĖos, la reacción es considerada grave en un 100% de los casos y mortal en un 4,8% de los mismos. También llama la atención que casi un tercio de los casos ocurren en CataluĖa. Adicionalmente, hemos observado que un 45% de casos con asociación metformina-acidosis láctica se producen con metformina en monoterapia.
Los primeros objetivos de tratamiento de MALA son el restablecimiento del equilibrio ácido-base y eliminación de metformina, mediante hemodiálisis y terapia con bicarbonato. No existe un antídoto específico (44). En el Centro Regional de Farmacovigilancia de Castilla-la Mancha se hicieron eco de los cinco casos de sospechas de acidosis láctica, dos de los cuales tuvieron resultado de muerte, situación que motivó una alerta de seguridad en julio de 2003 (45). En el extenso estudio UKPDS sobre el control glucémico de metformina no se produjo ningún caso de muerte por acidosis láctica. A esto hay que aĖadir que uno de los posibles motivos de desaparición de otras biguanidas como fenformina o buformina es que metformina tiene entre 10 y 20 veces menos riesgo de producir acidosis láctica (46).
Respecto a la información incluida en las fuentes bibliográficas al respecto de esta RA, en el Catálogo de Especialidades Farmacéuticas, la acidosis láctica por metformina se encuadra dentro de las RAs hematológicas (47), en vez de en metabólicas como correspondería según se recoge en el diccionario MedDRA (17).
También podría ser de utilidad la inclusión de un ítem en la tarjeta amarilla que indique si el paciente consume o no alcohol. El consumo de alcohol en pacientes que toman metformina aumenta el riesgo de hipoglucemia (si el consumo es agudo) y de acidosis láctica (si el consumo es crónico) (19, 20, 26).
Metformina y diarrea. Se trata de una RA cuya relación con metformina es conocida. Se sabe que es dosis dependiente y debido a ello presenta especificaciones de uso recogidas en su ficha técnica. El comienzo está indicado con una dosis baja (500-850 mg en 2-3 tomas diarias) que puede aumentarse tras 10-15 días según los niveles de glucemia (48). El aumento lento de la dosis ha demostrado mejorar la tolerancia gastrointestinal. En nuestros resultados observamos que un 44% de los casos de asociación de metformina-diarrea se producen en monoterapia. Estas características concuerdan con el perfil 2.3 que se produce mayoritariamente en mujeres, en edades comprendidas entre los 65 y los 74 aĖos y, llamativamente, casi un cuarto de los casos se dan en Aragón.
Existen estudios sobre la prescripción de metformina en la población con mayor riesgo de desarrollar RAs que han demostrado que este principio activo se administra a pacientes en los que no estaría recomendado (contraindicado con valores de creatinina superiores a 0,132mMol/l, respecto a su riesgo de acidosis láctica), y se ha observado como efecto adverso diarrea que ha requerido disminución de la dosis de metformina (49). Es destacable que el 83% de las intervenciones farmacéuticas realizadas en este último estudio, que aconsejaban la suspensión del tratamiento con metformina, fueron aceptadas, por lo que el seguimiento farmacoterapéutico se posiciona como un servicio de gran utilidad en estos casos.
Metformina actualmente se indica como fármaco de primera línea en el control glucémico de pacientes con diabetes tipo 2, incidiendo en su potencial aplicación en dosis elevadas para maximizar el control glucémico sin aumentarse los efectos adversos gastrointestinales (50).
Por último, cabe indicar que se ha estudiado que ambas condiciones producidas por metformina –diarrea y acidosis láctica- pueden estar relacionadas. Una ingesta oral reducida junto a la deshidratación secundaria debida a la diarrea puede resultar en un fallo renal agudo que precipita la aparición de MALA (51).
Sulfonilureas e hipoglucemia. Según nuestros resultados, los casos de hipoglucemia por sulfonilureas en monoterapia se asocian fundamentalmente al uso de glibenclamida, y en menor medida al de glimepirida. A pesar de ello, los casos en monoterapia -respecto al total de casos (monoterapia y politerapia)- son inferiores para glibenclamida (34,5%) que para glimepirida (42,8%); en cambio, esta última parece ser más segura en caso de combinaciones con otros AHOs o insulina.
Es conocido que glibenclamida tiene un mayor riesgo de hipoglucemias e hiperinsulinemias. Otras sulfonilureas de segunda generación, como gliclazida y glimepirida, podrían ser más útiles en ancianos por el menor riesgo de hipoglucemias graves –demostrado en comparaciones de glimepirida y glibenclamida (52)-; y además, al ser de toma única diaria, puede ayudar a mejorar el cumplimiento terapéutico (6). En cambio, otros autores consideran que los efectos secundarios entre las diferentes sulfonilureas son similares, y que cuanto más larga es la duración de acción más prolongado será un episodio hipoglucémico en caso de producirse, por lo que consideran prudente recurrir a sulfonilureas de acción corta -glibenclamida- en pacientes ancianos con hábitos dietéticos irregulares (53).
En nuestro estudio, observamos que Galicia es la única Comunidad Autónoma con más RAs por sulfonilureas que por biguanidas (demostrando una posible infrautilización de metformina), siendo DAONIL 5mg 30 comprimidos la especialidad notificada como sospechosa más frecuentemente. Galicia también se caracteriza por ser la tercera Comunidad en número de notificaciones de RAs relacionadas con antidiabéticos durante el periodo de estudio (154 casos), y los pacientes diabéticos de esta región que sufren RAs tienen entre 65-74 aĖos, la mayoría son mujeres y suelen presentar hipoglucemias no graves. Nuestros resultados se confirman con estudios realizados en Galicia donde se concluye que se utiliza más glibenclamida que glimepirida en pacientes pensionistas frente a no pensionistas y que su uso no se ajusta a las recomendaciones de las guías terapéuticas disponibles (6).
Estas mismas características diferenciadoras también se observan en el perfil 2.2, donde se observan reacciones no graves, mayoritariamente en mujeres, en edades de 75 o más aĖos, durante la segunda mitad del periodo, y -concordando con los datos anteriores- más de la mitad de los casos ocurren en Galicia.
También hemos observado en el País Vasco un mayor número de RAs de hipoglucemia, a la vez que una mayoría de RAs producidas por sulfonilureas, pero no estrictamente por glibenclamida. Esto último coincide con los datos de descenso de uso de este principio activo a lo largo del periodo, presentes tanto en nuestro estudio como en otros consultados (54). Aun así estimamos que glibenclamida podría seguir siendo responsable de estas hipoglucemias ya que el resto de sulfonilureas de primera generación como clorpropamida o tolbutamida, también tendentes a producir estos episodios, presentan un uso residual.
Respecto a glimepirida -incluida en 1997-, sólo parece adoptarse la evidencia de su uso preferente en ancianos frente al uso de glibenclamida por menor riesgo de hipoglucemia -conocida desde 2001 (52)- tras las recomendaciones del NICE de 2002 (55). Aun así, según recogen algunos estudios, en guías espaĖolas posteriores aún se recomienda el uso de glibenclamida como fármaco de primera elección en pacientes con normopeso con glucemia no controlada por medidas no farmacológicas (56).
En nuestros resultados no se recoge ningún caso de RA con gliclazida como fármaco sospechoso cuando su uso medio ha sido de un 9% del total de AHOs. Este hecho viene apoyado por los resultados del estudio ADVANCE que revelan que el uso de gliclazida de liberación retardada es la opción más segura dentro del tratamiento con sulfonilureas (57, 58).
Rosiglitazona y anemia. Aunque la aparición de anemia suele ir más asociada al uso combinado de rosiglitazona y metformina, en nuestro estudio observamos una frecuencia elevada de casos en monoterapia con rosiglitazona que presentan anemia. De hecho, el 58% de los casos en los que se presenta dicha relación rosiglitazona-anemia se producen en monoterapia (12 casos).
Esta RA hematológica se considera frecuente (1,9%), con disminución del hematocrito alrededor de un 3,3% y descensos de hemoglobina de 1 g/dL. Su aparición se produce en los tres primeros meses de tratamiento o al aumentar la dosis de rosiglitazona. Se suele asociar a hemodilución (26) y no suele reportar gravedad ni consecuencias clínicas (59). Existen estudios en los que también se ha asociado el tratamiento con rosiglitazona con una reducción de los niveles de hemoglobina dosis-dependiente (60).
En otros estudios se recalca la asociación entre la anemia y el aumento del riesgo de complicaciones diabéticas -incluyendo nefropatía, retinopatía, neuropatía y enfermedad macrovascular-; por lo que consideran que esta RA puede ser significativa en la determinación de la evolución tras un fallo cardiaco y del daĖo orgánico inducido por hipoxia en casos de diabetes. El fallo renal en la síntesis de eritropoyetina parece un factor fundamental en su aparición (61).
Para la prevención de esta RA se recomienda un control óptimo, tanto metabólico como de presión arterial. Además, la detección de anemia puede utilizarse para identificar a pacientes con diabetes que tengan mayor riesgo de sufrir resultados clínicos adversos según los estudios consultados (61).
INSULINAS EN POLITERAPIA
Existe una baja frecuencia de coincidencias entre los principios activos más sospechosos. Esto se debe, en parte, a que el grupo de notificaciones en las que aparece insulina en politerapia -bien con otro tipo de insulina o bien con otros fármacos no antidiabéticos- es el segundo menos numeroso. Aun así, destacan la relación detemir-aspart y, en especial, la relación glargina-shock hipoglucémico contrastando con la mayor frecuencia de glargina-hiperglucemia observada en monoterapia.
Insulinas rápidas combinadas con insulinas intermedias/prolongadas: hipoglucemias e hiperglucemias. Se observa una relación de insulinas intermedias o prolongadas con insulinas rápidas, siempre con un análogo implicado en esa asociación. El perfil 3.1 sería el más ajustado a esta situación, con insulina glargina como principal análogo de acción prolongada sospechoso, y en el que se producen RAs en personas jóvenes o adultas. Los otros dos perfiles no se adaptan a esta descripción ya que se caracterizan por presentar sólo un principio activo sospechoso en la mayor parte de los casos.
Estas combinaciones de insulinas rápidas-prolongadas que destacamos coinciden con una mayor presencia de notificaciones de insulinas de acción rápida y de acción prolongada en combinación con al menos otro principio activo.
Tras considerar los resultados del gráfico de red y de los perfiles de insulina en politerapia, podemos concluir que el segundo principio activo suele ser, frecuentemente, otra insulina. Creemos que esta mayor notificación en la que se implican insulinas de acción prolongada y rápida se debe a la implementación de las recomendaciones de su uso combinado en tratamientos intensivos (62, 63), al haber demostrado estos mejoras en el control glucémico (64, 65), observándose tanto en pacientes con diabetes tipo 1 como con diabetes tipo 2 (66, 67).
Este estricto control puede llevar a la aparición de episodios de descompensación glucémica con su consiguiente riesgo. De hecho, hemos observado en nuestros resultados que, entre los casos mortales, los dos únicos en los que estaban implicadas insulinas presentan asociación de insulina rápida (aspart) con insulinas bifásicas (lispro+lispro protamina) y/o prolongadas (glargina o detemir). En uno de los casos se produce coma diabético y en el otro se producen malformaciones congénitas.
Por otro lado, algunos autores han estudiado la tendencia a usar la mezcla de insulina aspart con insulina detemir en la misma jeringa como régimen habitual para minimizar el número de inyecciones diarias -especialmente en niĖos con diabetes tipo 1- que va en contra de las advertencias del laboratorio fabricante. Sus resultados constatan que tal práctica produce un efecto adverso debido al descenso acusado del pico de acción de la insulina aspart y a la prolongación de su duración de acción frente a la administración separada de aspart y detemir (68).
Debemos puntualizar que, en nuestro país durante el periodo de estudio, no existen presentaciones en vial para insulina detemir, pero sí para insulina glargina. En la ficha técnica de glargina se indica que no se puede mezclar con otra insulina o diluirse ya que puede cambiar su tiempo/perfil de acción y la mezcla puede precipitar (69), mientras que en la ficha técnica de aspart (vial) se indica que sólo puede mezclarse con insulina NPH (70).
En nuestra base de datos no aparece ningún caso en el que se administre insulina aspart e insulina de acción prolongada ambas en viales por lo que la práctica comentada no parece muy extendida en EspaĖa. Aun así debería estudiarse si la administración al mismo tiempo y en una zona cercana de ambas insulinas –aunque no sea en la misma jeringa- puede alterar el perfil farmacodinámico de la insulina de acción rápida pudiendo generar hiperglucemias. Así por ejemplo, en el perfil 3.1, además de las reacciones en la zona de inyección características de las insulinas prolongadas se detecta hiperglucemia. Este perfil también se caracteriza por presentar casos graves (el 5,1% son mortales).
El perfil 3.2 es poco frecuente, se da mayoritariamente en hombres -tanto jóvenes como adultos- en tratamiento con insulina regular+isofánica o detemir, y se dan casos graves aunque la mayoría no mortales. Lo llamativo es la presencia de insulinas, vitaminas y agentes modificadores de los lípidos como fármacos no sospechosos. Respecto a los dos últimos, no hemos encontrado ninguna interacción conocida. Los casos de hiperglucemia los consideramos asociados al uso de insulina regular+isofánica o detemir para cubrir las necesidades de insulina durante la noche con posibilidad de producirse hiperglucemias matutinas.
Respecto al perfil 3.3 hay que destacar que se produce en pacientes de mayor edad en los que está implicada glargina como único fármaco sospechoso, siendo la mitad de los casos graves y mortales. Es contradictorio que entre los fármacos considerados no sospechosos se encuentren otras insulinas, cuando la RA más frecuentemente observada en este perfil es la hipoglucemia, por lo que creemos que debía haberse tenido en cuenta en la notificación. Esto explicaría por qué en la red de enlaces destaca la relación glargina-shock hipoglucémico, cuando en monoterapia glargina se relaciona más frecuentemente con hiperglucemia.
En este perfil también observamos casos que concuerdan con RAs de tipo alérgico inherentes a la utilización de insulina, como son la formación de anticuerpos anti-insulina que producen una disminución del efecto farmacológico y de la respuesta terapéutica (26, 69).
Combinaciones de análogos de lispro. Son casos en los que se observa asociación entre insulina lispro con insulinas intermedias (isofánica) o bifásicas (lispro+lispro protamina). Según su ficha técnica, la insulina de acción rápida lispro sólo está autorizada para su uso en combinación con insulina de acción prolongada o sulfonilureas (71). Es por ello que pensamos en la existencia de un uso combinado incorrecto con este análogo de acción rápida.
Insulina, irbesartán e hidroclorotiazida. Respecto a la asociación entre irbesartán e hidroclorotiazida observada en determinados casos donde también se utiliza insulina, hemos descubierto que tal asociación se debe a una codificación imprecisa. En la base de datos original, siempre que aparecen los principios activos irbesartán e hidroclorotiazida lo hacen porque el paciente toma una combinación a dosis fija (código C02F2), a pesar de ello, se codifican por separado. Al realizar la actualización de los códigos ATC observamos que no existe un código concreto para esta combinación -en el índice ATC/DDD 2011 (72, 73) la única posibilidad de nombrar correctamente este tipo de formulación sería asignándole el código de ‘Irbesartán y diuréticos C09DA04’ en el que no se especifica el diurético de la combinación-. Es por ello que, al igual que en la base de datos original, también adjudicamos un código a cada principio activo por separado, motivo por el que aparecen relacionados en la red de enlaces. Este es un ejemplo de la relevancia que pueden tener algunos defectos en la notificación a tener en cuenta en estudios posteriores.
A pesar de lo comentado, y dado que la combinación de insulina e hidroclorotiazida (combinada o no con irbesartán) existe en la base de datos, queremos hacer hincapié en la posible inhibición del efecto hipoglucemiante de la insulina en presencia de diuréticos tiazídicos, interacción ampliamente conocida (26). En nuestros datos no hemos observado ninguna RA hiperglucémica en presencia de insulina e hidroclorotiazida.
AHOs EN POLITERAPIA
Hemos observado pocos casos en los que coincidan las asociaciones de principios activos independientemente de la posición de sospecha que ocupe el AHO, es decir, en los que coincidan combinaciones del perfil 4 y del perfil 5.
El perfil 4 se caracteriza por presentar AHOs notificados en primera posición de sospecha (según la clasificación preliminar, ver Método) y donde los principios activos notificados en segunda posición también han sido AHOs en su mayoría, situándose por delante de otros fármacos no antidiabéticos. Es llamativa la aparición de la relación metformina-hipoglucemia y metformina-acidosis, no observadas en monoterapia. A continuación comentamos estas y otras de las relaciones más relevantes observadas en este perfil 4:
Metformina y sulfonilureas. Se sabe que la acción antihiperglucemiante de metformina presenta efecto sinérgico con las sulfonilureas, de hecho está indicada su combinación en adultos. Esta sinergia puede desencadenar fenómenos de hipoglucemia que la metformina por sí sola no suele producir (26). El perfil 4.1 es el único que presenta como sospechoso de RA el uso concomitante de metformina y sulfonilureas; y se caracteriza por producir casos no graves, mayoritariamente en mujeres, y en edades entre los 65 y 74 aĖos. Es especialmente interesante el alto porcentaje de casos observados en Galicia, concordando con el ya comentado mayor uso de glibenclamida en monoterapia en esta región en el perfil 2.2.
Adicionalmente, hemos observado una mayor relación entre metformina y glibenclamida (20 registros) que entre metformina y glimepirida (4 registros). Nuestros resultados coinciden tanto con estudios en los que las combinaciones de glimepirida o gliclazida con metformina presentan menor riesgo (en concreto, menor mortalidad) que la combinación de glibenclamida con metformina (74); como con otros estudios que demuestran que la combinación de glimepirida+metformina –en este caso a dosis fija-es más eficaz que glibenclamida+metformina en la consecución de los objetivos glucémicos, al reducir el número de episodios de hipoglucemia en pacientes diabéticos tipo 2 no controlados (75).
Estas combinaciones de sulfonilureas y metformina han sido ampliamente recomendadas (76-79) y aplicadas en el tratamiento antidiabético en EspaĖa (19, 22, 25), aunque en nuestro país sólo se presentan en formulaciones separadas. Teniendo en cuenta el impulso actual de las formulaciones de combinaciones a dosis fijas -debido a la simplificación de la dosificación y posible mejora del cumplimiento terapéutico-, creemos que la combinación metformina+glimepirida podría ser una opción terapéutica interesante.
Según nuestros resultados, el número de notificaciones correspondientes a terapia combinada de sulfonilureas y metformina es bajo (117 casos) comparado con las notificaciones respectivas de estos fármacos en monoterapia.
Esto contrasta con estudios que valoran la terapia combinada de sulfonilureas y metformina como la más ampliamente utilizada (más del 67% de los usuarios de AHOs a nivel internacional), debido a una aplicación de metformina como fármaco suplementario en tratamientos con sulfonilureas u otros AHOs (43), por lo que, en estos casos, cabría esperar una mayor proporción de RAs.
En el 84% de los casos de nuestro estudio donde se notifican metformina y sulfonilureas, también aparecen notificados otros principios activos. De hecho, entre los casos mortales, hemos observado con mayor frecuencia combinaciones de metformina con sulfonilureas y con otros AHOs (3 casos), que combinación de los dos primeros exclusivamente (1 caso).
A propósito del único caso mortal donde los fármacos implicados son metformina y glibenclamida, observamos que sólo se considera sospechoso al fármaco metformina cuando ninguna de las RAs registradas es específica de este principio activo (el caso presenta acidosis metabólica, anuria, hipoglucemia, hipotensión y malestar general; sin presencia de acidosis láctica). A su vez, ambos tratamientos -metformina y glibenclamida- fueron concomitantes, por lo que la hipoglucemia generada podría asociarse más al uso combinado que al efecto de metformina por sí sola (26). Por tanto, creemos recomendable que en casos con desenlace mortal, todos aquellos medicamentos concomitantes con posibilidad de producir alguna de las RAs notificadas, sean considerados sospechosos o, en su defecto, sospechosos por interacción.
En términos generales, y aun teniendo en cuenta el riesgo de hipoglucemia asociado a las sulfonilureas y su efecto sinérgico con metformina, creemos que el uso combinado de ambos fármacos ha tenido buenos resultados durante los aĖos de estudio en lo referido a seguridad (sólo 19 casos donde aparece la combinación de sulfonilurea y metformina sin ningún otro fármaco). En cambio, en el resto de notificaciones con sulfonilureas, AHOs y terceros principios activos, el riesgo de sufrir una RA parece estar más asociado a dicha combinación con terceros que a RAs específicas de los principios activos. Por lo tanto, las politerapias de más de dos AHOs parecen presentan mayores riesgos de seguridad en detrimento de su potencial efecto sinérgico para la consecución de un buen control glucémico.
Metformina y acidosis. En nuestro estudio, la presencia de acidosis (diferente de acidosis láctica) como RA relacionada con metformina en casos de politerapia –cuando no se ha observado en monoterapia-, lleva a pensar en la influencia del resto de medicación en su aparición. De hecho, existen estudios recientes sobre casos de acidosis inducida por metformina debida a RAs con otros fármacos (80). Sería interesante que, en estos casos, se registrase si ha habido RAs previas y, si así fuese, notificar los fármacos implicados como sospechosos por interacción, lo que facilitaría el estudio de seĖales.
Glitazonas y metformina. Hemos observado el mismo número de relaciones entre rosiglitazona y metformina que entre pioglitazona y metformina en las notificaciones donde estos fármacos se consideraban sospechosos y se administran en formulaciones independientes.
Tampoco hemos observado diferencias entre la notificación de glitazonas combinadas con metformina en formulaciones separadas y la de glitazonas sin combinar con metfomina.
En cambio, considerando las notificaciones con glitazonas+metformina a dosis fijas (un 51% del total de casos con glitazonas), existe una mayor frecuencia de la combinación con rosiglitazona (94%) que con pioglitazona (6%).
Si consideramos tanto la administración por separado como la combinación a dosis fija, observamos mayor frecuencia de notificación en mujeres entre los tratados con rosiglitazona y metformina (tanto por separado como combinados a dosis fija), y mayor frecuencia en hombres para pioglitazona y metformina. Esto último concuerda con algunos estudios en los que se indica que los hombres tienen más probabilidad de ser tratados con glitazonas que las mujeres (81).
Para el resto de combinaciones a dosis fijas de glitazonas, sólo se observan ligeras diferencias en la aparición de RAs según el género para los hombres tratados con rosiglitazona+glimepirida.
Respecto al uso combinado de glitazonas y otros fármacos no antidiabéticos, observamos mayor frecuencia de tratamiento con estatinas entre los que toman glitazonas y mayor frecuencia de tratamiento con IECAs entre los que toman AHOs diferentes a glitazonas. Estos resultados difieren en parte con estudios donde se indica que los pacientes en tratamiento con glitazonas tienen más probabilidad de estar tratándose con medicamentos cardioprotectores, -tanto estatinas como IECAs- que en cualquier otro grupo de pacientes tratados con AHOs, aunque puntualizan que las diferencias se limitan a fármacos recomendados como prevención primaria en la mayoría de diabéticos, mientras que la prescripción de otros medicamentos cardioprotectores es similar (81).
También llama la atención que en alrededor de un 75% de las notificaciones en las que aparecen combinadas glitazonas, estatinas y/o IECAs, los pacientes estaban siendo tratados con combinaciones a dosis fijas de glitazonas y metformina. Esto nos lleva a plantearnos si el uso de combinaciones a dosis fijas favorece el aumento del número de fármacos en politerapia, y si esto tiene implicaciones en la seguridad del tratamiento, ya que la administración por separado de una glitazona y metformina parece haber resultado más segura.
Metformina y fármacos del Sistema Nervioso. El perfil 4.2. se da mayoritariamente en mujeres y en la edad adulta (entre los 55 y 64 aĖos), siendo el fármaco sospechoso metformina. Es interesante la presencia de fármacos del sistema nervioso, aunque aparezcan como no sospechosos. Algunos de ellos pertenecen al subgrupo de ansiolíticos (N05B) y al de hipnóticos y sedantes (N05C). Existen estudios donde también se ha observado un mayor consumo de antidepresivos y ansiolíticos en mujeres diabéticas, situación que junto a una mayor utilización de AINEs y otros analgésicos, podría sugerir que las mujeres diabéticas tienen peor calidad de vida (6, 82). De hecho, en general las mujeres declaran tener peor estado de salud que los hombres (83).
Metformina y fármacos del Sistema Cardiovascular. El perfil 4.3 se caracteriza por la combinación de metformina con fármacos no sospechosos. Esta combinación puede darse con pocos fármacos en la mayoría de los casos, o bien con muchos fármacos en algunos casos aislados. Entre dichos fármacos no sospechosos, los del sistema cardiovascular se presentan con frecuencia. A pesar de la politerapia existente en este perfil, las RAs son mayoritariamente gastrointestinales, no revisten gravedad y no están asociadas con trastornos del metabolismo o alteraciones cardiovasculares. Creemos que el hecho de darse este perfil fundamentalmente en mujeres, y entre los 65 y 74 aĖos, puede influir en la reducida presencia de RAs cardiovasculares debido a que este grupo de pacientes presenta menores factores de riesgo asociados que los hombres. Así, por ejemplo, se sabe que uno de los factores de riesgo cardiovascular como es el tabaquismo es menor en mujeres de edad avanzada con diabetes tipo 2 (7).
Respecto a las diferencias entre géneros, según cifras oficiales de la ENS, el sobrepeso y la obesidad en EspaĖa es mayor en hombres que en mujeres (83); y también es conocido que la obesidad en pacientes diabéticos se relaciona con mayor aparición de complicaciones macrovasculares, peor control metabólico y peor cumplimiento del tratamiento (84). A su vez, las mujeres refieren más controles preventivos frente a factores de riesgo cardiovascular como son la hipertensión arterial o la hipercolesterolemia que los hombres (83).
Glibenclamida y enalapril. Según nuestros resultados, habría 19 casos donde aparecen relacionados glibenclamida y enalapril, con presencia de hipoglucemia en 4 de ellos -dos casos son graves aunque ninguno es mortal-. En algunas de estas notificaciones de hipoglucemia se considera enalapril como fármaco sospechoso por interacción y en otros como no sospechoso, cuando se conoce que la asociación entre sulfamidas hipoglucemiantes e IECAs en un paciente diabético puede producir, excepcionalmente, hipoglucemia. Es una RA que también puede presentarse con otros IECAs -como captopril-, y con otros hipoglucemiantes -como la sulfonilurea gliclazida o la propia insulina (85). También se sabe que este fenómeno es más probable que ocurra durante las primeras semanas de tratamiento combinado y en pacientes con insuficiencia renal (86).
Sería recomendable que en la ficha técnica de glibenclamida (87), además de la indicación general sobre su interacción con inhibidores de la ECA, se indicara que se ha observado con enalapril y captopril.
Glibenclamida y acarbosa. Sólo hemos encontrado un caso con hipoglucemia en el que estaban implicadas glibenclamida y acarbosa exclusivamente. Aunque la acarbosa posee un efecto antihiperglucemiante, sin ser hipoglucemiante por sí misma, en pacientes tratados con otros AHOs o insulina pueden producirse casos de shock hipoglucémico (85). El conocimiento de dicha interacción es reciente (87, 88), y puede que esto haya evitado un mayor uso combinado de ambos principios activos, influyendo positivamente en una mejora del perfil de seguridad. En relación al restablecimiento de la glucemia en estos casos, en la ficha técnica de glibenclamida se recomienda la ‘toma de glucosa’ en vez de ‘preferiblemente en forma de glucosa’, o bien, se podría especificar que debe utilizarse sólo glucosa si el paciente usa acarbosa como tratamiento concomitantemente.
El PERFIL 5 se caracteriza por presentar AHOs notificados en otras posiciones de sospecha (segunda posición o siguientes). Se observan combinaciones de un número elevado de fármacos sospechosos, siendo entre ellos casi una constante la presencia de fármacos del sistema cardiovascular combinados con diferentes AHOs. Como caso llamativo destaca la relación metformina-rivastigmina en la que se produce náuseas y pirexia.
Profundizando más, el perfil 5.1 se caracteriza por presentar -tanto en hombres como mujeres- trastornos de la piel y del tejido subcutáneo no graves. En cambio, en el perfil 5.2, se observan RAs graves que ocurren mayoritariamente en hombres y que afectan al metabolismo y la nutrición, al sistema sanguíneo y linfático, y al sistema respiratorio y torácico. El perfil 5.3 se desmarca de los anteriores por presentar menos fármacos sospechosos y ser predominante en mujeres. En este último perfil se registran RAs graves no mortales debidas a trastornos del metabolismo y la nutrición y trastornos gastrointestinales. A continuación comentamos las relaciones más relevantes observadas en este perfil 5:
Antihipertensivos y metformina. Dentro de los tratamientos antihipertensores que aparecen más relacionados con metformina, se encuentran los principios activos enalapril (IECA) y valsartán (ARA-II) pertenecientes ambos al tratamiento cardiovascular. Son agentes que ejercen su acción antihipertensora actuando en el sistema renina-angiotensina. Debido a que metformina presenta eliminación por vía renal, en su ficha técnica se recomienda tener especial cuidado en situaciones en las que la función renal pueda estar afectada como puede ser al iniciarse un tratamiento antihipertensor, diurético o con AINEs (48). En caso de llegar a una situación de insuficiencia renal podría producirse una acumulación plasmática de metformina, dando lugar a acidosis láctica (47). Es por ello que se recomienda estimar el aclaramiento de creatinina antes de iniciarse el tratamiento con metformina y regularmente desde su inicio (1 vez al aĖo en pacientes con función renal normal, de 2 a 4 veces en pacientes con aclaramiento de creatinina próximo al límite inferior del valor normal y en pacientes de edad avanzada) (48). También se recomienda no administrar metformina en pacientes con niveles de creatinina sérica superiores a 1,5 mg/dl en hombres o 1,4 mg/dl en mujeres (47).
Nuestros resultados demuestran la presencia de metformina y enalapril y/o valsartán (entre otros principios activos notificados) en 47 casos. En 5 de ellos aparecen ambos fármacos como sospechosos, y en 3 se presenta como RA insuficiencia renal (IR) -2 con resultado de muerte por acidosis e insuficiencia renal por lo que concuerda con las características indicadas anteriormente-. Debido a que el porcentaje de aparición de IR no es muy elevado (6%), creemos que las recomendaciones sobre el uso combinado de metformina y antihipertensivos parecen aplicarse. A su vez, si la IR se ha notificado como RA significa que no era una condición preexistente en el paciente, por lo que generaría sospecha sobre el tratamiento farmacológico, y como tal debería aparecer en la bibliografía. En los tres casos donde aparece IR el antihipertensivo implicado es enalapril.
Teniendo en cuenta la elevada proporción de mortalidad entre los casos que desarrollaron IR (preexistente o por RA), sería oportuno incluir información al respecto en el apartado de RAs de las ficha técnicas de formulaciones con metformina –además de la existente en advertencias y precauciones- (48), a semejanza de como aparece en el Catálogo de Especialidades Farmacéuticas (47); y que se valore el estudio de la potencialidad de generar IR por tratamiento con metformina y antihipertensivos en pacientes sin IR preexistente.
Rivastigmina y metformina. Relación relevante es la observada entre los principios activos metformina y rivastigmina (fármaco antidemencia), y estos, a su vez, con RAs de náuseas y pirexia. Esta combinación de fármacos aparece en 3 casos, de los cuales 2 tienen desenlace mortal. En estos casos mortales ambos principios activos, junto con otros notificados secundariamente, son considerados fármacos sospechosos.
No hemos encontrado ninguna referencia respecto a la relación entre metformina y rivastigmina (47). Debido a la gravedad de los casos en los que aparece, sería interesante estudiar esta posible interacción (o RA), en pacientes diabéticos de edad avanzada. Este hecho puede adquirir aún más relevancia con el tiempo, debido a que los pacientes diabéticos alcanzan cada vez edades más avanzadas en las que, a su vez, existe mayor incidencia de Alzheimer y Parkinson pudiendo verse afectados por estas RAs debido a su medicación con rivastigmina.
En los dos casos mortales con metformina-rivastigmina, se ha observado como RAs malestar general, náuseas y pirexia, esta triada podría utilizarse como sintomatología que precisara sobreseguimiento. Estas tres RAs notificadas aparecen en la ficha técnica de rivastigmina (89); en el caso de metformina sólo las náuseas. Aun así, las náuseas y los vómitos son RAs frecuentes observadas con rivastigmina y con metformina, especialmente durante la fase de adaptación al tratamiento. Puede darse un efecto sinérgico por parte de ambos fármacos en la aparición de estas RAs, las cuales desencadenarían estados de deshidratación aguda, situación que puede aumentar, a su vez, el riesgo de sufrir acidosis láctica (44). Hay que indicar que en ambos casos mortales también hubo uso concomitante de fármacos derivados de dihidropiridina (bloqueantes de canales de calcio con efectos cardiovasculares) y estatinas sin especificarse el principio activo.
Acenocumarol y glibenclamida. En nuestros resultados obtenemos relación entre glibenclamida –sulfonilurea- y acenocumarol -antagonista de vitamina K con acción antitrombótica-. La interacción con riesgo de hipoglucemia entre sulfonilureas y anticoagulantes orales es conocida (19, 20, 26), pudiendo llegar eventualmente a coma hipoglucémico, cuando se producen administraciones concomitantes de algunos antagonistas de la vitamina K -dicumarol, acenocumarol, warfarina- con determinadas sulfonilureas -tolbutamida/clorpropamida, clorpropamida, y glibenclamida, respectivamente- (85). En caso de tener que usarlos combinados se recomienda vigilar los parámetros de coagulación (tiempo de protrombina –TP- e International Normalized Ratio –INR-). En la ficha técnica de acenocumarol se indica que este puede potenciar el efecto hipoglucemiante de los derivados sulfoniluréicos sin especificar ninguno; así como que algunas sulfonilureas -como tolbutamida o clorpropamida- pueden, a su vez, potenciar el efecto anticoagulante del acenocumarol (90). Otros autores consideran que las interacciones asociadas con anticoagulantes orales son generalizables a las indicadas para warfarina (34).
Entre nuestros datos hay 13 casos con tratamiento de glibenclamida y acenocumarol. Sólo hay hipoglucemia en dos casos y el acenocumarol no se considera sospechoso. En cambio, en los 3 casos donde se identifican RAs hemorrágicas tanto acenocumarol como glibenclamida son considerados sospechosos por interacción.
Dado que en algunas referencias advierten de las interacciones cruzadas de determinadas sulfonilureas y anticoagulantes, mientras que en otras se hace la advertencia respecto al grupo al que pertenecen sin especificar principios activos, sería adecuado que donde se presenten sulfonilureas y acenocumarol implicados en casos con hipoglucemias, se notificase el acenocumarol como sospechoso por interacción.
Antidiabéticos y terapia preventiva cardiovascular. Según las recomendaciones internacionales, en pacientes diabéticos que presentan hipertensión, es necesaria la politerapia de 2 o más agentes antihipertensivos (IECA/ARAII, diuréticos) (91). A su vez, en caso de que los pacientes diabéticos tengan más de cuarenta aĖos o algún factor de riesgo (hipertensión, dislipemia, riesgo cardiovascular, historia familiar de enfermedad cardiovascular, tabaquismo), se recomienda el uso de estatinas y antiagregantes plaquetarios (91).
En nuestros resultados hay 258 casos con tratamiento antihipertensivo (IECA o ARAII), de los que 13 presentan trastornos cardiovasculares como RA (5,0 %). Entre los pacientes diabéticos con tratamiento antihipertensivo, hay 82 con tratamiento hipolipemiante (estatinas), de los que 4 presentan trastornos cardiovasculares (4,8%). De los pacientes diabéticos con tratamiento antihipertensivo e hipolipemiante, 33 tienen tratamiento antiagregante, de los que 1 presenta trastorno no cardiaco (3,0%). Si además de tratamiento antidiabético, antihipertensivo, hipolipemiante y antiagregante tienen tratamiento adicional de diuréticos, nos encontramos con 9 casos donde ninguno presenta trastornos cardiovasculares.
Tras este desglose podríamos concluir que, en pacientes diabéticos, un mayor control de factores de riesgo cardiovascular parece eficaz en la reducción de aparición de RAs cardiovasculares. A su vez, este enfoque preventivo (antidiabéticos + IECA/ARAII + estatinas + antiagregantes + diuréticos) obliga a una politerapia mínima de 4-5 fármacos, que en contra de lo esperable, genera pocas RAs y, en general, no graves.
Simvastatina, hepatitis colestásica y AHOs. Observamos 2 casos donde se relacionan simvastatina y hepatitis colestásica en notificaciones de AHOs en politerapia. Simvastatina está contraindicada en hepatopatía activa o elevaciones persistentes de transaminasas séricas (85). A su vez, en su ficha técnica se recoge hepatitis como RA rara (92), aunque no se hace referencia expresa a la tipología colestásica que aparece en nuestros resultados, ni a que existan interacciones con hipoglucemiantes orales.
A pesar de ello, consideramos que un tratamiento concomitante antidiabético bien con riesgo de hepatitis reversible -como acarbosa (88) o metformina (48)-, bien con riesgo de hepatitis y colestasis que puedan derivar en fallo hepático -como glibenclamida (87)- puede aumentar el riesgo de aparición o la gravedad de la hepatitis colestásica por simvastatina. De hecho, glibenclamida también aparece relacionada con hepatitis colestásica en la red de enlaces.
Fármacos no antidiabéticos y RAs en presencia de AHOs. Hemos observado correlación de hipoglucemia con gemfibrozilo y con levofloxacino, y de erupción eritematosa con irbesartán.
En el caso de gemfibrozilo, es conocido su riesgo de producir hipoglucemia si se combina con hipoglucemiantes (85) –como es el caso-; y en especial con repaglinida (93). En nuestros resultados no llega a especificarse si se produce por combinación con este último fármaco.
Respecto a levofloxacino, hay advertencias -al igual que ocurre con todas las quinolonas-, del riesgo de hipoglucemia en pacientes que reciben tratamiento concomitante con agentes hipoglucemiantes orales -como glibenclamida- o insulina (85); y aparece recogida como RA en la ficha técnica de levofloxacino (94). En nuestros resultados parece más relacionada con AHOs, sin predominio de ninguno.
En el caso de irbesartán, no se registran reacciones cutáneas en la ficha técnica del fármaco para el 2009 (85) pero sí para el 2011 (95), aunque sólo se recoge como RA rara la erupción cutánea, no se indica eritematosa. Sería interesante observar si tratamientos concomitantes con riesgo de eritema –como repaglinida (96)- pueden influir en su aparición.
COMBINACIONES DE INSULINAS Y AHOs EN POLITERAPIA
Las asociaciones obtenidas presentan frecuencias muy bajas comparadas con los grupos analizados anteriormente, lo que significa que hay una gran variabilidad entre los casos. La única asociación de fármacos que aparece más de una vez es metformina-repaglinida, quedando notificada la insulina en posiciones de menor relevancia.
En este grupo de politerapia, a semejanza de los anteriores de Insulinas y AHOs considerados por separado, se repite el predominio de hipoglucemia en su asociación con glargina o con metformina, cuando, en monoterapia, glargina se asocia con más frecuencia a hiperglucemia, y metformina por sí sola no causa hipoglucemia. Se puede deducir que la influencia de otros fármacos concomitantes es la causa de dicha hipoglucemia, y que el hecho de que glargina o metformina no aparezcan relacionadas con principios activos concretos es signo de la variedad de tratamientos que pueden estar implicados.
En cambio, aparece la relación entre pioglitazona y la RA vértigo, que aun siendo poco frecuente según se registra en su ficha técnica (97), es bastante específica de este principio activo.
En el perfil 6.1, metformina es el fármaco sospechoso aunque se presenta combinado con todo tipo de fármacos –insulinas, IECAs, antiagregantes- considerados no sospechosos, mientras que las RAs notificadas no son específicas de metformina.
La situación de variabilidad que comentábamos es más observable en el perfil 6.2. Los fármacos sospechosos pueden ser insulina glargina o metformina o repaglinida, siendo así el único perfil de todo el estudio donde las notificaciones agrupadas no presentan elementos comunes. Esta situación, en contra de parecer una limitación del método, permite conocer que el modelo agrupa en un perfil todos los casos que considera atípicos, por lo tanto son más fácilmente identificables en caso de que ese fuese nuestro objetivo de estudio.
El perfil 6.3, es el único en el que se notifican insulinas y AHOs, y donde se considera más de un fármaco sospechoso. La insulina glargina destaca por ser el principal fármaco sospechoso, y la posibilidad de interacciones entre fármacos es elevada dada la variabilidad de combinaciones posibles entre antidiabéticos, analgésicos y antiinflamatorios, sedantes y anticoagulantes. A pesar de que los casos no fueron graves en su mayoría, consideramos especialmente la afectación del sistema nervioso.
A continuación comentamos las relaciones más relevantes observadas en el perfil 6:
Metformina, sulfonilurea e insulina. Resulta interesante que, en casos en los que se utiliza insulina, no se presenten metformina y sulfonilureas como los dos primeros fármacos sospechosos de RAs. Esto puede significar, por un lado, que el escalón de tratamiento basado en una terapia triple parece seguro; y contrasta con el número de casos de RAs donde la asociación metformina+sulfonilureas estaba presente sin utilizarse insulina, por lo que sería de esperar que hubiese más notificaciones al aĖadir esta última al tratamiento.
Por otro lado, esto puede significar que este enfoque terapéutico (metformina + sulfonilurea + insulina nocturna) no es muy utilizado, a pesar de recogerse en todos los algoritmos de tratamiento recomendados, tanto nacionales (19, 22, 25), como internacionales (76-79, 79, 98).
Si tomamos en conjunto las observaciones del perfil 6 -ausencia de RAs con uso asociado de metformina+sulfonilureas+insulina-, y las del perfil 4 -donde vemos más RAs asociadas a uso combinado de metformina y sulfonilureas o metformina y glitazonas, sin presencia de insulina-; y las contrastamos con los algoritmos de tratamiento indicados anteriormente, podemos deducir que en EspaĖa se ha tendido más hacia una triple terapia con AHOs que a complementar el tratamiento de metformina o de metformina-sulfonilurea con la insulinización temprana. Este hecho se contrapone con la recomendación adicional al algoritmo de tratamiento de diabetes tipo 2 realizada por el consenso ADA/EASD -y que se mantiene actualmente-, donde se indica que aunque se pueden usar tres AHOs, el inicio y la intensificación de la terapia con insulina es preferible en términos de efectividad y gasto (76).
Esta deducción sobre la ausencia de insulinización tardía, también se apoya en los pocos casos de RAs observados donde los fármacos sospechosos principales son metformina e insulina de acción prolongada glargina (1 caso), por lo que parece no haber sido un tratamiento muy extendido. Lo mismo ocurriría con el tratamiento insulínico intensivo combinado con metformina (1 caso de tratamiento con glulisina y metformina).
Metformina, repaglinida e insulina. Observamos notificaciones en las que se asocia metformina + repaglinida + insulina en el perfil 6 (insulinas+AHOs), mientras que en el perfil 4 (combinaciones de AHOs) no destacaba la asociación metfomina-repaglinida.
Según las guías nacionales, en casos donde las sulfonilureas estén contraindicadas o si los pacientes realizan comidas irregulares puede sustituirse las sulfonilureas por glinidas (22). Estas últimas sólo son consideradas como una opción terapéutica según el consenso ADA/EASD en casos concretos debido a su menor efectividad hipoglucemiante y su coste (76). Es probable que en los casos donde las sulfonilureas se descartan, la opción de insulinización se considere antes, debido a un control glucémico deficiente con las glinidas.
Insulinas y glitazonas. Hemos observado tres casos de edema (dos periféricos y un angioedema) en los que están implicados como sospechosos pioglitazona e insulina (detemir, glargina o lispro-lispro protamina). La insulina detemir es la única que no se consideraba sospechosa.
Es conocido que la administración concomitante de insulina y pioglitazona, ambas asociadas con la retención hídrica, puede aumentar el riesgo de edema y dicha situación exacerbar o precipitar la insuficiencia cardiaca (41, 97).
Según la ficha técnica de pioglitazona, su uso requiere un seguimiento de signos y síntomas de insuficiencia cardiaca, aumento de peso o edema; tanto en pacientes con al menos un factor de riesgo como en pacientes que combinen pioglitazona e insulina (97). Las mismas advertencias respecto al riesgo de insuficiencia cardiaca por dicho tratamiento combinado se recogen en la ficha técnica de insulina detemir (41).
Algunos autores incluso consideran contraindicado el uso de pioglitazona en combinación con insulina en cualquier circunstancia tras ocurrir casos de fallo cardiaco en presencia de esta combinación (85).
También observamos dos notificaciones de insuficiencia cardiaca en las que aparecen rosiglitazona e insulina (aspart-aspart protamina o glargina). De las dos insulinas, únicamente glargina se considera sospechosa por interacción -aunque en su ficha técnica sólo se recoge el riesgo de insuficiencia cardiaca con pioglitazona, no con rosiglitazona (69)-; mientras que aspart-aspart protamina -con idénticas indicaciones (99)- no se considera sospechosa por interacción en nuestros datos.
Debido a lo anterior, en los casos donde se notifica edema y los pacientes están tratados con glitazonas e insulina, estas últimas deberían registrarse siempre como sospechosas o sospechosas por interacción, y los pacientes deberían sobreseguirse por su posible riesgo de insuficiencia cardiaca.
Glimepirida, acarbosa e insulina. Hay dos casos de hipoglucemia y asociación de glimepirida y acarbosa como fármacos sospechosos, y exclusivamente en uno de ellos aparece también insulina como sospechosa. Sólo se advierte del riesgo hipoglucemiante de esta asociación en la ficha técnica de acarbosa (88) pero no en la de glimepirida explícitamente (100), a semejanza de lo que ya indicamos en el caso de glibenclamida y acarbosa.
6. limitaciones del estudio
Respecto a los resultados en casos de politerapia, al ajustar el modelo a tres perfiles por grupo, cada perfil está constituido por un número elevado de casos, y las observaciones que se derivan de ellos son más inespecíficas que en los perfiles de monoterapia. Hemos comprobado que si se permite que el modelo adapte los datos a tantos perfiles como fuesen necesarios se obtienen resultados mucho más específicos aunque desproporcionadamente amplios para su tratamiento detallado en el presente trabajo.
7. cOnclusiones
En monoterapia:
- los casos de hiperglucemia asociada a los análogos de insulina corresponderían a disminuciones del nivel de insulina, no a hiperglucemias de rebote;
- los análogos de acción prolongada producirían más reacciones en la zona de inyección por una administración inadecuada;
- la diarrea y acidosis láctica por metformina predominaron en Aragón y CataluĖa, respectivamente, en mujeres mayores de 65 aĖos; estas RAs parecen limitar el uso de metformina en EspaĖa;
- en Galicia existe una posible infrautilización de metformina frente a sulfonilureas; los pacientes –mujeres entre 65 y 74 aĖos- suelen presentar hipoglucemias no graves;
- la detección de anemia en monoterapia con rosiglitazona podría haber facilitado la identificación de pacientes en riesgo de sufrir resultados clínicos adversos.
En politerapia:
- existe un posible uso incorrecto de insulina lispro combinada con insulinas intermedias (isofánica) o bifásicas (lispro+lispro protamina);
- la administración por separado de metformina y glitazonas parece ser más segura;
- existe riesgo de aparición de insuficiencia renal con metformina y antihipertensivos;
- puede producirse hepatitis colestásica por simvastatina en presencia de acarbosa, metformina o glibenclamida;
- existe un posible efecto sinérgico de metformina y rivastigmina en la producción de náuseas y pirexia en pacientes diabéticos de edad avanzada;
- sólo en politerapia se observaron asociaciones de glargina-shock hipoglucémico, metformina-hipoglucemia y metformina-acidosis (no láctica);
- fueron más frecuentes las RAs a rosiglitazona/metformina en mujeres y a pioglitazona/metformina en hombres;
- la terapia cardiovascular parece segura y eficaz en la reducción de aparición de RAs cardiovasculares en pacientes diabéticos;
- en EspaĖa se tiende hacia una triple terapia con AHOs con más riesgo de producir RAs, en vez de complementar el tratamiento de metformina o de metformina-sulfonilurea con la insulinización temprana.
El modelo aplicado ha demostrado ser válido para detectar tanto características comunes entre los casos como casos atípicos. La obtención de perfiles de pacientes diabéticos que sufren reacciones adversas a medicamentos presenta aplicaciones para prever acontecimientos en el seguimiento post-comercialización de fármacos tanto tradicionales como nuevos.
8. agradecimientos
Trabajo financiado por la Junta de Castilla y León y el Fondo Social Europeo.
9. rEFERENCIaS
1. Carvajal A.: Introducción a la Farmacoepidemiología: Concepto, Historia, Métodos y Fuentes de Datos. En Farmacoepidemiología; Carvajal A, ed.; Secretariado de Publicaciones, Universidad de Valladolid; Valladolid, 1993; p 11-24.
2. Sánchez A, García A, Carvajal A.: Notificación voluntaria de reacciones adversas a los medicamentos. En Farmacoepidemiología; Carvajal A, ed.; Secretariado de Publicaciones, Universidad de Valladolid; Valladolid, 1993; p 61-74.
3. Lindquist M, Edwards IR, Bate A, et al. From association to alert--a revised approach to international signal analysis. Pharmacoepidemiol Drug Saf 8 Suppl 1, S15-S25 (1999).
4. Capellą D, Laporte JR.: La notificación espontánea de reacciones adversas a medicamentos. En Principios de epidemiología del medicamento; Laporte JR, Tognoni G, eds.; Masson-Salvat Medicina; Barcelona, 1983; p 147-70.
5. Manso G, Hidalgo A, Carvajal A, et al., editores. Los primeros 25 aĖos del Sistema EspaĖol de Farmacovigilancia de Medicamentos de Uso Humano. Oviedo: Servicio de Publicaciones de la Universidad de Oviedo, 2010.
6. Fornos JA, Fernández M, García P, et al. Análisis de la utilización de medicamentos por pacientes diabéticos en la provincia de Pontevedra. Av Diabetol 26, 47-52 (2010).
7. Sender Palacios MJ, Vernet VM, Larrosa SP, et al. Características sociodemográficas y clínicas de una población de pacientes con diabetes mellitus. Aten Primaria 29, 474-80 (2002).
8. Madurga M, Lázaro F, Martín-Serrano G, et al.: El Sistema EspaĖol de Farmacovigilancia de Medicamentos de Uso Humano: su historia en cifras. En Los primeros 25 aĖos del Sistema EspaĖol de Farmacovigilancia de Medicamentos de Uso Humano; Manso G, Hidalgo A, Carvajal A et al., eds.; Servicio de Publicaciones de la Universidad de Oviedo; Oviedo, 2010; p 31-46.
9. Instituto de Información Sanitaria.Ministerio de Sanidad y Política Social. Notificación de reacciones adversas a medicamentos por cada 1.000 habitantes. Base de datos de Indicadores Clave del Sistema Nacional de Salud (INCLASNS-BD). [acceso 12.12.2011]. Disponible en: http://www.msc.es/estadEstudios/estadisticas/sisInfSanSNS/inclasSNS_DB.htm
10. SPSS Inc.: Understanding Data Mining. En SPSS Clementine ® 12.0 User's Guide; SPSS Inc; Chicago, IL, 2007; p 33-45.
11. WHO Collaborating Centre for Drug Statistics Methodology, Norwegian Institute of Public Health. ATC. Structure and principles [acceso 12.02.2010]. Disponible en: http://www.whocc.no/atc/structure_and_principles/
12. Sistema EspaĖol de Farmacovigilancia de Medicamentos de Uso Humano. Base de datos FEDRA (Farmacovigilancia EspaĖola, Datos de Reacciones Adversas) 2000-2008. Agencia EspaĖola del Medicamento.
13. División de Farmacoepidemiología y Farmacovigilancia. Subdirección General de Seguridad de Medicamentos, Agencia EspaĖola de Medicamentos y Productos Sanitarios. Aceptación de los Criterios y Normas de utilización de los datos de la base de datos FEDRA del Sistema EspaĖol de Farmacovigilancia: SEFV/1/CT y SEFV/2/CT.
14. División de Farmacoepidemiología y Farmacovigilancia. Subdirección General de Seguridad de Medicamentos, Agencia EspaĖola de Medicamentos y Productos Sanitarios. Criterios para la utilización de los datos de la base de datos FEDRA del Sistema EspaĖol de Farmacovigilancia (SEFV/1/CT).
15. División de Farmacoepidemiología y Farmacovigilancia. Subdirección General de Seguridad de Medicamentos, Agencia EspaĖola de Medicamentos y Productos Sanitarios. Normas para la correcta interpretación y utlización de los datos del Sistema EspaĖol de Farmacovigilancia (SEFV/2/CT).
16. Instituto Nacional de Estadística (INE). Encuesta Nacional de Salud 2006 [acceso 03.02.2010]. Disponible en: http://www.ine.es/jaxi/menu.do?type=pcaxis&path=/t15/p419&file=inebase&L=0
17. International Conference on Harmonisation (ICH). MedDRA ® Term Selection: Points to consider. ICH-Endorsed Guide for MedDRA Users [acceso 03.04.2011]. Disponible en: http://www.meddramsso.com/files_acrobat/ptc/9491-1310_TermSelPTC_R4.0_sep2010.pdf
18. Carvajal A, Montero D. MedDRA: una terminología para la armonización en materia de medicamentos. ICB digital 10, 1-4 (2002).
19. Consejo General de Colegios Oficiales de Farmacéuticos., editores. Plan Estratégico para el desarrollo de la Atención Farmacéutica '10. Guía de Atención Farmacéutica al paciente diabético. Madrid: Consejo General de Colegios Oficiales de Farmacéuticos, 2010.
20. Murillo MD, Fernández-Llimós F, Tuneu L, editores. Guía de seguimiento farmacoterapéutico sobre diabetes. Granada: Espai Grąfic Anagrafic, S.L, 2004.
21. Menéndez E, Lafita J, Artola S, et al. Recomendaciones para el tratamiento farmacológico de la hiperglucemia en la diabetes tipo 2. Documento de consenso. Av Diabetol 26, 331-8 (2010).
22. Grupo de Trabajo de la Guía de Práctica Clínica sobre Diabetes tipo 2, editores. Guía de Práctica Clínica sobre Diabetes tipo 2. Madrid: Plan Nacional para el SNS del MSC. Agencia de Evaluación de Tecnologías Sanitarias del País Vasco: 2008.
23. Sociedad EspaĖola de Diabetes. Guías de práctica clínica: FMC - Protocolo DM2 en AP (2000) [acceso 12.08.2010]. Disponible en: http://www.sediabetes.org/gestor/upload/file/00003582archivo.pdf
24. Franch J, Goday A, Mata M. Proyecto COMBO. Actualización 2004. Criterios y pautas de terapia combinada en la diabetes tipo 2. Av Diabetol 20, 77-112 (2004).
25. del Olmo González E, Carrillo Pérez M, Aguilera Gumpert S. Actualización del tratamiento farmacológico de la diabetes mellitus tipo 2. Inf Ter Sis Nac Salud 32, 3-16 (2008).
26. Consejo General de Colegios Oficiales de Farmacéuticos. Catálogo de Especialidades Farmacéuticas. Madrid: Colegio de Farmacéuticos; 1998-2009.
27. Lázaro Bengoa E. Manual de usuario FEDRA ® 2.0 (Alta de notificaciones).
28. Matute P, Merello J, Lara R, editores. Curso de farmacovigilancia para profesionales sanitarios. Medical Dynamics, 2003.
29. Chang M.: Data mining and Signal Detection. En Modern Issues and Methods in Biostatistics. Statistics for Biology and Health.; Gail M, Krickeberg K, Samet J et al., eds.; Springer; New York, 2011; p 205-32.
30. SPSS Inc.: Graph Nodes. En SPSS Clementine ® 12.0 Source, Process, and Output Nodes; SPSS Inc; Chicago, IL, 2007; p 173-273.
31. SPSS Inc.: Clustering Models. En SPSS Clementine ® 12.0 Modeling Nodes; SPSS Inc; Chicago, IL, 2007; p 254-83.
32. SPSS Inc.: Kohonen Algorithms. En SPSS Clementine ® 12.0 Algorithms Guide; SPSS Inc; Chicago, IL, 2007; p 67-71.
33. Kohonen T. Self-organizing neural projections. Neural Netw 19, 723-33 (2006).
34. Martindale: The complete drug reference. London: Pharmaceutical Press, 2009.
35. Massi BM, Humburg E, Dressler A, et al. A one-year, randomised, multicentre trial comparing insulin glargine with NPH insulin in combination with oral agents in patients with type 2 diabetes. Horm Metab Res 35, 189-96 (2003).
36. Carroll MF, Schade DS. The dawn phenomenon revisited: implications for diabetes therapy. Endocr Pract 11, 55-64 (2005).
37. Rybicka M, Krysiak R, Okopien B. The dawn phenomenon and the Somogyi effect - two phenomena of morning hyperglycaemia. Endokrynol Pol 62, 276-84 (2011).
38. Ceruelo-Bermejo J, Miranda-Hidalgo R, García-Ortiz A, et al. Insulina detemir. Hoja Informativa de Medicamentos-Sacylime 1, 1-2 (2005).
39. CADIME, EASP. Insulina glargina (DCI). Ficha de novedad terapéutica 1-2 (2006).
40. CADIME, EASP. Insulina detemir (DCI). Ficha de novedad terapéutica 1-2 (2006).
41. European Medicines Agency (EMEA). Levemir®: EPAR-Product information [acceso 10.01.2012]. Disponible en: http://www.ema.europa.eu/docs/en_GB/document_library/EPAR_-_Product_Information/human/000528/WC500036662.pdf
42. Torlone E, Di CG, Mannino D, et al. Insulin analogs and pregnancy: an update. Acta Diabetol 46, 163-72 (2009).
43. International Diabetes Federation, editores. IDF Diabetes Atlas. Brussels, Belgium: International Diabetes Federation, 2006.
44. Spiller HA, Sawyer TS. Toxicology of oral antidiabetic medications. Am J Health Syst Pharm 63, 929-38 (2006).
45. Comisión de Farmacia y Terapéutica del Hospital Alarcos (Ciudad Real). Alerta sobre seguridad de metformina: riesgo grave de acidosis láctica [acceso 20.06.2007]. Disponible en: http://sescam.jccm.es/web1/profesionales/farmacia/usoRacional/documentos/VI_05_RiesgoGraveAcidosisLactica.pdf
46. UK Prospective Diabetes Study (UKPDS) Group. Effect of intensive blood-glucose control with metformin on complications in overweight patients with type 2 diabetes (UKPDS 34). Lancet 352, 854-65 (1998).
47. Consejo General de Colegios Oficiales de Farmacéuticos. Catálogo de Especialidades Farmacéuticas. Madrid: Colegio de Farmacéuticos; 2009.
48. Agencia EspaĖola de Medicamentos y Productos Sanitarios. Dianben 850mg®. Ficha técnica [acceso 24.02.2012]. Disponible en: http://www.aemps.gob.es/cima/especialidad.do?metodo=verFichaWordPdf&codigo=55211&formato=pdf&formulario=FICHAS&file=ficha.pdf
49. Redondo Capafons S, Garriga Riosca MR, Pla Poblador R. Seguimiento de la utilización de metformina en la población de riesgo. Farm Hosp 29, 364-6 (2005).
50. Hirst JA, Farmer AJ, Ali R, et al. Quantifying the effect of metformin treatment and dose on glycemic control. Diabetes Care 35, 446-54 (2012).
51. El-Hennawy AS, Jacob S, Mahmood AK. Metformin-associated lactic acidosis precipitated by diarrhea. Am J Ther 14, 403-5 (2007).
52. Holstein A, Plaschke A, Egberts EH. Lower incidence of severe hypoglycaemia in patients with type 2 diabetes treated with glimepiride versus glibenclamide. Diabetes Metab Res Rev 17, 467-73 (2001).
53. Consejo General de Colegios Oficiales de Farmacéuticos. A10BB. Sulfonilureas y productos relacionados. Catálogo de Especialidades Farmacéuticas. Madrid, Consejo de Farmacéuticos; 2008. p.407.
54. Elizondo-López-de-Landache I, Braceras-Izaguirre L. Evolución de datos de consumo de antidiabéticos orales correspondientes al grupo terapéutico A10B a través de receta médica oficial en la Comunidad Autónoma del País Vasco en el periodo 2000-octubre 2007. Gac Med Bilbao 106, 41-3 (2009).
55. McIntosh A, Hutchinson A, Home PD, et al., editores. Clinical guidelines and evidence review for Type 2 diabetes: management of blood glucose. Sheffield: ScHARR, University of Sheffield. 2001.
56. Cano Blanquer D, San Martín Ciges MD. Utilización de antidiabéticos en un área de salud urbana y otra rural de la provincia de Valencia. FAP 3, 105-17 (2005).
57. Reimundez G and Real M. El estudio ADVANCE, el más amplio realizado hasta ahora en diabéticos Tipo 2, muestra que el control intensivo de la glucosa reduce en un 10% las complicaciones macro y microvasculares asociadas a esta patología. Nota de prensa. Disponible en: http://www.accesomedia.com/display_release.html?id=47178
58. Patel A, MacMahon S, Chalmers J, et al. Intensive blood glucose control and vascular outcomes in patients with type 2 diabetes. N Engl J Med 358, 2560-72 (2008).
59. Shvidel L, Arcavi L, Sigler E. Symptomatic anemia induced by rosiglitazone. Eur J Intern Med 18, 348 (2007).
60. European Medicines Agency (EMEA). Avandia®: EPAR-Product information [acceso 10.01.2012]. Disponible en: http://www.ema.europa.eu/docs/es_ES/document_library/EPAR_-_Product_Information/human/000268/WC500029108.pdf
61. Thomas MC, Cooper ME, Rossing K, et al. Anaemia in diabetes: Is there a rationale to TREAT? Diabetologia 49, 1151-7 (2006).
62. The Diabetes Control and Complications Trial Research Group. The effect of intensive treatment of diabetes on the development and progression of long-term complications in insulin-dependent diabetes mellitus. N Engl J Med 329, 977-86 (1993).
63. UK Prospective Diabetes Study (UKPDS) Group. Intensive blood-glucose control with sulphonylureas or insulin compared with conventional treatment and risk of complications in patients with type 2 diabetes (UKPDS 33). Lancet 352, 837-53 (1998).
64. DeWitt DE, Hirsch IB. Outpatient insulin therapy in type 1 and type 2 diabetes mellitus: scientific review. JAMA 289, 2254-64 (2003).
65. CADIME - Escuela Andaluza de Salud Pública. Nuevas insulinas. Boletín Terapéutico Andaluz 22, 17-9 (2006).
66. Martin CL, Albers J, Herman WH, et al. Neuropathy among the diabetes control and complications trial cohort 8 years after trial completion. Diabetes Care 29, 340-4 (2006).
67. American Diabetes Association. Standards of medical care in diabetes--2008. Diabetes Care 31 Suppl 1, S12-S54 (2008).
68. Cengiz E, Swan KL, Tamborlane WV, et al. The Alteration of Aspart Insulin Pharmacodynamics When Mixed With Detemir Insulin. Diabetes Care (2012).
69. European Medicines Agency (EMEA). Lantus®: EPAR-Product information [acceso 03.01.2012]. Disponible en: http://www.ema.europa.eu/docs/es_ES/document_library/EPAR_-_Product_Information/human/000284/WC500036082.pdf
70. European Medicines Agency (EMEA). Novorapid®: EPAR-Product information [acceso 10.01.2012]. Disponible en: http://www.ema.europa.eu/docs/es_ES/document_library/EPAR_-_Product_Information/human/000258/WC500030372.pdf
71. European Medicines Agency (EMEA). Humalog®: EPAR-Product information [acceso 10.10.2011]. Disponible en: http://www.ema.europa.eu/docs/es_ES/document_library/EPAR_-_Product_Information/human/000088/WC500050332.pdf
72. WHO Collaborating Centre for Drug Statistics Methodology, Norwegian Institute of Public Health. ATC/DDD Index [acceso 16.03.2011]. Disponible en: http://www.whocc.no/atc_ddd_index/
73. WHO Collaborating Centre for Drug Statistics Methodology, Norwegian Institute of Public Health. List of DDDs combined products [acceso 20.05.2011]. Disponible en: http://www.whocc.no/ddd/list_of_ddds_combined_products/
74. Monami M, Luzzi C, Lamanna C, et al. Three-year mortality in diabetic patients treated with different combinations of insulin secretagogues and metformin. Diabetes Metab Res Rev 22, 477-82 (2006).
75. Gonzalez-Ortiz M, Guerrero-Romero JF, Violante-Ortiz R, et al. Efficacy of glimepiride/metformin combination versus glibenclamide/metformin in patients with uncontrolled type 2 diabetes mellitus. J Diabetes Complications 23, 376-9 (2009).
76. Nathan DM, Buse JB, Davidson MB, et al. Management of hyperglycemia in type 2 diabetes: A consensus algorithm for the initiation and adjustment of therapy: a consensus statement from the American Diabetes Association and the European Association for the Study of Diabetes. Diabetes Care 29, 1963-72 (2006).
77. Nathan DM, Buse JB, Davidson MB, et al. Management of hyperglycemia in type 2 diabetes: a consensus algorithm for the initiation and adjustment of therapy: update regarding thiazolidinediones: a consensus statement from the American Diabetes Association and the European Association for the Study of Diabetes. Diabetes Care 31, 173-5 (2008).
78. Nathan DM, Buse JB, Davidson MB, et al. Medical management of hyperglycemia in type 2 diabetes: a consensus algorithm for the initiation and adjustment of therapy: a consensus statement of the American Diabetes Association and the European Association for the Study of Diabetes. Diabetes Care 32, 193-203 (2009).
79. National Collaborating Centre for Chronic Conditions, editores. Type 2 diabetes: national clinical guideline for management in primary and secondary care (update). London: Royal College of Physicians, 2008.
80. Schier JG, Hoffman RS, Nelson LS. Metformin-induced acidosis due to a warfarin adverse drug event. Ann Pharmacother 37, 1145 (2003).
81. Gomes T, Juurlink DN, Lipscombe LL, et al. Clinical and demographic characteristics of patients receiving different oral hypoglycemic agents. Pharmacoepidemiol Drug Saf 18, 756-60 (2009).
82. Fornos JA, Patricia García G, Fernández M, et al. Evaluación del conocimiento, el cumplimiento y la satisfacción del tratamiento en pacientes diabéticos en la oficina de farmacia. Av Diabetol 24, 399-406 (2008).
83. Instituto Nacional de Estadística (INE). Mujeres y hombres en EspaĖa 2008-2010 [acceso 03.10.2011]. Disponible en: http://www.ine.es/ss/Satellite?L=es_ES&c=INEPublicacion_C&cid=1259924822888&p=1254735110672&pagename=ProductosYServicios%2FPYSLayout&tittema=Sociedad
84. Dilla T, Costi M, Boye KS, et al. El impacto de la obesidad en el manejo y evolución de la diabetes mellitus. Rev Clin Esp 208, 437-43 (2008).
85. UBM Medica. Vademecum de medicamentos, sustancias, principios activos, dopaje, interacciones, equivalencias internacionales y laboratorios farmacéuticos de EspaĖa [acceso 14.12.2011]. Disponible en: http://www.vademecum.es/
86. Agencia EspaĖola de Medicamentos y Productos Sanitarios. Acetensil®. Ficha técnica [acceso 24.12.2011]. Disponible en: http://www.aemps.gob.es/cima/especialidad.do?metodo=verFichaWordPdf&codigo=58116&formato=pdf&formulario=FICHAS&file=ficha.pdf
87. Agencia EspaĖola de Medicamentos y Productos Sanitarios. Daonil®. Ficha técnica [acceso 24.12.2011]. Disponible en: http://www.aemps.gob.es/cima/especialidad.do?metodo=verFichaWordPdf&codigo=48545&formato=pdf&formulario=FICHAS&file=ficha.pdf
88. Agencia EspaĖola de Medicamentos y Productos Sanitarios. Glucobay®. Ficha técnica [acceso 24.02.2012]. Disponible en: http://www.aemps.gob.es/cima/especialidad.do?metodo=verFichaWordPdf&codigo=59420&formato=pdf&formulario=FICHAS&file=ficha.pdf
89. European Medicines Agency (EMEA). Exelon®: EPAR-Product information [acceso 10.01.2012]. Disponible en: http://www.ema.europa.eu/docs/es_ES/document_library/EPAR_-_Product_Information/human/000169/WC500032598.pdf
90. Agencia EspaĖola de Medicamentos y Productos Sanitarios. Sintrom®. Ficha técnica [acceso 24.12.2011]. Disponible en: http://www.aemps.gob.es/cima/especialidad.do?metodo=verFichaWordPdf&codigo=58994&formato=pdf&formulario=FICHAS&file=ficha.pdf
91. American Diabetes Association. Standards of medical care in diabetes--2009. Diabetes Care 32 Suppl 1, S13-S61 (2009).
92. Agencia EspaĖola de Medicamentos y Productos Sanitarios. Zocor®. Ficha técnica [acceso 24.02.2012]. Disponible en: http://www.aemps.gob.es/cima/especialidad.do?metodo=verFichaWordPdf&codigo=58846&formato=pdf&formulario=FICHAS&file=ficha.pdf
93. Agencia EspaĖola de Medicamentos y Productos Sanitarios. Nota informativa 2003/07. Contraindicación del uso concomitante de repaglinida y gemfibrozilo [acceso 05.06.2008]. Disponible en: http://www.aemps.gob.es/informa/notasInformativas/medicamentosUsoHumano/seguridad/2003/NI_2003-07_repaglinida-gemfibrozilo.htm
94. Agencia EspaĖola de Medicamentos y Productos Sanitarios. Tavanic®. Ficha técnica [acceso 24.02.2012]. Disponible en: http://www.aemps.gob.es/cima/especialidad.do?metodo=verFichaWordPdf&codigo=62065&formato=pdf&formulario=FICHAS&file=ficha.pdf
95. European Medicines Agency (EMEA). Aprovel®: EPAR-Product information [acceso 10.01.2012]. Disponible en: http://www.ema.europa.eu/docs/es_ES/document_library/EPAR_-_Product_Information/human/000141/WC500025752.pdf
96. European Medicines Agency (EMEA). Novonorm®: EPAR-Product information [acceso 10.01.2012]. Disponible en: http://www.ema.europa.eu/docs/es_ES/document_library/EPAR_-_Product_Information/human/000187/WC500029905.pdf
97. European Medicines Agency (EMEA). Actos®: EPAR-Product information [acceso 10.01.2012]. Disponible en: http://www.ema.europa.eu/docs/es_ES/document_library/EPAR_-_Product_Information/human/000285/WC500021386.pdf
98. Sibal L, Home PD. Management of type 2 diabetes: NICE guidelines. Clin Med 9, 353-7 (2009).
99. European Medicines Agency (EMEA). Novomix®: EPAR-Product information [acceso 10.01.2012]. Disponible en: http://www.ema.europa.eu/docs/es_ES/document_library/EPAR_-_Product_Information/human/000308/WC500029441.pdf
100. Agencia EspaĖola de Medicamentos y Productos Sanitarios. Amaryl®. Ficha técnica [acceso 24.12.2011]. Disponible en: http://www.aemps.gob.es/cima/especialidad.do?metodo=verFichaWordPdf&codigo=61409&formato=pdf&formulario=FICHAS&file=ficha.pdf
APÉNDICE
1a. Análisis de red de enlaces. Frecuencias de correlación en monoterapia
GRUPO |
principio activo |
término preferente RAM |
nľ de enlaces |
GRUPO 1. Notificaciones con Insulina en monoterapia |
A10AD05 |
Hiperglucemia |
7 |
A10AE05 |
Reacción en la zona de inyección |
5 |
|
A10AC01 |
Hipoglucemia |
5 |
|
A10AE04 |
Hiperglucemia |
5 |
|
A10AE05 |
Erupción eritematosa |
3 |
|
A10AE04 |
Hipoglucemia |
3 |
|
A10AE04 |
Reacción en la zona de inyección |
3 |
|
A10AD05 |
Respuesta terapéutica disminuida |
3 |
|
A10AD01 |
Hiperglucemia |
2 |
|
A10AE04 |
Erupción eritematosa |
2 |
|
A10AD05 |
Prurito |
2 |
|
A10AE04 |
Diabetes mellitus |
2 |
|
A10AC01 |
Hiperglucemia |
2 |
|
GRUPO 2. Notificaciones con AHO en monoterapia |
A10BA02 |
Diarrea |
60 |
A10BA02 |
Acidosis láctica |
28 |
|
A10BB01 |
Hipoglucemia |
20 |
|
A10BA02 |
Dolor abdominal |
11 |
|
A10BA02 |
Dispepsia |
10 |
|
A10BA02 |
Náuseas |
10 |
|
A10BB12 |
Hipoglucemia |
9 |
|
A10BG02 |
Anemia |
6 |
|
A10BF01 |
Diarrea |
6 |
|
A10BA02 |
Mareo |
6 |
1b. Análisis de red de enlaces. Frecuencias de correlación en politerapia
GRUPO |
principio activo sospechoso posición 1 |
principio activo sospechoso posición 2 |
término preferente RAM posición 1 |
término preferente RAM posición 2 |
nľ de enlaces |
GRUPO 3. Notificaciones con Insulina/s y principios activos no antidiabéticos |
A10AE05 |
A10AB05 |
- |
- |
3 |
A10AC01 |
- |
Hipoglucemia |
- |
2 |
|
A10AD04 |
A10AB04 |
- |
- |
2 |
|
A10AE04 |
- |
Shock hipoglucémico |
- |
2 |
|
A10AB04 |
A10AC01 |
- |
- |
2 |
|
C09CA04 |
C03AA03 |
- |
- |
2 |
|
GRUPO 4. Notificaciones con AHO/s y principios activos no antidiabéticos. AHO en primera posición |
A10BA02 |
A10BB01 |
- |
- |
11 |
A10BB01 |
- |
Hipoglucemia |
- |
11 |
|
A10BA02 |
- |
Diarrea |
- |
11 |
|
A10BB01 |
A10BA02 |
- |
- |
9 |
|
- |
A10BA02 |
Hipoglucemia |
- |
8 |
|
A10BA02 |
- |
Hipoglucemia |
- |
8 |
|
A10BA02 |
- |
Acidosis láctica |
- |
7 |
|
- |
A10BB01 |
Hipoglucemia |
- |
7 |
|
A10BA02 |
A10BB12 |
- |
- |
4 |
|
A10BG03 |
A10BA02 |
- |
- |
3 |
|
A10BG02 |
A10BA02 |
- |
- |
3 |
|
A10BB12 |
- |
Hipoglucemia |
- |
3 |
|
- |
A10BB12 |
Hipoglucemia |
- |
3 |
|
A10BB01 |
C09AA02 |
- |
- |
3 |
|
A10BA02 |
- |
- |
Acidosis |
3 |
|
GRUPO 5. Notificaciones con AHO/s y principios activos no antidiabéticos. Principio activo no antidiabético en primera posición |
- |
A10BB01 |
Hipoglucemia |
- |
5 |
B01AA07 |
A10BB01 |
- |
- |
4 |
|
- |
A10BA02 |
- |
Náuseas |
3 |
|
C09AA02 |
A10BA02 |
- |
- |
3 |
|
C10AB04 |
- |
Hipoglucemia |
- |
3 |
|
- |
A10BB01 |
Hepatitis colestásica |
- |
2 |
|
C09CA03 |
A10BA02 |
- |
- |
2 |
|
C09CA04 |
- |
Erupción eritematosa |
- |
2 |
|
C10AA01 |
- |
Hepatitis colestásica |
- |
2 |
|
J01MA12 |
- |
Hipoglucemia |
- |
2 |
|
N06DA03 |
A10BA02 |
- |
- |
2 |
|
N06DA03 |
- |
Pirexia |
2 |
||
N06DA03 |
- |
- |
Náuseas |
2 |
|
- |
A10BA02 |
Pirexia |
- |
2 |
|
- |
- |
Pirexia |
Náuseas |
2 |
|
GRUPO 6: Notificaciones con combinaciones de Insulina/s y AHO/s |
A10BA02 |
A10BX02 |
- |
- |
2 |
- |
A10BA02 |
Hipoglucemia |
- |
2 |
|
A10AE04 |
- |
Hipoglucemia |
- |
2 |
|
A10BG03 |
- |
Vértigo |
- |
2 |
2. Ejemplo de ficha-resumen estructurada. Información obtenida para el perfil 1.1:
PERFIL 1.1 |
|||||
DATOS DE LA NOTIFICACIÓN |
|||||
52 notificaciones x=0, y=0 |
Género: |
mujer -> 59,62% |
Gravedad: |
no -> 100% |
|
Edad (aĖos): |
≥ 75 -> 21,15% |
Mortal: |
- |
||
CCAA: |
CataluĖa -> 17,31% |
||||
AĖo: |
2006 -> 23,08% |
||||
PRINCIPIOS ACTIVOS (PAs) |
|||||
PA1 |
ATC 4: |
A10AE -> 40,38% |
|||
ATC 5: |
A10AE05 -> 26,92% |
||||
Sospecha: |
sospechoso -> 100% |
||||
Indicación terapéutica: |
Diabetes mellitus -> 67,31% |
||||
REACCIONES ADVERSAS (RAMs) |
|||||
RAM1 |
Órgano |
Trastornos generales y alteraciones en el lugar de administración -> 36,54% |
|||
RAM2 |
Órgano |
Trastornos de la piel y del tejido subcutáneo, Trastornos generales y alteraciones en el lugar de administración -> 31,58% |
|||
HltRAM |
Pruritus NCOC -> 15,79% |
||||
RAM3 |
Órgano |
Trastornos de la piel y del tejido subcutáneo -> 60% |
|||
HltRAM |
Pruritus NCOC -> 40% |
||||
PtRAM |
Prurito -> 40% |
||||
RELACIÓN CAUSAL- Algoritmo de Karch y Lasagna: |
5-8 probable -> 63,46% |
||||