Control hipotalámico de las interacciones neuroendocrinas
Blanca Lizarbe y Sebastián Cerdán*
Instituto de Investigaciones Biomédicas “Alberto Sols” CSIC/UAM, c/ Arturo Duperier 4. 28029
Madrid (EspaĖa).
e-mail: scerdan@iib.uam.es
Recibido el 27 de marzo de 2013 An. Real Acad. Farm. Vol 79, Nľ 1 (2013), pag. 90-110 FISIOLOGIA Y CONTROL CEREBRAL DEL COMPORTAMIENTO. Mesa Redonda celebrada en la Real Academia Nacional de Farmacia el día 29 de noviembre del 2012. Coordinadora: A. M. Pascual-Leone Académica de Número de la RANF.
RESUMEN
El hipotálamo juega en los mamíferos superiores un papel central en la integración de funciones vitales como la regulación del metabolismo energético global, la saciedad y el hambre, el control de la presión sanguínea y la temperatura corporal, la sed, hidratación y metabolismo salino del organismo, y las funciones testiculares y ováricas, entre otras. Muchas de estas funciones neuroendocrinas se realizan mediante el control del funcionamiento de la hipófisis, utilizando un complejo sistema de retroalimentación que modula la secreción de una gran variedad de hormonas hipofisarias con efectos sistémicos de vital importancia, incluyendo las hormonas tiroideas o la hormona del crecimiento, entre otras. El hipotálamo consta de aproximadamente una docena de subestructuras, conocidas como núcleos hipotalámicos, que se encargan de controlar los diversos procesos. Hasta muy recientemente no ha sido posible evaluar la función hipotalámica directamente in vivo, un aspecto que se resolvía mediante procedimientos indirectos como la determinación de cambios en el peso corporal, eliminación de líquidos, alteraciones en la termorregulación o desequilibrios en el perfil de hormonas en sangre. En esta revisión describiremos toda una nueva serie de métodos de imagen no invasiva para la evaluación directa de la función hipotalámica y su impacto potencial en nuestro conocimiento actual de la regulación de las interacciones neuroendocrinas, con especial referencia a la regulación hipotalámica del apetito in vivo. |
Palabras clave: Hipotálamo; Núcleos hipotalámicos; Control del apetito; Imagen por Resonancia Magnética; Espectroscopía por Resonancia Magnética.
ABSTRACT
Control of hypothalamic neuroendocrine interactions
The hypothalamus plays in higher mammals a central role in the integration of vital functions as the regulation of global energy metabolism, satiety and hunger, the control of blood pressure and body temperature, thirst, hydration and electrolyte metabolism, testicular and or ovarian functions, among others. Many of these neuroendocrine functions are performed through the control of the performance of the hypophysis, using a complex system of feed- back loops that modulate the secretion of large variety of hypophysary hormones with systemic effects of vital importance, including the thyroid and growth hormones, among others. The hypothalamus has approximately a dozen of substructures, known as hypothalamic nuclei, which control the different processes. Until very recently, it has not been possible to evaluate directly the hypothalamic function in vivo, an aspect solved through indirect measurements as the determination of bodyweight changes, liquid elimination and alterations in thermoregulation or disequilibria in the hormonal profiles in blood. In this review we shall describe a novel series of non-invasive imaging and spectroscopy methods for the direct evaluation of hypothalamic function and their potential impact on our current knowledge of neuroendocrine regulation, with special reference to the hypothalamic regulation of appetite in vivo. |
Keywords: Hypothalamus; Hypothalamic nuclei; Appetite control; Magnetic Resonance Imaging; Magnetic Resonance Spectroscopy.
1. Introducción
El hipotálamo es una pequeĖa estructura cerebral responsable del equilibrio homeostático de funciones sistémicas vitales como el metabolismo energético global, el apetito, la sed y la regulación osmótica, la termorregulación, los ritmos circadianos y algunas respuestas fundamentales para la supervivencia como la agresividad (1,2). La evaluación de su actividad fisiológica in vivo se ha realizado, hasta muy recientemente, empleando métodos indirectos como las medidas de peso corporal e ingesta de alimentos, o abordajes invasivos, midiendo concentraciones de hormonas en sangre o mediante la implantación de microelectrodos (3,4).
Los procedimientos no invasivos de evaluación de la función hipotalámica, han permanecido limitados hasta muy recientemente, por las dificultades impuestas en la adquisición de imágenes por las reducidas dimensiones del hipotálamo y por la complejidad de los procesos retroalimentación que subyacen a la función hipotalámica.
Las nuevas tecnologías de Resonancia Magnética proporcionan herramientas robustas que permiten superar estas limitaciones, habiendo proporcionado en la última década, resultados funcionales importantes sobre la fisiología hipotalámica in vivo (5,6).
En este contexto, resulta apropiado revisar el progreso adquirido hasta ahora y evaluar críticamente las ventajas e inconvenientes de cada abordaje.
El presente trabajo revisará la información generada mediante la aplicación al hipotálamo de técnicas de imagen y espectroscopía por Resonancia Magnética, proporcionando algunas recomendaciones para futuras aplicaciones.
Dada la diversidad de las funciones hipotalámicas, este trabajo se centrará principalmente en la regulación del apetito y metabolismo energético global, una de las funciones hipotalámicas con mayor repercusión fisiopatológica y socioeconómica.
Comenzaremos con una breve descripción de los mecanismos fisiológicos de control del apetito, para describir después las tecnologías MRI utilizadas en su evaluación, incluyendo BOLD (Blood Oxygenation Level Dependent contrast; Contraste basado en la oxigenación de la sangre), MEMRI (Manganese Enhanced Magnetic Resonance Imaging; Resonancia Magnética potenciada en captación de Mn2+) y DWI (Diffusion Weighted Magnetic Resonance Imaging; Resonancia magnética potenciada en difusión).
Terminaremos con una revisión crítica de las contribuciones de la espectroscopía por Resonancia Magnética, tanto in vivo como en el “ángulo mágico” (HRMAS; High Resolution Magic Angle Spinning) y una propuesta de actividades futuras.
2. Control hipotalámico del apetito
Nuestro conocimiento sobre los mecanismos hipotalámicos que regulan el apetito y la homeostasis energética ha progresado considerablemente en los últimos aĖos (7). El control del apetito se entiende, en el contexto actual, como el resultado de un complejo balance entre seĖales periféricas e intrahipotalámicas que controlan, a corto plazo, la sensación de hambre o saciedad, y a largo plazo, la regulación del peso corporal y balance energético (8).
Estos procesos parecen incluir además, la participación de otras estructuras cerebrales, corticales, límbicas y del tronco cerebral. Las principales seĖales periféricas son la leptina, una hormona producida en el tejido adiposo, y la insulina, una hormona proveniente del páncreas. Además, participan como seĖales del estado energético periférico, péptidos que provienen del estómago, como el péptido YY (PYY), la oxintomodulina (OXM), la grelina, el péptido análogo de glucagón 1 (GLP-1) y la colecistokininina (CKK). Estas seĖales pasan con facilidad la frágil barrera hematoencefálica del hipotálamo y, una vez allí, modulan la actividad catabólica (+) o anabólica (-) de los núcleos Arcuado (ARC), Ventromedial (VMN), Dorsomedial (DMN) y Paraventricular (PVN) (Figura 1). Estos controlan la ingesta de comida mediante procesos altamente evolucionados de “feed-back” o retroalimentación entre seĖales orexigénicas (de estimulación de apetito) y anorexigénicas (de saciedad) (9).
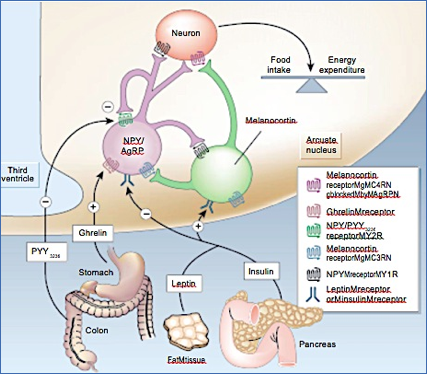
Figura 1.- Control hipotalámico del balance energético global. El apetito está regulado por un balance complejo que involucra seĖales endocrinas originadas en los tejidos periféricos y péptidos intrahipotalámicos. La leptina y la insulina inhiben las neuronas orexigénicas NPY/AgRP (morado) y estimulan las neuronas anorexigénicas de melacnocortina (verde), produciendo una disminución del apetito. La grelina o el pétido PYY3-36 inhiben las NPY/AgPR resultando en respuestas orexigénicas o anorexigénicas, respectivamente. Imagen obtenida de (10) y reproducida con permiso de la revista.
La Figura 1 resume estos procesos incluyendo, las hormonas leptina e insulina , que pueden tener distinto efecto dependiendo de su concentración en sangre, las seĖales periféricas con efectos orexigénicos (grelina) o anorexigénicos (PYY) (10) y los componentes de seĖalización intrahipotalámicos. Las cantidades de leptina e insulina circulan en sangre en función de la cantidad de grasa corporal y de los niveles de glucosa, respectivamente, llegando al hipotálamo a través del núcleo ARC, donde la barrera hematoencefálica (BBB) resulta altamente permeable. La llegada en exceso de estas seĖales inhibe la activación de las neuronas orexigénicas del Neuropeptido Y (NPY) y Agouti Related Peptide (AgRP) (color morado) y activa las neuronas anorexigénicas de melacortina (α-MSH) y del transcrito regulado por anfetamina (Cocaine-Anphetamine-Regulated Transcript; CART ) (en verde). Este balance tiene como consecuencia una disminución de la ingesta de comida (saciedad) y un incremento del gasto energético. Los niveles bajos de leptina e insulina en sangre promueven, en cambio, la activación de las neuronas orexigénicas y la inhibición de las anorexigénicas, produciendo un aumento de la sensación de hambre y un ahorro en el gasto energético.
La acción de la grelina y el péptido PYY3-36, segregados en el estómago y en el colon, respectivamente, proporcionan al núcleo ARC seĖales positivas (grelina) y negativas (PYY) que a corto plazo promueven sensaciones de hambre y saciedad, respectivamente, mediante la activación o inhibición selectiva de los grupos neuronales específicos del hipotálamo (11). A más largo plazo, los niveles altos de leptina e insulina en sangre pueden producir una desensibilización de sus receptores, originando fenómenos de resistencia a la insulina y/o leptina, aumentando los niveles de glucosa en plasma y la acumulación de lípidos, que pueden causar eventualmente diabetes y obesidad.
3. Estudios de MRI de la Regulación Hipotalámica del Apetito
Las técnicas de imagen más utilizadas en estudios de regulación del apetito in vivo son: BOLD, MEMRI y DWI. BOLD infiere la actividad neuronal en las regiones cerebrales activadas por los niveles de deoxihemoglobina paramagnética y los cambios en perfusión sanguínea (12,13). MEMRI utiliza la acumulación de Mn2+ paramagnético durante la activación neuronal, un fenómeno que refleja competitivamente la acumulación de Ca2+ durante los potenciales de acción (14). DWI detecta la activación neuronal por los cambios en los parámetros de difusión del agua, consecuencia de los flujos transcelulares de iones que ocurren durante la neurotransmisión (15), aunque también se han atribuido los cambios a la aparición de procesos inflamatorios relacionados con la obesidad (16,17).
A continuación, se proporciona una descripción detallada de la información conseguida con cada una de estas metodologías.
BOLD
BOLD es una de las técnicas más utilizadas para estudiar la actividad funcional del cerebro, tanto animales como en seres humanos. Se empleó para de detectar, a finales de los aĖos noventa, la respuesta del hipotálamo a administraciones de glucosa (18,19). En ambos estudios, uno con seres humanos y el otro con ratas, se administró glucosa a sujetos ayunados y se detectó una disminución significativa de la seĖal de resonancia en hipotálamo tras su administración. En el estudio con humanos, se comparó la atenuación de la seĖal entre personas obesas y personas no obesas, resultando la inhibición de las primeras mucho menor y demostrando in vivo por primera vez la existencia de una funcionalidad alterada en el hipotálamo de sujetos obesos.
Unos aĖos más tarde, se estableció la primera correlación de BOLD, como contraste de los centros de regulación del apetito en animales, con un marcador de activación neuronal muy establecido, c-Fos (20). Esta correlación se verificó un tiempo después (21), en un estudio en el que se comparó el efecto de la administración de 2-deoxy-D- glucosa en los núcleos hipotalámicos con mapas de actividad de c-Fos en los mismos. Desde entonces, el uso de la técnica BOLD para el estudio de la regulación del apetito en animales ha generado un número importante de contribuciones, sobre todo relacionadas con los efectos de activación hipotalámica tras la administración de diferentes dietas o péptidos (22,23).
En los estudios con seres humanos, se ha dedicado un esfuerzo considerable a estudiar la contribución de otras zonas cerebrales extrahipotalámicas a la regulación integral del apetito, utilizando estimulaciones del apetito mediante activaciones visuales (fotografías de comida) (24), o respuestas específicas a distintos sabores (25).
La Figura 2, ilustra una aplicación representativa de la imagen BOLD aplicada a un estudio de regulación del apetito. Este estudio monitorizó la actividad cerebral de voluntarios humanos tras visualizar fotografías de alimentos calóricos y no calóricos y de utensilios relacionados con la comida, pero no comestibles. Se encontraron áreas de activación comunes a los estímulos de comida, independientemente de su contenido calórico, como la amígdala o el hipocampo. Solamente las fotografías de alimentos de alto valor calórico activaron las zonas del hipotálamo, entre otras regiones.
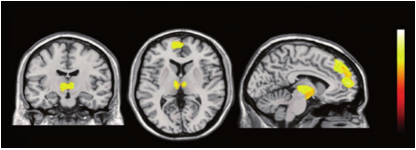 Figura 2.- Mapas paramétricos
estadísticos (SPM) de las regiones activadas en el cerebro humano, medidos con
BOLD, durante la visualización de imágenes de alto contenido calórico. La barra
de color refleja la escala de la estadística SPM utilizada para el análisis. La
corteza prefrontal y dorsolateral, el tálamo y el hipotálamo muestran
activación significativa (p<0.005) relativamente a la activación detectada
tras mostrar fotografías de utensilios no comestibles. Reproducido de (29) con
permiso del editor.
Figura 2.- Mapas paramétricos
estadísticos (SPM) de las regiones activadas en el cerebro humano, medidos con
BOLD, durante la visualización de imágenes de alto contenido calórico. La barra
de color refleja la escala de la estadística SPM utilizada para el análisis. La
corteza prefrontal y dorsolateral, el tálamo y el hipotálamo muestran
activación significativa (p<0.005) relativamente a la activación detectada
tras mostrar fotografías de utensilios no comestibles. Reproducido de (29) con
permiso del editor.
Estos estudios, demostraron que el apetito en seres humanos es el resultado de un complejo entramado de redes neuronales que incluye, además del hipotálamo y del tronco encefálico, regiones corticolímbicas y corticales. Esta múltiple regulación está relacionada aparentemente con los efectos cerebrales de recompensa a la ingesta de comida, con los estímulos del apetito presentes en el ambiente, y con otros factores cognitivos o incluso emocionales (26).
En este contexto, se han investigado con éxito las respuestas funcionales a seĖales orexigénicas y anorexigénicas en el cerebro humano. Estudios BOLD de administración del péptido PYY a voluntarios humanos sanos (27) con niveles altos de PYY en plasma indicaron que, como sucede en los estados alimentados, la activación cerebral de la corteza orbitofrontal caudolateral (OFC) predice la ingesta de comida. Por lo contrario, niveles bajos de PYY en plasma, como sucede en condiciones de ayuno, es la actividad hipotalámica la está correlacionada con la ingesta de comida. Así se pudo demostrar por primera vez que la presencia de una seĖal de saciedad post-ingesta cambia las zonas de activación cerebral.
Casi al mismo tiempo, en estudios de administración de grelina, una seĖal orexigénica (28) se pudo demostrar que la respuesta neuronal a estímulos visuales relacionados con el apetito era superior también en la zona OFC, y en otras regiones implicadas en la codificación de incentivos del apetito. En definitiva este trabajo demostró, que la presencia de seĖales metabólicas como la grelina podía favorecer el consumo de alimentos mediante la activación de zonas del sistema hedónico.
Más recientemente, las aplicaciones de BOLD en estudios de regulación del apetito cubren principalmente tres ámbitos: la respuesta hipotalámica a la glucosa en condiciones normales o patológicas (29,30), las diferencias en control cerebral de apetito en personas obesas (31), y los efectos de las hormonas y péptidos en la regulación del apetito(32-34).
MEMRI
La imagen MEMRI refleja de una forma directa y no invasiva la acumulación de Mn2+ en las neuronas activadas, a través de los canales de calcio dependientes del voltaje. Esta se extiende trans-sinápticamente, y permite la creación de mapas de conectividad neural por contraste de Mn2+ (35). Muy posiblemente, la acumulación de Mn2+ excede los tractos neuronales y se extiende hasta los astrocitos y redes de astrocitos circundantes, a través de las numerosas gap- junctions que existen entre los mismos (36). En particular, ha sido posible demostrar que la activación neuronal va acompaĖada de ondas intracelulares y extracelulares de Ca2+ (37,38). Los iones de Mn2+ presentan un radio iónico es muy similar al del Ca2+, por lo que pueden mimetizar muy adecuadamente y de manera competitiva las acumulaciones de Ca2+ durante la activación neuronal.
Sin embargo, en contraste con los iones Ca2+ que son diamagnéticos, los iones Mn2+ son paramagnéticos, por lo que inducen una reducción muy importante del tiempo de relajación T1 del agua, que resulta fácilmente detectable en imágenes de resonancia pesadas en T1. Así, las áreas de activación y acumulación de Mn2+ aparecen claramente más brillantes que las que no lo acumulan, en lo que se conoce como efecto MEMRI (Manganese Enhanced Magnetic Resonance Imaging) (39).
La técnica MEMRI presenta, sin embargo, una limitación importante, debido a que el Mn2+ presenta notables efectos neurotóxicos. Esto se debe a su competición con los flujos intracelulares de Ca2+, una circunstancia que termina por alterar procesos metabólicos vitales como el ciclo tricarboxílico, los intercambios neurogliales de los neurotransmisores glutamato o GABA y los niveles fisiológicos de metabolitos hipotalámicos (40-42). Por ello, MEMRI sólo puede ser utilizada hasta ahora en animales de experimentación.
A pesar de sus limitaciones, MEMRI se ha utilizado con éxito para detectar actividad cerebral en ratones, y su arquitectura y conectividad neuronal, desde el comienzo de los aĖos dos mil (43,44). Las primeras aplicaciones de MEMRI al estudio de la activación hipotalámica relacionada con el control apetito, aparecieron en 2006 (45,46).
En su trabajo, Kuo et al. compararon la activación detectada en hipotálamo de ratones alimentados o ayunados, encontrando regiones específicas de activación, y siendo los primeros en conseguir la entrada directa de Mn2+ sanguíneo al hipotálamo, sin necesitar de la rotura previa de la barrera hematoencefálica.
Por su parte, Chaudri et al. encontraron diferentes patrones de activación en el hipotálamo de ratones tras administrar oxintomodulina (OXM) y GLP-1, ambas hormonas anorexigénicas y generadas en el estómago. La administración de OXM produjo en una disminución del contraste en la imagen, indicando una disminución de la actividad neuronal, en los núcleos ARC, PVN y supraóptico del hipotálamo. GLP-1 causó, sin embargo, una disminución del contraste solamente en el PVN, y un incremento del mismo en el núcleo VMN. Este estudio mostró por primera vez cómo dos péptidos aparentemente similares podían tener distintos patrones de activación hipotalámica. Desde entonces, varios grupos han focalizado su trabajo a la aplicación de MEMRI para el estudio de la funcionalidad hipotalámica en la regulación del apetito; con estudios de administración de péptidos (47-49), activación cerebral en ratones transgénicos (50) y respuesta hipotalámica a alteraciones de ingesta de comida (51,52). Además, durante los últimos aĖos, el creciente interés en las aplicaciones de MEMRI y su posible interacción con diversos procesos hipotalámicos, ha generado la aparición de un número elevado de trabajos que combinan MEMRI con otras técnicas, sobre todo espectroscópicas con objeto de validar con MEMRI los diversos abordajes (50,53,40,54).
La Figura 3 muestra un ejemplo representativo de la utilización de MEMRI en el hipotálamo. Se trata de la comparación de la actividad neuronal de los núcleos hipotalámicos en ratones normales y ratones genéticamente obesos (ob/ob), en condiciones de alimentación ad libitum. En este estudio, se infundió Mn2+ en la vena de la cola de ratones control y de ratones obesos, deficientes en leptina, y se analizó la intensidad de seĖal resultante en los núcleos VMN (o VMH) y ARC, y la zona del cuarto ventrículo (V4). El contraste de manganeso comporta un mayor incremento de seĖal específico en los ratones obesos (en negro) que en los controles (en gris), en los núcleos ARC y VMN; algo que no sucede en el V4. Esta circunstancia revela una mayor estimulación orexigénica de los animales obesos, selectiva en ARC y VMN, en las mismas condiciones de alimentación que los controles.
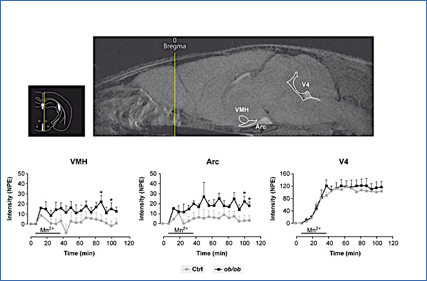
Figura 3.- Respuesta MEMRI en ratones obesos y ratones control. Inserto superior izquierdo: Localización del hipotálamo, tercer y cuarto ventrículo en un atlas anatómico [81]. Superior derecha: Incremento de seĖal inducido por el contraste de Mn2+ (MEMRI) en el núcleo ARC, VMN y en el cuarto ventrículo (v4). Paneles inferiores: cinética del incremento MEMRI en ARC, VMN y V4. Los ratones obesos (círculos negros) presentan mayor seĖal con los controles (círculos grises) en los núcleos hipotalámicos, pero no el ventrículo, revelando un efecto específico en estos. Reproducida de (50) con el permiso de la revista.
DWI
La interpretación de los modelos biofísicos que subyacen a los cambios en la difusión browniana del agua en estados fisiológicos y patológicos, ha representado un motivo de discusión frecuente en las últimas décadas.
La difusión de las moléculas de agua es un proceso aleatorio, y en medios homogéneos, el decaimiento de la seĖal de resonancia magnética se puede describir por una función monoexponencial caracterizada por un coeficiente de difusión D.
En la seĖal observada con DWI, sin embargo, lo que se obtiene es resultado de la integración de los desplazamientos microscópicos de todas las moléculas de agua presentes en un vóxel, por lo que D, se define mejor mediante un parámetro de difusión aparente (ADC) (55).
En relación con el control del apetito, algunos grupos han estudiado el papel del ADC en distintas regiones cerebrales de pacientes obesos y no obesos (16). Este estudio mostró que, el hipotálamo de los pacientes obesos presenta un mayor valor de ADC, muy posiblemente debido a una distribución neurovascular alterada de fluidos, como ocurre en el edema vasogénico. De hecho, se ha demostrado que la obesidad está asociada a una respuesta inflamatoria crónica, caracterizada por una producción anormal de adipokinas y la activación de algunas rutas de seĖalización pro-inflamatorias. Esta una situación produce la inducción de varios marcadores de inflamación (56) y que apoya las evidencias de que las dietas de alto contenido calórico activan respuestas proinflamatorias en el hipotálamo (57,58). Esto sugiere que las respuestas inflamatorias podrían ser las verdaderas responsables de la resistencia a insulina y leptina inducida por las dietas de alto contenido calórico (59,60). Adicionalmente, la inflamación puede directamente daĖar el tejido cerebral, aumentando la permeabilidad de los vasos sanguíneos y causando eventualmente un incremento del número de células inflamatorias en el líquido cefalorraquídeo y en los espacios perivasculares en el cerebro (61).
En este sentido, un trabajo reciente (62), ha permitido determinar que los sujetos con mayor peso corporal presentan reducciones significativas en la integridad vascular de las estructuras cerebrales relacionadas con el control del apetito y los nuevos resultados de nuestro laboratorio, sugieren que la respuesta inflamatoria podría ocurrir no solo en la obesidad, sino también de forma transitoria en estados de ayuno (63).
En otros estudios, se han utilizado los cambios en ADC para describir la activación neuronal en seres humanos, en animales y biopsias ex vivo (15, 64-66), asociando la disminución del ADC observada a un aumento de volumen neurocelular, ligado a la activación neuronal. De hecho, el aumento de volumen neurocelular causado por la activación neuronal ha sido demostrado también por otras técnicas (67-69). El amplio rango de valores de difusión con los que se trabajaba en estos estudios, originó la aparición de modelos de difusión más elaborados, como el biexponencial (70).
Interesantemente, otros estudios demostraron que el cambio de seĖal de difusión tras activación neuronal se produce antes que el cambio detectado mediante las técnicas BOLD (65,71).
En este contexto, la primera aplicación fDWI al estudio del control del apetito, fue publicada recientemente por nuestro laboratorio (63). Nuestros resultados mostraron que los coeficientes de difusión del agua en el hipotálamo cambian en situaciones de ayuno, tanto en ratones como en seres humanos. En ratones, fue posible detectar cambios en los núcleos ARC, DMN y VMN. Sobre esta base, es posible afirmar que la aplicación de fDWI al estudio de la activación cerebral en general, y de la hipotalámica en particular, abre un nuevo camino en neuroimagen funcional; donde los cambios detectados mediante las técnicas de difusión ocurren anteriormente a los detectados en BOLD (70), evitando además el uso potencialmente tóxico de las técnicas MEMRI. Además, la capacidad de DWI de detectar diferencias en la dirección preferencial de la difusión mediante la implementación de medidas del tensor de difusión (DTI) (72,73) permitirá en el futuro, la investigación no invasiva de tractos neuronales específicos y sus posibles alteraciones en desordenes del apetito.
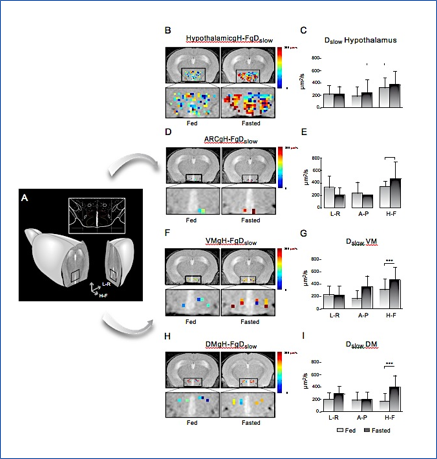
Figura 4.- Representación del apetito mediante fDWI en los núcleos hipotalámicos del cerebro de ratón. A: Sección axial que contiene el hipotálamo de un ratón representativo y un inserto de un atlas anatómico que muestra la localización de los núcleos; DMN (rojo), VMN (amarillo) y ARC (azul). B, D, F, H: Mapas de color de la difusión en ratones alimentados (izquierda) y ayunados (derecha), superpuestos a imágenes pesadas en T2 (T2w). La región hipotalámica se muestra expandida en los correspondientes paneles inferiores. C, E, G, I: Gráficos de barras del promedio del coeficiente de difusión lenta (Dslow) correspondiente a cada uno de los paneles B, D, F, H, respectivamente. Reproducido de (63) con permiso de la revista.
La Figura 4 muestra un ejemplo representativo del uso de fDWI en el estudio de activación hipotalámica en ratones, mediante los cambios observados en los parámetros de difusión del agua en distintos núcleos hipotalámicos, incluyendo el ARC, VMN y DMN, cuya localización anatómica puede observarse en detalle en el panel 5A. Los paneles 5B, 5D, 5F y 5H muestran los mapas paramétricos del coeficiente lento de la difusión (Dslow) de un animal representativo en estado alimentado (izquierda) y tras un ayuno nocturno (derecha) en el hipotálamo, ARC, VMN y ARC, respectivamente. Los gráficos de barras en los paneles 5C, 5E, 5G y 5I representan los valores promedio del parámetro correspondiente en siete animales. El incremento significativo de Dslow con el ayuno se puede interpretar como consecuencia del incremento de volumen celular consecuencia de la activación neuronal (60).
4. Estudios de MRS de la Regulación Hipotalámica del Apetito
Los métodos de imagen pueden ser completados por varias técnicas espectroscópicas, principalmente in vivo 1H MRS y ex vivo 1H y 13C HRMAS. Estos métodos han demostrado, recientemente, haber superado las restricciones que impedían previamente evaluar adecuadamente la fisiología hipotalámica, principalmente por la necesidad de utilizar grandes volúmenes de tejido para alcanzar suficiente resolución.
In vivo 1H MRS de alto campo
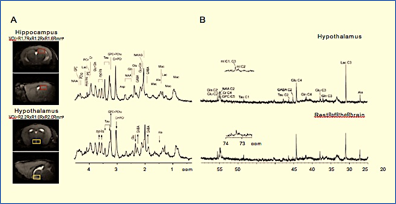
Figura 5.- Espectroscopía multinuclear del hipotálamo. Izquierda: Espectroscopía in vivo de 1H en el hipocampo (paneles superiores) y en el hipotálamo (paneles inferiores) y sus correspondientes espectros. Nótese los incrementos relativos de GABA y myo-inositol (flecha hacia arriba) y decrecimientos de glutamato y taurina (flecha hacia abajo). Reproducido de (75) con permiso de la revista. Derecha: Espectro de 13C HRMAS de biopsias hipotalámicas (arriba) preparado después de la administración de [1-13C] glucosa, comparado con el resto del cerebro (abajo) en un ratón ayunado. Reproducido de (80) con permiso de la revista.
La espectroscopía de 1H MRS de alto campo (14.1T) se ha utilizado para obtener perfiles metabólicos de elevada calidad en el hipotálamo de ratón in vivo (74,75). Los autores describieron que el perfil metabólico del hipotálamo es diferente del de otras estructuras cerebrales como el hipocampo.
En particular, el hipotálamo contiene concentraciones más altas de ácido γ-aminobutírico (GABA) y myo-inositol, y menores concentraciones de taurina (Figura 5A). Por otro lado, la espectroscopía de 1H alto campo también se ha utilizado de forma combinada con técnicas de imagen (52). En este caso, los autores estudiaron la activación hipotalámica en ratas mediante el paradigma de Anorexia Inducida por Deshidratación (DIA), en ratas ayunadas una noche y en ratas control. El contraste de Mn2+ detectó activación neuronal en dos núcleos hipotalámicos: en el hipotálamo lateral (LH) y en el Periventricular (PVN), revelando una activación superior en las ratas con DIA. Por otro lado, en el perfil metabólico analizado con espectroscopia a 14.1T, se encontraron incrementos significativos de GABA en las dos condiciones respecto a las ratas control, mientras que el lactato aumentó solamente en las ratas DIA. En su conjunto, estos estudios muestran como la espectroscopia de alto campo in vivo acoplada con MEMRI, puede proporcionar una información muy relevante sobre los mecanismos hipotalámicos de control del apetito, balance energético global y control de peso en roedores.
Espectroscopía 13C y 1H de alto campo en ángulo mágico
La espectroscopía de 13C es un método que ha mostrado un gran potencial en la investigación de los mecanismos de acoplamiento neuroglial tanto in vivo como in vitro (76-79). La baja abundancia natural del 13C (1,1%), sin embargo, y la baja sensibilidad del método, imponían la necesidad de utilizar vóxeles de tamaĖo relativamente grande in vivo, que excedían significativamente las dimensiones del hipotálamo.
Para superar este inconveniente, nuestro laboratorio ha implementado recientemente una nueva colección de métodos espectroscópicos ex vivo, concretamente la espectroscopía de 13C alta resolución de ángulo mágico (HRMAS). Adquiriendo espectros de resonancia magnética de biopsias hipotalámicas, con la muestra inclinada 54.7 grados con respecto al campo magnético estático, se eliminan los acoplamientos dipolares que ensanchan las resonancias in vivo, y se obtienen espectros de alta resolución de la biopsia similares a los que se obtienen en solución. Notablemente, estos espectros pueden obtenerse con muestras de tan solo 5-10 mg, un tamaĖo similar al del hipotálamo en roedores. Utilizando esta tecnología, se han investigado los efectos del ayuno nocturno y de la administración de grelina en el perfil metabólico, así como la incorporación de 13C desde (1-13C) glucosa en los metabolitos hipotalámicos (80).
Los resultados mostraron que el ayuno nocturno induce incrementos significativos en la incorporación de 13C en (2-13C) GABA y (3-13C) Lactato, mientras que la infusión del péptido orexigénico no afectó al marcaje en 13C de los metabolitos. Estos resultados revelaron que el ayuno parece incrementar las neurotransmisiones GABAérgicas y la glucolisis. Sin embargo, la infusión de grelina no induce los mismos efectos, indicando que factores adicionales a la la grelina resultan necesarios para mimetizar la compleja respuesta hipotalámica.
Finalmente, se han investigado recientemente los mecanismos neurogliales relacionados con la seĖalización de la leptina en el hipotálamo, empleando ratones ob/ob, deficientes en leptina, y ratones control (50). Este estudio combinó técnicas MEMRI con 1H y 13C HRMAS, empleando infusiones de (1-13C) glucosa, un sustrato principalmente neuronal, o de (2-13C) acetato, un sustrato primordialmente glial. Los ratones deficientes en leptina mostraron un contraste de Mn2+ aumentado en los núcleos hipotalámicos (Figura 3) y una acumulación incrementada de 13C, solamente en los carbonos de glutamato y glutamina derivados de (1-13C) glucosa, pero no en los derivados de (2-13C) acetato.
El abordaje combinado MEMRI-13C HRMAS mostró por primera vez que el incremento en la seĖal MEMRI asociada a la activación neuronal de las rutas orexigénicas, ocurre simultáneamente con un incremento en el metabolismo oxidativo y en el ciclo gultamato-glutamina que soporta la neurotransmisión glutamatérgica. Considerando estas observaciones junto con las evidencias de aumento de neurotransmisiones GABAérgicas (80), los resultados parecen indicar que la estimulación orexigénica del hipotálamo resulta en un incremento de neurotransmisiones GABAérgicas y glutamatérgicas, implicando un aumento de los ciclos transcelulares de glutamato-glutamina y GABA entre neuronas y astrocitos. En general, los resultados adquiridos hasta ahora indican que los eventos de transmisión sináptica que soportan la seĖalización neuroendocrina en el hipotálamo siguen unos mecanismos de compartimentación neuroglial similares a otros tipos de activaciones sensoriales o motoras, pero bajo control hormonal.
5. Conclusiones y perspectivas futuras.
Las secciones anteriores han resumido la información obtenida sobre la función hipotalámica de regulación del apetito in vivo, utilizando técnicas de imagen y espectroscopía por Resonancia Magnética. Los resultados revelan que la estimulación orexigénica está asociada a: un incremento de perfusión sanguínea del hipotálamo como revelan las técnicas BOLD, un incremento de actividad neuronal glutamatérgica y GABAérgica como revelan los estudios MEMRI y 13C HRMAS y un incremento de volumen neuroglial compatible con la acumulación de iones asociada al disparo de las neuronas orexigénicas y a fenómenos inflamatorios, como revelan las técnicas fDWI.
Estas características hacen que la transmisión neuroendocrina durante el apetito adopte mecanismos sinápticos similares a otras formas de estimulación sensorial o motora. Sin embargo, en las sinapsis neuroendocrinas, la transmisión del mensaje glutamatérgico o GABAérgico, parece estar controlada principalmente por la concentración sanguínea del efector hormonal que podría interaccionar adicionalmente con elementos del sistema inmunitario y de la cascada inflamatoria, resultando en el sistema más complejo de neuroregulación que conocemos.
Por otro lado, las técnicas de Resonancia Magnética han permitido diseĖar un nuevo escenario para los mecanismos neuroendocrinos que subyacen a la regulación del apetito. A pesar del progreso alcanzado, varios aspectos importantes permanecen aún por esclarecer. En particular, la discriminación entre neurotransmisiones activadoras e inhibidoras resulta difícil mediante estas metodologías, pues ambas conducen al mismo resultado espectroscópico o de imagen. Tampoco resulta posible incrementar aún más la resolución espacial y temporal de la imaginería mejorando la resolución obtenida de los núcleos hipotalámicos y alcanzando resoluciones celulares o subcelulares. La combinación de técnicas MRI o MRS con abordajes electrofisiológicos hipotalámicos y la utilización de imanes de campo magnético superior al actual podría contribuir a superar estas limitaciones.
Finalmente, los abordajes MRI y MRS descritos en esta revisión para la elucidación de los mecanismos de regulación hipotalámica del apetito in vivo, pueden ser fácilmente extendidos a otras funciones hipotalámicas incluyendo, la sed y osmoregulación, la regulación de la presión sanguínea, la termorregulación, los ritmos circadianos y algunas manifestaciones de agresividad.
6. Agradecimientos
Los autores manifiestan su agradecimiento a D. Javier Pérez CSIC, por su competencia en la preparación de las ilustraciones.
Este trabajo ha sido financiado en parte por las ayudas: SAF-2008-01327, SAF2011-23622 del Ministerio de Economía y Competitividad y S2010/BMD-2349 de la Comunidad de Madrid concedidas a Sebastián Cerdán y la beca predoctoral BES 2009-027615 del Ministerio de Economía y Competitividad concedida a Blanca Lizarbe.
7. abreviaturas
ARC:núcleo Arcuado, AgRP: Agouti related protein, BOLD: Contraste en Imagen por Resonancia Magnética ponderada en el nivel de oxigenación de la sangre, CART: transcrito regulado por cocaína y anfetamina, DIA: Anorexia inducida por deshidratación, DMD: núcleo dorsomedial, DWI: Imagen por Resonancia Magnética ponderada en difusión, MEMRI: Imagen por Resonancia Magnética ponderada en captación de manganeso, MRI: Imagen por Resonancia Magnética, MRS: Espectroscopía por Resonancia Magnética, MSH: ruta de la melanocortina, NPY: neuropéptido Y, VMN: núcleo Ventromedial, V4: cuarto ventrículo.
8. REFERENCIAS
1. Lin, D., et al.(2011) Functional identification of an aggression locus in the mouse hypothalamus. Nature. 470(7333): p. 221-6.
2. Swaab, D.F., Hofman, M.A., Mirmiran, M., Ravid, R., van Leewen, F.W. Eds.(1992) The human hypothalamus in health and disease. Proceedings of the 17th International Summer School of Brain Research. Amsterdam, The Netherlands, 26-30 August 1991. Prog Brain Res. 93: p. 1-481.
3. Mori, Y., et al.(1991) Chronic recording of electrophysiological manifestation of the hypothalamic gonadotropin-releasing hormone pulse generator activity in the goat. Neuroendocrinology. 53(4): p. 392-5.
4. Sani, S., et al.(2009) Microelectrode recording in the posterior hypothalamic region in humans. Neurosurgery. 64(3 Suppl): p. ons161-7; discussion ons167-9.
5. Carnell, S., et al.(2012) Neuroimaging and obesity: current knowledge and future directions. Obes Rev. 13(1): p. 43-56.
6. Gibson, C.D., et al.(2010) Neuroimaging, gut peptides and obesity: novel studies of the neurobiology of appetite. J Neuroendocrinol. 22(8): p. 833-45.
7. Coll, A.P., I.S. Farooqi, and S. O'Rahilly(2007) The hormonal control of food intake. Cell. 129(2): p. 251-62.
8. Morton, G.J., et al.(2006) Central nervous system control of food intake and body weight. Nature. 443(7109): p. 289-95.
9. Stanley, S., et al.(2005) Hormonal regulation of food intake. Physiol Rev. 85(4): p. 1131-58.
10. Schwartz, M.W. and G.J. Morton(2002) Obesity: keeping hunger at bay. Nature. 418(6898): p. 595-7.
11. Tang-Christensen, M., et al.(2004) Central administration of ghrelin and agouti-related protein (83-132) increases food intake and decreases spontaneous locomotor activity in rats. Endocrinology. 145(10): p. 4645-52.
12. Logothetis, N.K. and B.A. Wandell(2004) Interpreting the BOLD signal. Annu Rev Physiol. 66: p. 735-69.
13. Zhu, X.H., et al.(1998) Simultaneous oxygenation and perfusion imaging study of functional activity in primary visual cortex at different visual stimulation frequency: quantitative correlation between BOLD and CBF changes. Magn Reson Med. 40(5): p. 703-11.
14. Koretsky, A.P. and A.C. Silva(2004) Manganese-enhanced magnetic resonance imaging (MEMRI). NMR Biomed. 17(8): p. 527-31.
15. Darquie, A., et al.(2001) Transient decrease in water diffusion observed in human occipital cortex during visual stimulation. Proc Natl Acad Sci U S A. 98(16): p. 9391-5.
16. Alkan, A., et al.(2008) Diffusion-weighted imaging features of brain in obesity. Magn Reson Imaging. 26(4): p. 446-50.
17. Mueller, K., et al.(2011) Sex-dependent influences of obesity on cerebral white matter investigated by diffusion-tensor imaging. PLoS One. 6(4): p. e18544.
18. Mahankali, S., et al.(2000) In vivo fMRI demonstration of hypothalamic function following intraperitoneal glucose administration in a rat model. Magn Reson Med. 43(1): p. 155-9.
19. Matsuda, M., et al.(1999) Altered hypothalamic function in response to glucose ingestion in obese humans. Diabetes. 48(9): p. 1801-6.
20. Stark, J.A., et al.(2006) Functional magnetic resonance imaging and c-Fos mapping in rats following an anorectic dose of m-chlorophenylpiperazine. Neuroimage. 31(3): p. 1228-37.
21. Dodd, G.T., S.R. Williams, and S.M. Luckman(2010) Functional magnetic resonance imaging and c-Fos mapping in rats following a glucoprivic dose of 2-deoxy-D-glucose. J Neurochem. 113(5): p. 1123-32.
22. Li, J., et al.(2012) Correlations of macronutrient-induced functional magnetic resonance imaging signal changes in human brain and gut hormone responses. Am J Clin Nutr. 96(2): p. 275-82.
23. Min, D.K., et al.(2011) Changes in differential functional magnetic resonance signals in the rodent brain elicited by mixed-nutrient or protein-enriched meals. Gastroenterology. 141(5): p. 1832-41.
24. Killgore, W.D., et al.(2003) Cortical and limbic activation during viewing of high- versus low-calorie foods. Neuroimage. 19(4): p. 1381-94.
25. Smeets, P.A., et al.(2005) Functional magnetic resonance imaging of human hypothalamic responses to sweet taste and calories. Am J Clin Nutr. 82(5): p. 1011-6.
26. Berthoud, H.R.(2004) Neural control of appetite: cross-talk between homeostatic and non-homeostatic systems. Appetite. 43(3): p. 315-7.
27. Batterham, R.L., et al.(2007) PYY modulation of cortical and hypothalamic brain areas predicts feeding behaviour in humans. Nature. 450(7166): p. 106-9.
28. Malik, S., et al.(2008) Ghrelin modulates brain activity in areas that control appetitive behavior. Cell Metab. 7(5): p. 400-9.
29. Purnell, J.Q., et al.(2011) Brain functional magnetic resonance imaging response to glucose and fructose infusions in humans. Diabetes Obes Metab. 13(3): p. 229-34.
30. Vidarsdottir, S., et al.(2007) Glucose ingestion fails to inhibit hypothalamic neuronal activity in patients with type 2 diabetes. Diabetes. 56(10): p. 2547-50.
31. Tomasi, D., et al.(2009) Association of body mass and brain activation during gastric distention: implications for obesity. PLoS One. 4(8): p. e6847.
32. Baicy, K., et al.(2007) Leptin replacement alters brain response to food cues in genetically leptin-deficient adults. Proc Natl Acad Sci U S A. 104(46): p. 18276-9.
33. Guthoff, M., et al.(2010) Insulin modulates food-related activity in the central nervous system. J Clin Endocrinol Metab. 95(2): p. 748-55.
34. Jones, R.B., et al.(2012) Functional neuroimaging demonstrates that ghrelin inhibits the central nervous system response to ingested lipid. Gut. 61(11): p. 1543-51.
35. Pautler, R.G.(2004) In vivo, trans-synaptic tract-tracing utilizing manganese-enhanced magnetic resonance imaging (MEMRI). NMR Biomed. 17(8): p. 595-601.
36. Andrew, R.D., et al.(1981) Dye transfer through gap junctions between neuroendocrine cells of rat hypothalamus. Science. 211(4487): p. 1187-9.
37. Jaffe, L.F.(2008) Calcium waves. Philos Trans R Soc Lond B Biol Sci. 363(1495): p. 1311-6.
38. Jaffe, L.F.(2010) Fast calcium waves. Cell Calcium. 48(2-3): p. 102-13.
39. Lee, J.H., et al.(2005) Manganese-enhanced magnetic resonance imaging of mouse brain after systemic administration of MnCl2: dose-dependent and temporal evolution of T1 contrast. Magn Reson Med. 53(3): p. 640-8.
40. Just, N., et al.(2011) Effect of manganese chloride on the neurochemical profile of the rat hypothalamus. J Cereb Blood Flow Metab. 31(12): p. 2324-33.
41. Zwingmann, C., D. Leibfritz, and A.S. Hazell(2003) Energy metabolism in astrocytes and neurons treated with manganese: relation among cell-specific energy failure, glucose metabolism, and intercellular trafficking using multinuclear NMR-spectroscopic analysis. J Cereb Blood Flow Metab. 23(6): p. 756-71.
42. Zwingmann, C., D. Leibfritz, and A.S. Hazell(2004) Brain energy metabolism in a sub- acute rat model of manganese neurotoxicity: an ex vivo nuclear magnetic resonance study using [1-13C]glucose. Neurotoxicology. 25(4): p. 573-87.
43. Aoki, I., et al.(2002) Dynamic activity-induced manganese-dependent contrast magnetic resonance imaging (DAIM MRI). Magn Reson Med. 48(6): p. 927-33.
44. Aoki, I., et al.(2004) In vivo detection of neuroarchitecture in the rodent brain using manganese-enhanced MRI. Neuroimage. 22(3): p. 1046-59.
45. Chaudhri, O.B., et al.(2006) Differential hypothalamic neuronal activation following peripheral injection of GLP-1 and oxyntomodulin in mice detected by manganese- enhanced magnetic resonance imaging. Biochem Biophys Res Commun. 350(2): p. 298-306.
46. Kuo, Y.T., et al.(2006) Manganese-enhanced magnetic resonance imaging (MEMRI) without compromise of the blood-brain barrier detects hypothalamic neuronal activity in vivo. NMR Biomed. 19(8): p. 1028-34.
47. Hankir, M.K., et al.(2011) Peptide YY 3-36 and pancreatic polypeptide differentially regulate hypothalamic neuronal activity in mice in vivo as measured by manganese- enhanced magnetic resonance imaging. J Neuroendocrinol. 23(4): p. 371-80.
48. Parkinson, J.R., O.B. Chaudhri, and J.D. Bell(2009) Imaging appetite-regulating pathways in the central nervous system using manganese-enhanced magnetic resonance imaging. Neuroendocrinology. 89(2): p. 121-30.
49. Parkinson, J.R., et al.(2009) Differential patterns of neuronal activation in the brainstem and hypothalamus following peripheral injection of GLP-1, oxyntomodulin and lithium chloride in mice detected by manganese-enhanced magnetic resonance imaging (MEMRI). Neuroimage. 44(3): p. 1022-31.
50. Delgado, T.C., et al.(2011) Neuroglial metabolic compartmentation underlying leptin deficiency in the obese ob/ob mice as detected by magnetic resonance imaging and spectroscopy methods. J Cereb Blood Flow Metab. 31(12): p. 2257-66.
51. Anastasovska, J., et al.(2012) Fermentable carbohydrate alters hypothalamic neuronal activity and protects against the obesogenic environment. Obesity (Silver Spring). 20(5): p. 1016-23.
52. Just, N. and R. Gruetter(2011) Detection of neuronal activity and metabolism in a model of dehydration-induced anorexia in rats at 14.1 T using manganese-enhanced MRI and 1H MRS. NMR Biomed. 24(10): p. 1326-36.
53. Gutman, D.A., et al.(2013) Mapping of the mouse olfactory system with manganese- enhanced magnetic resonance imaging and diffusion tensor imaging. Brain Struct Funct. 218(2): p. 527-37.
54. Silva, A.C.(2012) Using manganese-enhanced MRI to understand BOLD. Neuroimage. 62(2): p. 1009-13.
55. Le Bihan, D.(2003) Looking into the functional architecture of the brain with diffusion MRI. Nat Rev Neurosci. 4(6): p. 469-80.
56. Bastard, J.P., et al.(2006) Recent advances in the relationship between obesity, inflammation, and insulin resistance. Eur Cytokine Netw. 17(1): p. 4-12.
57. De Souza, C.T., et al.(2005) Consumption of a fat-rich diet activates a proinflammatoryresponse and induces insulin resistance in the hypothalamus. Endocrinology. 146(10): p. 4192-9.
58. Wang, X., et al.(2012) Increased hypothalamic inflammation associated with the susceptibility to obesity in rats exposed to high-fat diet. Exp Diabetes Res. 2012: p. 847246.
59. Kleinridders, A., et al.(2009) MyD88 signaling in the CNS is required for development of fatty acid-induced leptin resistance and diet-induced obesity. Cell Metab. 10(4): p. 249-59.
60. Wisse, B.E. and M.W. Schwartz(2009) Does hypothalamic inflammation cause obesity? Cell Metab. 10(4): p. 241-2.
61. Man, S., E.E. Ubogu, and R.M. Ransohoff(2007) Inflammatory cell migration into the central nervous system: a few new twists on an old tale. Brain Pathol. 17(2): p. 243-50.
62. Cazettes, F., et al.(2011) Obesity-mediated inflammation may damage the brain circuit that regulates food intake. Brain Res. 1373: p. 101-9.
63. Lizarbe, B., et al.(2013) Imaging hypothalamic activity using diffusion weighted magnetic resonance imaging in the mouse and human brain. Neuroimage. 64: p. 448-57.
64. Flint, J., et al.(2009) Diffusion weighted magnetic resonance imaging of neuronal activity in the hippocampal slice model. Neuroimage. 46(2): p. 411-8.
65. Kohno, S., et al.(2009) Water-diffusion slowdown in the human visual cortex on visual stimulation precedes vascular responses. J Cereb Blood Flow Metab. 29(6): p. 1197-207.
66. Yacoub, E., et al.(2008) Decreases in ADC observed in tissue areas during activation in the cat visual cortex at 9.4 T using high diffusion sensitization. Magn Reson Imaging. 26(7): p. 889-96.
67. Andrew, R.D. and B.A. MacVicar(1994) Imaging cell volume changes and neuronal excitation in the hippocampal slice. Neuroscience. 62(2): p. 371-83.
68. Hansson, E., et al.(2000) Astroglia and glutamate in physiology and pathology: aspects on glutamate transport, glutamate-induced cell swelling and gap-junction communication. Neurochem Int. 37(2-3): p. 317-29.
69. Stroman, P.W., et al.(2008) Magnetic resonance imaging of neuronal and glial swelling as an indicator of function in cerebral tissue slices. Magn Reson Med. 59(4): p. 700-6.
70. Le Bihan, D., et al.(2006) Direct and fast detection of neuronal activation in the human brain with diffusion MRI. Proc Natl Acad Sci U S A. 103(21): p. 8263-8.
71. Aso, T., et al.(2013) Comparison of diffusion-weighted fMRI and BOLD fMRI responses in a verbal working memory task. Neuroimage. 67: p. 25-32.
72. Ahn, S. and S.K. Lee(2011) Diffusion tensor imaging: exploring the motor networks and clinical applications. Korean J Radiol. 12(6): p. 651-61.
73. Le Bihan, D., et al.(2001) Diffusion tensor imaging: concepts and applications. J Magn. Reson Imaging. 13(4): p. 534-46.
74. Duarte, J.M., et al.(2012) The neurochemical profile quantified by in vivo 1H NMR spectroscopy. Neuroimage. 61(2): p. 342-62.
75. Lei, H., et al.(2010) Neurochemical profile of the mouse hypothalamus using in vivo 1H MRS at 14.1T. NMR Biomed. 23(6): p. 578-83.
76. Cruz, F. and S. Cerdan(1999) Quantitative 13C NMR studies of metabolic compartmentation in the adult mammalian brain. NMR Biomed. 12(7): p. 451-62.
77. Gruetter, R., et al.(2003) Localized in vivo 13C NMR spectroscopy of the brain. NMR Biomed. 16(6-7): p. 313-38.
78. Rodrigues, T.B., et al.(2009) 13C NMR tracers in neurochemistry: implications for molecular imaging. Q J Nucl Med Mol Imaging. 53(6): p. 631-45.
79. Rothman, D.L., et al.(2003) In vivo NMR studies of the glutamate neurotransmitter flux and neuroenergetics: implications for brain function. Annu Rev Physiol. 65: p. 401-27.
80. Violante, I.R., et al.(2009) Cerebral activation by fasting induces lactate accumulation in the hypothalamus. Magn Reson Med. 62(2): p. 279-83.
81. Paxinos, G., Franklin, K., The Mouse Brain in Stereotaxic Coordinates2001, New York: Academic Press.