Desarrollo perinatal del cerebro. Un paso esencial para el establecimiento de la inteligencia
José María Medina
Académico de Número de la Real Academia Nacional de Farmacia.
e-mail: edicion@ranf.com
Recibido el 13 de abril de 2013;;; An. Real Acad. Farm. Vol 79, Nľ 1 (2013), pag. 44-68 FISIOLOGIA Y CONTROL CEREBRAL DEL COMPORTAMIENTO. Mesa Redonda celebrada en la Real Academia Nacional de Farmacia el día 29 de noviembre del 2012. Coordinadora: A. M. Pascual-Leone Académica de Número de la RANF.
RESUMEN
El desarrollo del neuroepitelio durante la etapa embrionaria es un paso obligado para el desarrollo del Sistema Nervioso Central. Sin embargo, en la especie humana el desarrollo del cerebro continúa en las cercanías del parto y, muy particularmente, durante el período postnatal inmediato. Esta última etapa del desarrollo tiene lugar de una forma destacada en la pared de los ventrículos laterales y es esencial para el refinamiento de la estructura del córtex. En este sentido, la contribución de este período del desarrollo a la complejidad del neocórtex se considera fundamental en el desarrollo de la inteligencia en la especie humana. |
Palabras clave: Perinatal; Cerebro; Inteligencia.
ABSTRACT
Perinatal development of the brain. An essential event for the flourishing of intelligence
The development of neuroepithelium during the embryonic period is a mandatory step in the CNS development. However, in the human brain development continues around birth and, particularly during the early postnatal period. During this time brain development takes place mainly in the lateral ventricle walls and results in the refining of cortex layers. Thus, the development of neocortex during postnatal period seems to be essential in the flourishing of intelligence in the human species. |
Keywords: Perinatal; Brain; Intelligence.
1. Introducción
La localización y origen de la inteligencia humana ha sido una preocupación científica ancestral, primeramente explicitada por Aristóteles, con su concepto del alma. Más recientemente, es bien conocida la controversia que, con respecto a la aparición de la mente, mantuvieron Wallace y Darwin. Según el primero, la mente apareció de forma súbita mediante la intervención divina, mientras que para Darwin la mente apareció paulatinamente como un perfeccionamiento más de nuestras funciones cerebrales. En este sentido, Darwin propone, en "The Descent of Man", que el hombre ha mejorado paulatinamente las capacidades de sus predecesores, de tal manera que resulta del desarrollo de los primates, una de cuyas ramas adquirió progresivamente la inteligencia.
Esta hipótesis del crecimiento paulatino de la inteligencia fue ampliada por T.H. Huxley, en el sentido de que la evolución del cerebro ha seguido un patrón cuantitativo ("la cantidad es lo que vale"). Al establecer la doctrina de la continuidad propone que a un aumento de tamaĖo del cerebro le sigue el crecimiento de la inteligencia. De esta manera impulsó la teoría de la encefalización, que intenta demostrar la desproporción existente entre el tamaĖo de nuestro encéfalo y aquél que nos correspondería dado nuestro tamaĖo corporal.
Curiosamente, el proceso de encefalización comienza en los prosimios, puesto que los lemures tienen ya una encefalización que podríamos calificar de "media". Son, sin embargo, los simios, es decir, los primates antropoideos, los que destacan por su avanzada encefalización. Aún es más esclarecedor el hecho de que la encefalización se centra principalmente en el crecimiento del lóbulo prefrontal, allá donde hoy sabemos radica la inteligencia, y que en los primates alcanza un especial grado de desarrollo.
En efecto, fue Elliot Smith el primero en proponer la idea de que el área prefrontal, exclusiva de los primates, podría ser el sustrato donde se desarrollara la mente. En este sentido, Brodman propuso que la transformación de los primates en los homínidos fue consecuencia de la evolución del área prefrontal. Concretamente, de la zona dorsolateral, en donde aparece una capa nueva del córtex, la lámina IV, repleta de células granulares. Esto explica, asimismo, la formación de las numerosas circunvoluciones cerebrales, causadas por el crecimiento masivo de las capas más externas del córtex.
De hecho, el Australopithecus africanus, a pesar de poseer sólo 450 gramos de encéfalo y tener, posiblemente, una estructura cerebral diferente de la del hombre actual, tenía muy desarrollado el sector orbital del lóbulo frontal, puesto que quedan seĖales de ello en los fósiles encontrados. En este sentido, es en el lóbulo frontal donde se ha propuesto radica la denominada Teoría de la Mente, que se define como aquélla que dirige nuestro comportamiento, teniendo en cuenta lo que creemos que los demás piensan de nosotros, así como el estado de la situación presente. Asimismo, el lóbulo frontal controla todas aquellas capacidades que constituyen la inteligencia. En él, además de controlarse las emociones, radica nuestra capacidad de concentración, anticipación y planificación, así como el control de la memoria. En resumen, en el lóbulo frontal se elaboran y mantienen las ideas, la característica esencial de nuestra mente.
Por consiguiente, no es de extraĖar que el habla, posiblemente la característica más distintiva del hombre, también se localice en el área prefrontal. En este sentido, se acepta de una manera general que el lenguaje y la inteligencia están fuertemente unidos. Si esto es así, sólo el Homo sapiens ha sido inteligente. En efecto, para que se produjese este cambio revolucionario, el Homo tuvo que sufrir importantes cambios anatómicos. La laringe hubo de descender para emitir los primeros sonidos guturales. Este hecho tuvo lugar tan lejos como en el Homo ergaster (1,8 millones de aĖos). Sin embargo, la calidad de estos sonidos no permitía más que una comunicación deficiente, muy lejana de la utilizada por el hombre actual. Era necesario ser capaz de pronunciar las vocales, verdaderos pivotes en los que se sustenta el lenguaje. Según Arsuaga esto aconteció más tarde, en el Homo sapiens, gracias al acortamiento horizontal del aparato fonador (aproximadamente hace 300.000 aĖos) (Arsuaga y Martínez 1998).
En resumen, sólo a nuestros antecesores más cercanos podemos considerarlos como plenamente inteligentes, aunque se trata de la coronación de un proceso, el de la aparición de la inteligencia, que comenzó aĖos atrás.
Así, la “inteligencia tecnológica” data de hace 2,5 millones de aĖos, momento en que se fabrican los primeros utensilios de piedra. Un millón de aĖos más tarde (hace 1,5 millones de aĖos) se llega a la perfección con el hacha lítica de dos caras simétricas. Un millón más es necesario para otro paso definitivo, la invención del fuego (0,25 millones de aĖos). Esta época coincide con los primeros enterramientos (0,3 millones de aĖos), seĖal de que en este tiempo nuestros antepasados poseían el sentido de la trascendencia.
Es necesario destacar que el sentido de la transcendencia es una de las claves de la existencia de la mente, por lo que podemos datar hace 300.000 aĖos, el nacimiento de la “inteligencia filosófica”, verdadera clave de la mente. A partir de este momento se comienzan a pronunciar las vocales, imprescindibles para una comunicación coherente y fluida.
Más tarde, los indicios de la mente empiezan a aparecer por doquier. El adorno personal (35.000 aĖos) y las maravillosas pinturas de Altamira y Lascaux (17.000-14.000 aĖos) son un buen índice de ello.
2. TamaĖo y complejidad: requisitos para el desarrollo de la inteligencia
Es evidente que un sistema tan sofisticado como el que denominamos inteligencia debe estar instalado en un sustrato biológico único. Por consiguiente, debemos esperar que la inteligencia esté soportada por una estructura compleja y con la suficiente extensión como para acoger la “maquinaria” necesaria para mantener las sutiles habilidades que en su conjunto denominamos “inteligencia”.
No es extraĖo, pues, que nuestro cerebro presente estas dos características, las que hemos definido como tamaĖo y complejidad, características que van a ser necesarias para que la especie humana alcance esta cualidad que nos distingue de todo el resto del reino animal.
2.1. El salto neoténico: en busca de la libertad estérica
Resulta paradójico que nuestra especie, supuestamente la más evolucionada, accede a la vida extrauterina con un retraso evolutivo con respecto a especies inferiores en la escala filogenética.
Siempre nos ha sorprendido comprobar cómo la mayoría de las otras especies traen a este mundo a sus hijos plenamente capacitados para funciones tan elementales como la de seguir a su madre o buscar el alimento. Así, el cervatillo, aunque torpemente, se levanta inmediatamente tras su salida del seno materno para, primero con dificultad y más tarde con precisión. encontrar las ubres maternas. Pero no sólo llega a este mundo con habilidades olfativas y motoras, sino con la suficiente coordinación instintiva como para conocer a su madre entre miles de sus congéneres.
Por el contrario, nuestro recién nacido es ciego, inválido para moverse en busca de su sustento y dependiente de la madre durante aĖos, siendo incapaz siquiera de acercar la boca a la mama con la que su madre le ofrece su primer alimento. Por no citar su indefensión, que le obliga a descansar en sus padres su protección y defensa hasta bien alcanzada la pubertad. Sin embargo, este aparente retraso evolutivo no es más que un mero guiĖo de la Naturaleza, algo aparente tras lo cual se esconde uno de los mayores logros de los seres vivientes, tan importante que les ha permitido desarrollarse hasta el extremo de ser conscientes de sí mismos y de llegar a preguntarse acerca del misterio de su existencia, procedencia o futuro. Les ha permitido generar aquello que los iguala a los dioses, aquello que es el origen de sus innegables éxitos, aquello que los ha hecho superiores, aquello que los ha hecho, en una palabra, inteligentes.
Pero para llegar a esta sorprendente conclusión deberemos profundizar en el tempus del desarrollo de nuestro Sistema Nervioso, para ver cómo nuestra especie ha escogido un certero diseĖo para su desarrollo, aunque envuelto en una aparente estela de retraso y precariedad. Porque, en un principio, todo parece falsar nuestra hipótesis. Así, el peso del cerebro de nuestro recién nacido es muy inferior al del adulto, en una proporción muy lejana a la mayoría de las especies. De hecho, la mayoría de los mamíferos son "precoces", es decir, su cerebro se desarrolla pronto en el seno de la madre. Por el contrario nuestra especie es claramente "no precoz", puesto que el 80% de su desarrollo se realiza tras el parto, a lo largo de los cuatro primeros aĖos de vida extrauterina (Figura 1).
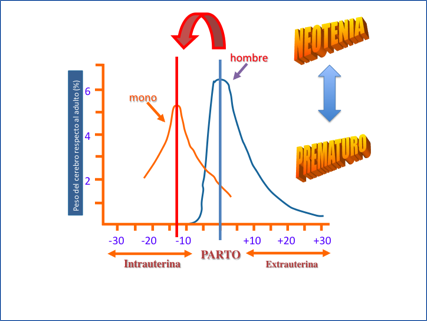
Figura 1.- Vida intrauterina-extrauterina. Modificado de Dobbing and Sands (1979) Early Hum Devel 3: 79-84.
Es necesario resaltar que todo parece aconsejar el desarrollo intrauterino, puesto que en el seno de la madre el feto se encuentra perfectamente protegido de las agresiones fisicoquímicas externas. En este entorno, termorregulado y amortiguado, el desarrollo transcurre armónicamente, sin distorsiones ni influencias indeseables. Es más, los monos, es decir, nuestros más cercanos predecesores en el árbol evolutivo, han optado por la precocidad, puesto que consuman el desarrollo de su cerebro mucho antes de acceder a la vida extrauterina. Pero olvidamos que la evolución es la antítesis del confort, puesto que la selección natural es, sin duda, el paradigma del cambio.
Pensaremos, quizás, que el peso del cerebro (Figura 1) es un burdo índice del desarrollo cerebral y que, si investigamos a fondo, encontraremos en nuestro recién nacido un Sistema Nervioso avanzado en su dimensión microscópica aunque inmaduro en su aspecto anatómico. Nada más lejos de la realidad; si utilizamos herramientas moleculares que nos hablen del grado de desarrollo bioquímico del cerebro de nuestro neonato, nos encontramos con un panorama semejante. Así, las enzimas de la glucolisis, quizás el proceso bioquímico evolutivamente más antiguo, muestran una inmadurez palmaria en nuestro neonato, aunque están plenamente desarrolladas en las especies precoces antes indicadas. Nuestra especie, por el contrario, tiene que esperar meses de vida extrauterina para conseguir un grado de desarrollo similar al de las especies precoces.
Resistiéndonos a aceptar el retraso de nuestra especie, pensaríamos que las células del cerebro de nuestro recién nacido puede que sean más primitivas, pero quizás más eficientes, en sus funciones nerviosas. No obstante, tenemos que rendirnos a la evidencia de que el cerebro de nuestro recién nacido es claramente inmaduro, puesto que el número de conexiones sinápticas es muy bajo en el momento del nacimiento.
De hecho, la mayor parte de las interconexiones neuronales se llevan a cabo postnatalmente, acompaĖadas del crecimiento del entramado glial. Podríamos argüir, sin embargo, que el desarrollo bioquímico, celular o sináptico, no tiene paralelismo con el desarrollo de la inteligencia y que, por consiguiente, toda inferencia al respecto tiene, a lo más, un interés anecdótico.
Pues bien, el difícil reto de la valoración del grado de inteligencia del recién nacido fue abordado por Morgan (Morgan, 1979) en un intento de evaluar tanto el “tempo” como el “tempus” del retraso mental producido en el Síndrome de Down. Para ello, estudió el desarrollo del coeficiente de inteligencia en recién nacidos normales, con objeto de conocer la influencia del Síndrome de Down en el desarrollo cognitivo. De acuerdo con sus datos, el coeficiente intelectual crece en el recién nacido tras el parto, en un rápido ascenso que es prácticamente anulado por la enfermedad. Por otro lado, el retraso en el desarrollo intelectual producido por el Síndrome de Down coincide con cambios en el contenido lipídico del cerebro del enfermo, relativo a una caída de los ácidos grasos monoinsaturados, así como con una disminución de las conexiones sinápticas (Shah 1979, Elul et al. 1975).
Es evidente, pues, que nuestro recién nacido accede a la vida extrauterina con un cerebro inmaduro, un hecho que no parece obedecer a un patrón filogenético, puesto que las especies más cercanas, p.ej. los de la familia Hominidae, no lo siguen. Sin embargo, no tenemos que recurrir al invento de nuevas pautas para entender este fenómeno, puesto que, si por un momento olvidamos la paradoja de que los seres más evolucionados lleguen al mundo en tan precarias condiciones y comparamos la situación con otras similares observadas en vegetales o animales, todo nos invita a aceptar que se trata de un caso de neotenia (Medina, 2002).
Como sabemos, la neotenia es un salto evolutivo mediante el cual se impone la persistencia en el adulto de rasgos juveniles que parecen quedar "congelados" durante el desarrollo ontogénico (Milner, 1995). Tenemos ejemplos de rasgos neoténicos en todos los reinos de los seres vivos. Desde las plantas adultas, que conservan características propias de las plántulas, hasta insectos que permanecen en forma de larva durante toda su vida, mientras que sus congéneres se desarrollan más allá del estado pupa. Este fenómeno es también observable en el hombre, que conserva el hirsutismo y la cabeza erecta del feto de los primates.
Por otro lado, la neotenia ha ayudado a explicar, al menos en parte, los saltos evolutivos que nos muestra el registro fósil y que tanto preocuparon a Darwin. Así, resulta inexplicable que ciertas especies hayan perdurado sin cambios aparentes, mientras que otras hayan cambiado profusamente, generando una extensa variedad de especies prole.
Darwin lo atribuyó a que el registro fósil estaba incompleto, sin embargo, los "saltos" son observables aún hoy, que conocemos el registro mucho mejor. Es más, hoy sabemos que los saltos evolutivos no coinciden con las grandes extinciones sino, muy probablemente, con saltos neoténicos. De hecho, la neotenia ha dado base a la teoría "saltista", "episódica" o "puntuista" de la evolución, la cual intenta explicar los saltos evolutivos manifestados por ciertas especies. De hecho, el fenómeno neoténico podría explicar el "efecto fundador", como denomina Mayr a la innovación introducida por ciertas especies, o la aparición de los "monstruos esperanzadores", que según Goldschmidt fueron los grandes mutantes que dirigieron la evolución.
Por consiguiente, la neotenia se considera esencial en la evolución de los primates, ya que el hombre posee numerosas características del feto de los simios. El cuello erecto, la cara plana, los grandes ojos, el hirsutismo, etc. son características presentes en el feto de los simios pero inexistentes en los primates adultos, excepto en el hombre. De hecho, se dice que el hombre es un feto de simio adulto, puesto que conserva muchas de sus características morfológicas. Desafortunadamente, el hecho de tratarse de una similitud aparentemente morfológica ha restado interés a la investigación de las causas y efectos de tal salto neoténico, quedando sin respuesta el cómo, el porqué y el para qué de este fenómeno. Intentaremos dilucidar este misterio en las próximas líneas.
La respuesta a cómo tiene lugar el salto neoténico es bien sencilla: el salto neoténico se produce por el adelanto del parto en la especie humana. Es decir, se trata de un parto prematuro, en el que el feto humano accede a la vida extrauterina inmaduro, posiblemente hacia la mitad del desarrollo normal del feto de simio. No obstante, la neurogénesis es un proceso precoz en el hombre, de manera que, aun prematuro, el feto ha llevado a cabo gran parte de la proliferación neuronal en el momento del nacimiento. Es verdad que aún le quedan por realizar las tareas más importantes, tales como la diferenciación neuronal y la glial, así como la neurogénesis secundaria y la sinaptogénesis.
Sea como fuere, el supuesto parto prematuro contesta al cómo se ha llevado el proceso neoténico, aunque no al porqué, es decir, a cuáles fueron las causas últimas que provocaron la instauración sistemática del parto prematuro en nuestra especie. Todo parece indicar que el adelanto del parto tuvo lugar como consecuencia de la excesiva encefalización del feto de nuestra especie, que aumentó de tal manera su tamaĖo que superó la capacidad del estrecho superior de la pelvis (Arsuaga y Martínez, 1998).
A las dificultades originadas por el tamaĖo del cráneo del feto a la hora del parto hay que aĖadir las derivadas de la postura erecta que la mujer adopta como consecuencia de la bipedación. Así, en los simios el coxis se sitúa de manera que el orificio pélvico coincide casi en línea recta con la vagina. En la mujer, sin embargo, el feto una vez que atraviesa la pelvis tiene que girar dorsoventralmente para embocar el cuello uterino.
De todas maneras, la instauración de la bipedación y, por consiguiente, la colocación cuasi-sagital de las caderas ocurrió, posiblemente, antes del adelanto del parto, puesto que, si éste se debió a un exceso de encefalización, es a partir del Homo habilis/rudolfensis cuando el tamaĖo del encéfalo se duplica en relación a los simios. En efecto, dado que la cadera de Lucy (Australopithecus afarensis) ya se parece mucho a la de la mujer actual, el primer tramo de encefalización, hasta el Homo habilis/rudolfensis, en el que se duplica el volumen del encéfalo, tiene lugar cuando la disposición de las caderas ya impide un parto fácil. Es, posiblemente, en este tramo, de aproximadamente un millón de aĖos, cuando se instaura el parto prematuro.
La instauración de esta pauta en el adelanto del parto se llevó a cabo, posiblemente, bajo las crueles reglas de la selección natural. Aquellas mujeres en que se le adelantó el parto sobrevivieron junto a su prole. En las que fisiológicamente siguieron su curso, el tamaĖo del encéfalo impediría el parto provocando, posiblemente, la muerte de ambos, madre y feto.
Una visión menos catastrofista y, posiblemente, más real, propondría que el excesivo volumen del encéfalo con respecto a la edad gestacional provocaría el parto prematuro a través de los mecanismos habituales. Quizás el elevado volumen del feto presionaría la decidua aumentando la producción de PAF ("platelet activation factor"), induciendo la secreción de las prostaglandinas F2α y E2, lo que incrementaría los efectos de la oxitocina sobre las contracciones del útero. Si fuese así, se salvaría la vida de la madre y del hijo, además de dar un salto genial en el desarrollo de nuestra especie.
En resumen, el excesivo tamaĖo del encéfalo junto con la estrechez de la pelvis provocada por la bipedación provoca el adelanto del parto, lo que resultaría en un salto neoténico (Figura 1). Curiosamente, esta idea del adelanto del parto ya fue enunciada en 1977 por el célebre naturalista Stephen Gould (Gould, 1977), aunque no fue tenida en cuenta dado lo exagerado de su propuesta, puesto que proponía que el feto humano había accedido a la vida extrauterina con más de un aĖo de adelanto. Sea como fuere, las ventajas a largo plazo de este hecho son evidentes, puesto que la encefalización puede continuar postnatalmente de manera ilimitada, hasta el punto de que el Homo sapiens sapiens triplica el coeficiente de encefalización de los demás simios. Por consiguiente, el adelanto del parto puede ser la clave de la alta encefalización de los homínidos, que permitió el desarrollo cerebral sin restricciones y que, por lo tanto, dio paso a la aparición de la inteligencia (vide infra).
Podemos resumir nuestra hipótesis como sigue: conocemos que la bipedación es tan antigua como la de los Ardipithecus (5,5-4,5 millones de aĖos). Por consiguiente, la mujer homínida es erecta desde hace 5-6 millones de aĖos, lo que conduce a una adaptación del "aparato" pélvico, de manera que el estrecho superior se va haciendo progresivamente más circular. Asimismo, la pelvis se va alargando hacia la zona ventral, tomando una forma muy femenina, es decir, se diferencia cada vez más de la del macho, adoptando una forma característica que se ha denominado "hiperfemenina", no existente en otros simios. Este hecho es ya ostensible en los Australopithecus, puesto que sus hembras tiene el estrecho superior muy poco ovalado y su pelvis se alarga ventralmente, tomando la forma típicamente hiperfemenina.
Por consiguiente, aproximadamente 2 millones de aĖos después de la aparición de la bipedación, la mujer ha adaptado su pelvis para el difícil parto a que le obliga la adopción de la posición erecta. La bipedación ha impuesto una pelvis situada en una posición casi paralela al suelo, con objeto de balancear los pesos durante la bipedación, cuando uno solo de los pies sostenga el tronco durante el desplazamiento. Así, las claras ventajas de la bipedación imponen a la mujer la servidumbre de una postura de la pelvis que dificulta el parto. En este sentido, el feto humano tiene que girar casi 90 grados para embocar la vagina tras su paso por el hueco pélvico, muy diferente de los simios en los que la posición inclinada de la pelvis sitúa el orificio pélvico y la vagina en una misma dirección (Figura 2).
Esto quiere decir que a partir de Lucy (Australopithecus afarensis; 3,3 millones de aĖos) la mujer está preparada para el difícil parto a que le obliga la bipedación. No es de extraĖar, por tanto, que a partir de este momento se acelere la encefalización, duplicándose el volumen del cerebro en apenas 1 millón de aĖos. Dado que la cesárea no es aún practicable, la única solución es la de adelantar el parto, de manera que el cráneo del feto, aún pequeĖo, pueda atravesar la pelvis por el estrecho superior y acceder a la vida extrauterina indemne, aunque para ello deba ser, al principio, un ser inmaduro y desvalido. Progresivamente, la selección natural favorece a las mujeres que adelantan el parto, hasta que la prematuridad se implanta como algo natural, confundiéndose con la duración "normal" de la gestación en nuestra especie. Se abre paso a la encefalización postnatal que, al no estar limitada estéricamente, inicia un camino de amplios horizontes que va a finalizar en la creación de la mente. Sin embargo, el camino neoténico es peligroso, puesto que el recién nacido neoténico es inmaduro y extremadamente vulnerable al entorno extrauterino.
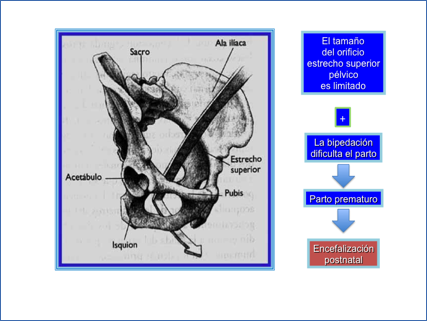
Figura 2.- Orificio pélvico. Dibujo de Arsuaga y Martínez (1998). “La especie elegida”, Ediciones Temas de Hoy S.A. Madrid.
Pero siguiendo la apuesta evolutiva se apuesta por el riesgo, se apuesta por lo difícil. Puesto que el premio puede ser importante, el premio puede ser algo nunca visto hasta ahora, algo nuevo destinado a revolucionar el planeta. Se trata de la generación de la inteligencia, se trata del nacimiento de la mente. Es más, el propio camino, lleno de peligros e incertidumbres, va a dar resultados beneficiosos inesperados. Así, la dependencia paterna de nuestro recién nacido, motivada por su necesidad de protección y ayuda, le obliga a convivir con sus padres durante un largo período de tiempo. Entre tanto, sus padres no se limitan a cuidarlo en sus necesidades físicas y nutricionales, sino que aprovechan el tiempo para transmitirle sus experiencias y habilidades, advertirle de los peligros, enseĖarle la tecnología, los métodos cinegéticos, etc.
Se inicia, pues, la civilización, en la que se dan pasos adelante basándose en las experiencias de los predecesores; se aprende de los antecesores evitando repetir experimentos fallidos o inútiles. Es más, a partir del Homo ergaster comienza la comunicación oral, primero con gruĖidos y, posteriormente, en el Homo sapiens, con palabras claras y de creciente complejidad. Este hecho permitirá transmitir a la prole conocimientos y experiencias no vividas por uno mismo. Por consiguiente, con independencia del grado de desarrollo alcanzado, la dependencia paterna será civilizadora, además de contribuir al agrupamiento social que tanta importancia ha tenido en el desarrollo intelectual de nuestra especie.
La encefalización postnatal presenta, asimismo, ventajas extraordinarias para el desarrollo cerebral. Fuera del seno materno el recién nacido recibe una mayor cantidad de estímulos que, por “feedback”, van conformando el cerebro, aumentando el número de interconexiones neuronales y, en consecuencia, creando el complejo entramado nervioso que abrirá paso a la inteligencia. En este sentido, es un hecho bien conocido que el Sistema Nervioso requiere estímulos externos para su desarrollo, a los que responde creando nuevas conexiones interneuronales.
Así, sabemos que el estímulo de la luz es necesario para la creación de las vías nerviosas del sistema visual, así como que la "estimulación precoz" mejora el curso de los niĖos con determinadas secuelas neurológicas. Pues bien, cuando se accede a la vida extrauterina, los estímulos externos se constituyen en conformadores del Sistema Nervioso, cincelándolo hasta lograr los grados de perfección estructural y funcional que conocemos en el adulto. Todos los estímulos son aprovechados para que el tejido nervioso se desarrolle de manera que pueda dar cuenta de las difíciles tareas a las que deberá enfrentarse. Y este sistema es tan eficiente que el recién nacido aprende con prontitud a reconocer en la cara de la madre tristeza o alegría. Se establece pronto una relación enriquecedora entre el neonato y su entorno, que implementa no sólo su evolución intelectual sino, sin duda por ello, el desarrollo del sustrato material que lo sustenta.
2.2. Encefalización: en busca del tamaĖo necesario
Como hemos mencionado antes, la encefalización, es decir, el crecimiento desproporcionado de nuestro encéfalo con respecto a nuestro peso corporal, ha preocupado a los antropólogos, dado que parece una característica de los homínidos directamente relacionada con la aparición de la inteligencia. Es necesario mencionar que la encefalización no es una característica exclusiva de los homínidos, pues todos los mamíferos e, incluso, las aves, han incrementado su índice de encefalización a lo largo de la evolución filogenética.
Sin embargo, ha sido en los simios y, particularmente en los homínidos (Figura 3), donde este fenómeno se ha dado con una especial relevancia. De hecho, el índice de encefalización se ha triplicado en el Homo sapiens sapiens con respecto a los primates más cercanos, es decir, los chimpancés, los bonobos y los gorilas (i.e. los otros componentes de la familia Hominidae). Por consiguiente, es muy posible que una vez que el cerebro haya adquirido el tamaĖo necesario se haya desarrollado suficiente complejidad como para albergar funciones más allá de las puramente fisiológicas.
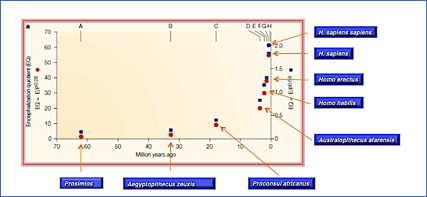
Figura 3.- Crecimiento del índice de encefalización. Modificado de Gilbert et al (2005) Nature Reviews Genetics 6: 581-590.
Estudios recientes (Gilbert et al. 2005) han mostrado que ciertos genes ejercen una fuerte influencia en el volumen del cerebro, especialmente en lo que se refiere a los lóbulos frontales, el córtex sensomotor y las áreas de Broca y de Wernicke, responsables, estas últimas, del habla. Así, el gen ASPM (“abnormal spindle microcephaly associated”) parece responsable de la encefalización de los homínidos, habiendo sufrido una fuerte selección natural durante los últimos 18 millones de aĖos y, muy especialmente, durante los últimos 6 millones de aĖos, coincidiendo con el período de mayor encefalización de los homínidos (Evans et al. 2004).
Es interesante constatar que la penúltima mutación del gen tuvo lugar hace 37.000 aĖos, coincidiendo con la aparición de las pinturas murales, normalmente asociadas con la aparición de la inteligencia y, la última, hace 6.000 aĖos, coincidiendo con la aparición de las primeras grandes civilizaciones (Evans et al. 2005). De hecho se acepta de una manera general que este gen es el responsable de la encefalización ocurrida entre los grandes monos y el hombre, mientras que otro gen relacionado, el MCPH1 (“Microencephalin1”), sería el responsable de la encefalización en el período evolutivo entre los simios y los grandes monos.
Sin embargo, más recientemente el grupo de Lahn (Mekel-Bobrov et al. 2005) ha puesto de manifiesto que, aunque ambos genes son responsables de la encefalización en los homínidos, su evolución no está directamente relacionada con la aparición de la inteligencia, ya que no existe relación entre los cambios evolutivos de estos genes y el coeficiente de inteligencia de los 2.393 individuos analizados.
Estos genes, han sido descubiertos por su implicación en enfermedades relacionadas con el desarrollo cerebral denominadas microcefalias, que se caracterizan por un crecimiento anormalmente bajo del volumen cerebral, causado por la proliferación anormal de los neuroblastos.
Las microcefalias (MCPH) son unas enfermedades autosómicas recesivas que se caracterizan por una reducción del volumen encefálico, sin grandes cambios en la distribución de la masa encefálica, a excepción del córtex, que está sensiblemente disminuido aunque manteniendo la arquitectura normal. Están también afectados el giro dentado, el bulbo olfatorio y la corriente migratoria rostral. Se acompaĖa de retraso mental de carácter ligero o medio (Bond et al. 2002).
Desde el punto de vista genético, las microcefalias se encuentran ligadas a mutaciones en cinco loci recesivos, aunque sin diferencias aparentes en el fenotipo. Están causadas por la mutación del gen ASPM, ortólogo del asp de Drosophila, localizado en cromosoma 1p31 y que codifica una proteína MAP (“microtubule associated protein”). La proteína, que posee un extremo amino terminal conservado en Drosophila, se une a los microtúbulos en un dominio repetitivo IQ (Ile y Gln repetidos) de unión a la calmodulina. Este último dominio se repite 24 veces en Drosophila y 74 veces en en la proteína humana, debido a la inserción de 10 repeticiones IQ en el exón 18. La pérdida de 425 aminoácidos, incluido el carboxilo terminal, produce la enfermedad, lo que sugiere que las todas las repeticiones IQ son necesarias para el correcto funcionamiento de la proteína (Bond et al. 2002).
La expresión de la proteína tiene lugar, fundamentalmente, en la zona ventricular del córtex y, en el ratón, comienza el día 11 de la fase embrionaria (E11), mostrando su expresión máxima a E15 y descendiendo a partir de E17. La expresión de la proteína es muy baja en el día del nacimiento (P0) y el día P9 está limitada a la zona subventricular, giro dentado y corriente migratoria rostral, es decir, las áreas en las que continúa la neurogénesis tras el parto (Bond et al. 2002). La localización de la proteína y su perfil temporal de expresión indican claramente que la proteína está implicada en la regulación de la neurogénesis.
De hecho, la proteína está implicada en la mitosis, concretamente en el ensamblaje de los microtúbulos en los polos y en el ecuador del uso cromático. Así, la mutación de la ASPM causa la parada de la división de los neuroblastos en metafase, lo que lleva consigo una disminución de la expansión del córtex. De hecho, si la división de los neuroblastos tiene lugar de manera simétrica, con el huso cromático paralelo al plano del neuroepitelio, se originan dos neuronas, mientras que si lo hace asimétricamente, es decir, perpendicular al neuroepitelio, se genera arriba una neurona y abajo una célula progenitora. Las mutaciones de ASPM parecen impedir la división asimétrica, responsable final de la expansión del córtex (Bond et al. 2002) (Evans et al. 2004).
2.3. Adquisición de la complejidad
Como hemos mencionado antes, el tamaĖo del encéfalo es necesario para el desarrollo del cerebro, dado que su estructura requiere un mínimo espacio necesario para la construcción del sustrato donde radicará un sistema tan sofisticado. Sin embargo, sin la complejidad necesaria el espacio quedaría vacío e impotente para cumplir sus destacados fines.
2.3.1. Desarrollo del córtex durante la etapa embrionaria
En los comienzos del desarrollo embrionario el tubo neural está formado por una capa de células que permanece más o menos estable hasta que el tubo neural se ha diferenciado, en lo que se ha denominado: tubo neural en cinco vesículas. Llegado este momento, se inicia la proliferación celular del epitelio comenzando por la zona más cercana al ventrículo, es decir, la denominada zona ventricular. De hecho, el neuroepitelio está formado por una sola clase de células alargadas que, en un momento dado, retraen sus procesos hacia la zona ventricular, donde entran en mitosis. Las primeras células en diferenciarse son las células gliales radiales, que extienden sus procesos perpendicularmente a la superficie del neuroepitelio a la que, finalmente, alcanzan (Figura 4).
De esta manera, extienden sus procesos en toda la anchura del neuroepitelio, constituyendo el “andamio” por el que las neuronas van a trepar en busca de destinos más lejanos. En efecto, las neuronas primordiales se disponen en estratos y comienzan a avanzar hacia la superficie del neuroepitelio, trepando por los procesos de las células gliales radiales para, finalmente, constituir las diversas capas (Figura 4) en las que se distribuyen las células en el córtex (Squire et al. 2003). Gracias a que las células gliales radiales poseen un antígeno específico, denominado RC2 (“intermediate filament-associated protein”, también Ifaprc2), de aparición precoz, se conoce que la diferenciación de las células gliales radiales es el fenómeno que inicia la neurogénesis (Tramontin et al. 2003).
En la zona ventricular las neuronas proliferan y, cuando salen de la mitosis, generan una capa en la que se excluyen los núcleos, denominada zona marginal, que está destinada a ser la más lejana del ventrículo cuando termina la diferenciación definitiva de la corteza cerebral. En este estadio, por consiguiente, el neuroepitelio está formado por dos zonas: la zona germinal cercana al ventrículo y, por encima de ella, la zona marginal, formada por los axones emitidos por las neuronas próximas a la zona germinal.
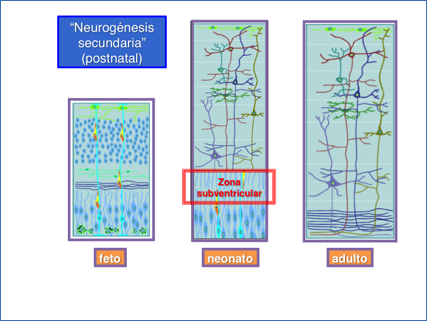
Figura 4.- Neurogénesis secundaria. Modificado de Squire et al (2003) Fundamental Neuroscience, Academic Press. London.
En este momento, algunas neuronas empiezan a alejarse del ventrículo, atraviesan la zona marginal y forman un nuevo estrato denominado preplaca. Entre los axones de la zona marginal y la preplaca aparece un nuevo estrato, denominado zona intermedia. Esta última zona constituirá el contacto de la corteza con el hipotálamo, una vez finalizada la diferenciación del Sistema Nervioso Central.
En resumen, al finalizar esta etapa, el neuroepitelio está formado por tres capas: la zona ventricular, formada por las células proliferativas multipotenciales, la zona intermedia, formada por axones y la preplaca, formada por las neuronas postmitóticas (Figura 4). El proceso continúa mediante la aparición de más neuronas en la zona ventricular que, posteriormente, migran a través de la zona intermedia a la preplaca, a la que expanden formando la placa cortical. Esta última queda limitada por una nueva zona denominada subplaca, contigua a la zona intermedia, mientras que por el extremo superior le cubre la zona marginal definitiva.
Finalizada la diferenciación, la placa cortical formará los estratos de la corteza cerebral, a excepción de la I (la más externa), que corresponderá a la zona marginal definitiva. Por el extremo inferior, la corteza estará limitada por la materia blanca, y sólo en las denominadas “zonas germinales secundarias” continuará la proliferación. Estas zonas, por su situación próxima al ventrículo y bajo el resto de la corteza, se denominan “zonas subventriculares” (Figura 4). En estos núcleos continuarán la neurogénesis y la gliogénesis durante el período postnatal. De hecho, la neurogénesis secundaria continúa, en el caso del hombre, hasta los dos aĖos, generando interneuronas, tales como las células granulares del cerebelo e hipocampo.
Las interneuronas cerebelosas se forman, asimismo, desde la zona germinal secundaria del cerebelo, aunque ésta última está situada en el exterior de este órgano, puesto que la migración cerebelar es centrípeta. En el proceso de formación de la placa neural intervienen las proteínas de la matriz extracelular, puesto que el déficit de una de ellas, la reelina, segregada por las neuronas de la lámina I del córtex y por las células de Cajal-Retzius (Meyer et al. 1999), impide la separación de la subplaca de la zona marginal definitiva, impidiendo la formación de la placa cortical y de las circunvoluciones cerebrales.
Para llevar a cabo la migración, la neurona adopta una forma bipolar, fielmente paralela al proceso glial. En el extremo más lejano de su lugar de origen comienzan a generarse unas uniones específicas entre neurona y célula glial, denominadas “uniones intersticiales”. Se trata de una estructura diferente a otras uniones intercelulares, consistente en un ensanchamiento del espacio intermembranal, que es ocupado por numerosos filamentos que se inician desde las proteínas de membrana de las neuronas conectadas con el citoesqueleto. Todo parece indicar que las uniones intersticiales sirven de anclaje a la neurona para iniciar la escalada, que se repite una y otra vez hasta alcanzar la ubicación adecuada.
En el proceso glial se expresa una proteína de reconocimiento, denominada astrotactina, que es reconocida por la neurona y que, al parecer, inicia la formación de la unión intersticial. Se trata de una proteína con repeticiones de EGF y de algunos dominios de la fibronectina tipo III. Una vez anclada en el proceso del astrocito, la neurona traslada su soma para avanzar mediante un mecanismo en que intervienen diversos factores, entre ellos una proteína asociada a los microtúbulos denominada doblecortina (Francis et al. 1999). Al mismo tiempo se produce la nucleoquinesis, un fenómeno en el que están implicadas varias proteínas, entre ellas la dineína y la proteína codificada por el gen LIS1 (“lissencephaly type-1-like domain-containing protein”).
Las neuronas que van a llevar a cabo la migración tangencial abandonan el andamio glial, mientras que la mayoría continúan hasta alcanzar el estrato previsto.
Un hecho fundamental dentro de la migración radial es que, cuanto más jóvenes sean las neuronas, más lejano será su lugar de residencia definitivo, de manera que las primeras que salen de la zona germinal ventricular ocupan los lugares más cercanos, mientras que las que se generan posteriormente alcanzan estratos más externos. Es necesario destacar que el andamio glial es permisivo y no instructivo en cuanto a la diferenciación neuronal. En otras palabras, las células gliales radiales permiten la migración de las neuronas pero no determinan ni su lugar de residencia ni sus características fenotípicas.
En este sentido, la migración neuronal puede consistir en una serie de interacciones célula-célula, en las que la neurona llevaría consigo sus destinos tópico y fenotípico, usando la glía sólo como guía y soporte. De ser así, la neurona, al detectar la astrotactina, generaría una seĖal inductora de la síntesis de todas aquellas proteínas necesarias para la migración, mientras que mantendría una seĖal en la glía para que colaborara en su movimiento. Una vez alcanzado su lugar de destino, la propia neurona silenciaría los mecanismos de migración propios, así como los de la célula glial radial.
La formación de las capas de la corteza cerebral está condicionada por los estratos previamente existentes (Figura 4). Así, las primeras células en proliferar darían origen a la lámina VI, es decir, a la más cercana a la zona ventricular. La diferenciación final de estas células vendría controlada por factores tróficos procedentes de la zona ventricular. Una vez ocupada la primera capa, las células de ésta liberarían factores que marcarían el desarrollo de las células que, procedentes de la zona ventricular, ocuparían la segunda capa. Los factores tróficos procedentes de la primera capa no germinativa regularían la diferenciación de la capa que la cubre, y así sucesivamente. Por consiguiente, cada célula diferenciada liberaría los factores neurotróficos necesarios para la diferenciación de la siguiente capa, generándose un gradiente de factores que pondrían en funcionamiento la expresión de grupos de genes (“subrutinas”) que originarían las características tópicas y fenotípicas propias de cada capa. La diferenciación de cada una de las capas dependerá de las subrutinas puestas en funcionamiento y del orden en que éstas son inducidas (Meyer et al. 1999).
2.3.2. Desarrollo postnatal del cerebro
El cerebro del recién nacido humano sigue su crecimiento durante el período postnatal, multiplicando por cuatro su peso debido a la proliferación neuronal y glial, con el correspondiente crecimiento de axones, dendritas y procesos gliales. Por otro lado, la mielinización es un proceso eminentemente postnatal, contribuyendo muy sensiblemente al aumento del volumen y del peso del cerebro del neonato. Este crecimiento se corresponde con un aumento del volumen del cráneo, a la vez que existe un aumento de las circunvoluciones cerebrales, aprovechando eficientemente el espacio disponible. Así, en la etapa postnatal, concretamente durante el primer aĖo, se desarrollan totalmente los denominados surcos terciarios, es decir, las circunvoluciones cerebrales que han aparecido durante los dos últimos meses de la gestación.
La neurogénesis “secundaria”, llamada así porque tiene lugar en la segunda fase de proliferación neuronal, es característica de los vertebrados y en el hombre tiene lugar durante el período postnatal. De hecho, durante la fase postnatal de la neurogénesis se genera un importante número de poblaciones neuronales de gran importancia en el desarrollo final del Sistema Nervioso Central. La proliferación neuronal secundaria se lleva a cabo en las denominadas “zonas germinales secundarias”, áreas del cerebro y del cerebelo que continúan generando neuronas hasta el segundo aĖo de vida.
En el recién nacido, la corteza cerebral está limitada en su extremo inferior por la materia blanca que, excepcionalmente, se interrumpe por las zonas germinales secundarias que, por su situación próxima al ventrículo y bajo el resto de la corteza, se denominan zonas subventriculares (Kostovic et al. 1989). En el caso del cerebelo, estos núcleos o zonas compactas están situados cercanas al labio rómbico, siendo la migración de la nuevas neuronas de carácter centrípeto y no centrífugo, es decir, siguiendo un comportamiento similar al de las neuronas “primarias”.
En estas zonas del cerebro y del cerebelo la neurogénesis y gliogénesis continúan durante el período postnatal, prolongándose en el caso del hombre hasta los dos aĖos de vida. En el cerebro, la zonas subventriculares dan origen a neuronas que emigran al bulbo olfatorio o forman las células granulares del hipocampo, aunque también se forman células gliales de la corteza. En el cerebelo, las zonas germinales subventriculares dan lugar a interneuronas, mientras que las del labio rómbico generan células granulares, que formarán la capa granular interna del cerebelo. Las neuronas “secundarias” generadas en esta segunda fase se intercalan en las estructuras ya existentes creadas durante la neurogénesis primaria, completando así la compleja estructura del Sistema Nervioso Central.
El crecimiento postnatal del número de neuronas tiene lugar principalmente en el córtex, donde, dependiendo de las zonas, el crecimiento neuronal continúa hasta los cinco meses, como en el caso de la corteza visual, o hasta los siete aĖos, como en el córtex frontal. La proliferación neuronal se acompaĖa del crecimiento de las dendritas, lo que indica que la diferenciación sigue a la proliferación. Así, el número de espinas dendríticas, aquellas estructuras donde se realizan las sinapsis, aumenta hasta los cinco meses en la corteza visual, coincidiendo con la neurogénesis. De hecho, el número de sinapsis crece exponencialmente tras el nacimiento, multiplicándose por dos entre el segundo mes y el final del primer aĖo. Asimismo, el consumo de glucosa, un excelente índice del metabolismo energético, aumenta significativamente hasta el cuarto aĖo, lo que refleja el esfuerzo sinaptogénico que se lleva a cabo durante este periodo (Johnson, 2001).
La proliferación celular y la neurogénesis continúan en las paredes laterales de los ventrículos laterales durante la vida postnatal, particularmente en las zonas cercanas a las eminencias ganglionares media y lateral. En los roedores (Tramontin et al. 2003), la denominada zona ventricular, única capa del córtex durante la fase embrionaria, continúa proliferando durante la vida postnatal. Así, las células de esta zona entran en fase S y migran hacia el lumen ventricular donde se dividen. En el momento del nacimiento la zona periventricular granular es muy extensa, diferenciándose dos zonas, la zona ventricular y la subventricular, también llamada subependimal. La zona ventricular se caracteriza por expresar noggina, mientras que la zona subventricular expresa DLX2 (“distal less”), un marcador de “precursores secundarios”.
En el momento del nacimiento la mayoría de las células son glías radiales, puesto que expresan RC2, un antígeno específico de estas células, aunque también se observan algunos ependimocitos inmaduros. Muy pocas son GFAP positivas, un marcaje específico de los astrocitos de la zona subventricular. A los siete días de vida extrauterina, la proporción de células radiales ha disminuido a favor de los ependimocitos inmaduros, lo que sugiere que las glías radiales han dado origen a las células ependimales inmaduras. En este estadio comienzan a aparecer las células GFAP positivas, es decir, los astrocitos de la zona subventricular.
Por último, en el día 15 las glias radiales han desaparecido, por lo que la zona ventricular está compuesta por ependimocitos maduros e inmaduros (Spassky et al. 2005). En este momento la mayoría de las células son GFAP positivas, lo que sugiere la presencia mayoritaria de astrocitos propios de la zona subventricular (Tramontin et al. 2003).
Por consiguiente, todo parece indicar que la glías radiales son las células madre neuronales, que se transforman en astrocitos de la zona subventricular durante las dos primeras semanas de vida extrauterina. Algunos de estos astrocitos de la zona subventricular, especialmente aquéllos que contactan con el lumen ventricular mediante un solo cilio, mantienen su capacidad pluripotencial y son la fuente de proliferación neuronal durante la etapa postnatal, incluida la vida adulta. La pluripotencialidad se conserva gracias a un ambiente rico en noggina que inhibe los BMPs (“bone morphogenic proteins”), lo que permite la neurogénesis (Tramontin et al. 2003).
Durante la vida adulta, la zona subventricular humana está formada por una capa de ependimocitos en contacto con el líquido cefalorraquídeo del ventrículo lateral, sobre la que se asienta una capa de astrocitos específicos de esta zona, algunos de ellos provistos de un cilio que contacta con el lumen ventricular. Estas últimas células son las verdaderas progenitoras, que proliferan para dar neuronas que migran tangencialmente (Merkle et al. 2004) (Quinones-Hinojosa et al. 2006) sin ayuda de la glía radial, en lo que se ha denominado corriente migratoria rostral. Las células de la corriente migratoria rostral forman cadenas de neuronas alargadas que se mueven dentro de “tubos gliales”, cuyas paredes están formadas por astrocitos que entrelazan sus procesos delimitando la corriente migratoria rostral de la zona circundante. Dentro de la corriente migratoria rostral, las neuronas se mueven paralelas a la dirección del flujo del líquido cefalorraquídeo que baĖa la pared del ventrículo lateral, siguiendo el gradiente de una molécula guía (Sawamoto et al. 2006). De esta manera, estas neuronas alcanzan el bulbo olfatorio donde se diferencian en, al menos, dos tipos de interneuronas, las neuronas granulares y perigranulares.
La corriente migratoria rostral es claramente ostensible en cerebro de rata en el momento del nacimiento, formando una “L” que parte de la zona subventricular en la pared del ventrículo lateral y se dirige ventralmente hacia el estriado, en los alrededores del ventrículo olfatorio para, posteriormente, tomar la dirección rostral hacia el bulbo olfatorio. Más tarde, coincidiendo con la desaparición del ventrículo olfatorio, la corriente migratoria rostral se estrecha progresivamente, formando una “L” que conecta la zona subventricular con el bulbo olfatorio mediante una línea densa de células. Durante el viaje, las células de la corriente están en continua división, observándose un gradiente de proliferación en el sentido caudorrostral, con un máximo en la zona subventricular y un mínimo en el bulbo olfatorio. La corriente migratoria rostral se mantiene durante todo el periodo postnatal y sigue presente en el adulto (Martoncikova et al. 2006). Recientemente se ha descubierto la presencia de la corriente migratoria rostral en el cerebro del hombre adulto, cuyas características son semejantes a las mencionadas anteriormente (Curtis et al. 2007)
Durante éstos últimos aĖos ha subsistido el misterio de cómo estas nuevas neuronas, generadas durante la “neurogénesis secundaria” que tiene lugar en la zona subventricular durante la etapa postnatal, podrían alcanzar su localización tópica, teniendo en cuenta que las células guías, es decir, las células glía radiales, desaparecen una vez estratificado el córtex. Este misterio ha sido resuelto recientemente por el grupo de Monyer (Le Magueresse et al. 2012), que han descubierto que, durante esta etapa, las neuronas utilizan los capilares sanguíneos para alcanzar los estratos indicados de la corteza cerebral durante la migración neuronal secundaria, tanto radial como tangencial (Figura 5).
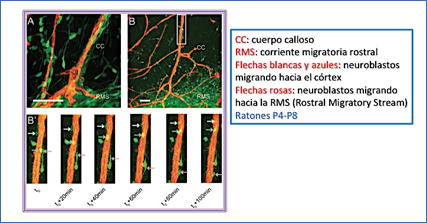
Figura 5.- Durante el período perinatal los neuroblastos migran hacia el córtex usando el sistema vascular como guía. Le Mageresse et al Cerebral Cortex (2011) 22: 2285-2296.
2.3.3. Papel del ácido oleico en el desarrollo postnatal del cerebro
Como se ha mencionado antes, gran parte del desarrollo del Sistema Nervioso Central en el hombre tiene lugar durante la etapa postnatal, cuando se lleva a cabo la “neurogénesis secundaria” y la conformación final del hipotálamo, así como la de otras estructuras cerebrales específicas. De hecho, la neurogénesis postnatal ha suscitado un extraordinario interés desde el punto de vista clínico, pues la inmadurez de la zona subventricular es la responsable de la extraordinaria vulnerabilidad del recién nacido al trauma hipóxico-isquémico. Este hecho es especialmente crítico en el recién nacido prematuro, en el que el distrés respiratorio produce tales cambios en la dinámica vascular que puede causar hemorragias subventriculares de efectos deletéreos permanentes.
Resultados procedentes de nuestro laboratorio han puesto de manifiesto que el ácido oleico controla el desarrollo postnatal del Sistema Nervioso Central en la rata (Tabernero et al. 2001) (Medina y Tabernero, 2002) (Velasco et al. 2003). En efecto, el ácido oleico se sintetiza en los astrocitos (Tabernero et al. 2002), de donde es enviado a las neuronas como mensajero de la acción neurotrófica.
De hecho, el ácido oleico no sólo es utilizado para la construcción de la membrana neuronal sino que actúa como agente neurotrófico, promoviendo el crecimiento de los axones y de las dendritas, la migración neuronal y la formación de las sinapsis. Estos cambios morfológicos se sustentan en la inducción de la síntesis de proteínas específicas del desarrollo neurítico, tales como la MAP2 (“microtubule associated protein-2”), marcadora del desarrollo de las dendritas, y de la GAP43 (“growth associated protein 43”), marcadora del crecimiento axonal (Tabernero et al. 2001). Asimismo, el ácido oleico promueve la síntesis de seĖales de migración neuronal, tales como la doblecortina, así como la de proteínas que participan en las sinapsis, tales como la PSD 95 y la sinaptotagmina.
; El efecto del ácido oleico es sinérgico con el de las neurotrofinas NT-3 y NT-4/5, aunque no con el del NGF ni del BDNF (Granda et al. 2003), lo que sugiere que durante el periodo perinatal el ácido oleico se comporta como un agente neurotrófico específico. En este sentido, el efecto del ácido oleico es singular de este ácido graso, pues ni siquiera su isómero en trans, el ácido elaídico, es capaz de mimetizar sus efectos (Rodríguez-Rodríguez et al. 2004).
; Asimismo, en nuestro laboratorio se ha identificado el mecanismo de transducción de la seĖal del ácido oleico en neuronas. En este sentido, el PPARalfa es el receptor nuclear del ácido oleico, puesto que su silenciamiento mediante RNA de interferencia (siRNA) suprime los efectos neurotróficos del ácido graso (Bento-Abreu et al. 2007). Además, el ácido oleico induce la síntesis del factor de transcripción NeuroD2, que juega un papel esencial en las últimas etapas del desarrollo neuronal (Rodríguez-Rodríguez et al. 2004). Es más, la proteína kinasa C está implicada en el efecto del ácido oleico, puesto que la presencia de inhibidores específicos de la kinasa suprime los efectos neurotróficos del ácido graso (Rodríguez-Rodríguez et al. 2004, Tabernero et al. 2002) (Bento-Abreu et al. 2007).
El ácido oleico se sintetiza en los astrocitos bajo el estímulo de la albúmina sérica (Tabernero et al. 2002). En efecto, la albúmina es reconocida por la megalina (Bento-Abreu et al. 2008), una proteína de la familia de los receptores de las lipoproteínas, siendo posteriormente endocitada por caveolas. Una vez en el interior del astrocito, la albúmina es conducida al retículo endoplasmático, donde activa al SREBP 1, un factor de transcripción que induce la estearil-CoA desaturasa, enzima clave de la síntesis de ácido oleico (Tabernero et al. 2002). En este sentido, el desarrollo postnatal del cerebro coincide con un aumento de la albúmina sérica en todas las especies, lo que se acompaĖa de la entrada específica de la albúmina en el cerebro durante este periodo (Velasco et al. 2003).
De hecho, inmediatamente tras el nacimiento se observa un aumento significativo de la forma activa del SREBP 1, un factor de transcripción que induce la expresión de diversas enzimas del metabolismo lipídico. Entre ellas, la de la estearil-CoA desaturasa, enzima clave en la síntesis de ácido oleico, ya que cataliza la introducción del doble enlace característica de este ácido graso. El aumento de la expresión de la enzima se acompaĖa de la inducción de las proteínas marcadoras de crecimiento axonal y dendrítico GAP 43 y MAP 2, respectivamente (Velasco et al. 2003). Estos resultados, realizados in vivo, han sido confirmados en cultivos organotípicos. En este sentido, hemos demostrado recientemente que, tanto la albúmina como el ácido oleico, promueven el desarrollo del estriado, donde inducen el crecimiento y la fasciculación de los axones (Polo-Hernández et al. 2010). La importancia de este hecho viene corroborada por el reciente descubrimiento de que el ratón nulo de megalina, es decir, del transportador específico de albúmina, presenta holoprosencefalia (Kantarci et al. 2007), lo que seĖala a la albúmina y al ácido oleico como piezas clave en el desarrollo del SNC.
Por último, un grupo de investigadores del Hospital de Parapléjicos de Toledo ha descubierto que el tratamiento intratecal con el complejo albúmina-ácido oleico consigue reparar la lesión de médula espinal causada experimentalmente en animales (Ávila-Martín et al. 2011).
En resumen, todo parece indicar que la albúmina regula el desarrollo postnatal del Sistema Nervioso Central a través del aumento del ácido oleico, el cual actúa como factor neurotrófico del desarrollo neuronal. Por consiguiente, el aumento de las concentraciones de albúmina que tiene lugar inmediatamente tras el nacimiento es la seĖal para el desarrollo postnatal del Sistema Nervioso Central. Para ello, la albúmina promueve la síntesis de ácido oleico en los astrocitos, el cual difunde hacia las neuronas, en las que promueve el crecimiento dendrítico y axonal, así como la migración de las neuronas y la formación de sinapsis.
3. conclusiÓN
En la especie humana el desarrollo del Sistema Nervioso continúa tras el nacimiento, un hecho que, al contrario de lo esperado, resulta en un perfeccionamiento de las estructuras cerebrales, posiblemente responsable del surgimiento de la inteligencia en la especie humana. Este hecho explica la vulnerabilidad del cerebro humano durante la etapa perinatal y seĖala a este periodo como de especial atención en el manejo del recién nacido.
4. REFERENCIAS
1. Arsuaga, J. L. and Martínez, I. (1998) La especie elegida. Ediciones Temas de Hoy, S.A., Madrid.
2. Ávila-Martin, G., Galán-Arriero, I., Gómez-Soriano, J. and Taylor, J. (2011) Treatment of rat spinal cord injury with the neurotrophic factor albumin-oleic acid: translational application for paralysis, spasticity and pain. PLoS One, 6, e26107.
3. Bento-Abreu, A., Tabernero, A. and Medina, J. M. (2007) Peroxisome proliferator-activated receptor-alpha is required for the neurotrophic effect of oleic acid in neurons. J Neurochem, 103, 871-881.
4. Bento-Abreu, A., Velasco, A., Polo, E., Reyes, P. L., Tabernero, A. and Medina, J. M. (2008) Megalin is a receptor for albumin in astrocytes and is required for the synthesis of the neurotrophic factor oleic acid. J Neurochem.
5. Bond, J., Roberts, E., Mochida, G. H., Hampshire, D. J., Scott, S., Askham, J. M., Springell, K., Mahadevan, M., Crow, Y. J., Markham, A. F., Walsh, C. A. and Woods, C. G. (2002) ASPM is a major determinant of cerebral cortical size. Nat Genet, 32, 316-320.
6. Curtis, M. A., Kam, M., Nannmark, U., Anderson, M. F., Axell, M. Z., Wikkelso, C., HoltĆs, S., van Roon-Mom, W. M., Björk-Eriksson, T., Nordborg, C., Frisén, J., Dragunow, M., Faull, R. L. and Eriksson, P. S. (2007) Human neuroblasts migrate to the olfactory bulb via a lateral ventricular extension. Science, 315, 1243-1249.
7. Elul, R., Hanley, J. and Simmons, J. I. (1975) Non-Gaussian behavior of the EEG in Down's syndrome suggests decreased neuronal connections. Acta Neurol. Scand., 51, 21-28.
8. Evans, P. D., Anderson, J. R., Vallender, E. J., Choi, S. S. and Lahn, B. T. (2004) Reconstructing the evolutionary history of microcephalin, a gene controlling human brain size. Hum Mol Genet, 13, 1139-1145.
9. Evans, P. D., Gilbert, S. L., Mekel-Bobrov, N., Vallender, E. J., Anderson, J. R., Vaez-Azizi, L. M., Tishkoff, S. A., Hudson, R. R. and Lahn, B. T. (2005) Microcephalin, a gene regulating brain size, continues to evolve adaptively in humans. Science, 309, 1717-1720.
10. Francis, F., Koulakoff, A., Boucher, D. Chafey, P., Schaar, B., Vinet, M. C., Friocourt, G., McDonnell, N., Reiner, O., Kahn, A., McConnell, S. K., Berwald-Netter, Y., Denoulet, P. and Chelly, J. (1999) Doublecortin is a developmentally regulated, microtubule-associated protein expressed in migrating and differentiating neurons. Neuron, 23, 247-256.
11. Gilbert, S. L., Dobyns, W. B. and Lahn, B. T. (2005) Genetic links between brain development and brain evolution. Nat Rev Genet, 6, 581-590
12. Gould, S. J. (1977) Ever Since Darwin: Reflections in Natural History. Penguin, London.
13. Granda, B., Tabernero, A., Tello, V. and Medina, J. M. (2003) Oleic acid induces GAP-43 expression through a protein kinase C-mediated mechanism that is independent of NGF but synergistic with NT-3 and NT-4/5. Brain Res, 988, 1-8.
14. Johnson, M. H. (2001) Functional brain development in humans. Nature Rev. Neurosci., 2, 475-483.
15. Kantarci, S., Al-Gazali, L., Hill, R. S., Donnai, D., Black, G. C. M., Bieth, E., Chassaing, N., Lacombe, D., Devriendt, K., Teebi, A., Loscertales, M., Robson, C., Liu, T., MacLaughlin, D.T., Noonan, K. M., Russell, M. K., Walsh, C. A., Donahoe, P. K. and Pober, B. R. (2007) Mutations in LRP2, which encodes the multiligand receptor megalin, cause Donnai-Barrow and facio-oculo-acoustico-renal syndromes. Nat Genet, 39, 957-959.
16. Kostovic, I., Lukinovic, N., Judas, M., Bogdanovic, N., Mrzljak, L., Zecevic, N. and Kubat, M. (1989) Structural basis of the developmental plasticity in the human cerebral cortex: The role of the transient subplate zone. Metabol. Brain Disease, 4, 17-23.
17. Le Magueresse, C., Alfonso, J., Bark, C., Eliava, M., Khrulev, S. and Monyer, H. (2012) Subventricular zone-derived neuroblasts use vasculature as a scaffold to migrate radially to the cortex in neonatal mice. Cereb Cortex, 22, 2285-2296.
18. Martoncikova, M., Racekova, E. and Orendacova, J. (2006) The number of proliferating cells in the rostral migratory stream of rat during the first postnatal month. Cell Mol Neurobiol, 26, 1453-1461.
19. Medina, J. M. (2002) Origen neoténico de la mente. Gráficas Cervantes S.A., Salamanca.
20. Medina, J. M. and Tabernero, A. (2002) Astrocyte-synthesized oleic acid behaves as a neurotrophic factor for neurons. J Physiol Paris, 96, 265-271.
21. Mekel-Bobrov, N., Gilbert, S. L., Evans, P. D., Vallender, E. J., Anderson, J. R., Hudson, R. R., Tishkoff, S. A. and Lahn, B. T. (2005) Ongoing adaptive evolution of ASPM, a brain size determinant in Homo sapiens. Science, 309, 1720-1722.
22. Merkle, F. T., Tramontin, A. D., García-Verdugo, J. M. and Álvarez-Buylla, A. (2004) Radial glia give rise to adult neural stem cells in the subventricular zone. Proc Natl Acad Sci U S A, 101, 17528-17532.
23. Meyer, G., Goffinet, A. M. and Fairen, A. (1999) What is a Cajal-Retzius cell? A reassessment of a classical cell type based on recent observations in the developing neocortex. Cereb Cortex, 9, 765-775.
24. Milner, R. (1995) Diccionario de la evolución. Bibliograf S.A., Barcelona.
25. Morgan, S. (1979) Development and distribution of intellectual and adaptative skills in Down syndrome children: Implications for early intervention. Ment Retard., 17, 247-249.
26. Polo-Hernández, E., De Castro, F., García-Garcia, A. G., Tabernero, A. and Medina, J. M. (2010) Oleic acid synthesized in the periventricular zone promotes axonogenesis in the striatum during brain development. J Neurochem, 114, 1756-1766.
27. QuiĖones-Hinojosa, A., Sanai, N., Soriano-Navarro, M., González-Pérez, O., Mirzadeh, Z., Gil-Perotin, S., Romero-Rodriguez, R., Berger, M. S., García-Verdugo, J. M. and Álvarez-Buylla, A. (2006) Cellular composition and cytoarchitecture of the adult human subventricular zone: a niche of neural stem cells. J Comp Neurol, 494, 415-434.
28. Rodríguez-Rodríguez, R. A., Tabernero, A., Velasco, A., Lavado, E. M. and Medina, J. M. (2004) The neurotrophic effect of oleic acid includes dendritic differentiation and the expression of the neuronal basic helix-loop-helix transcription factor NeuroD2. J Neurochem, 88, 1041-1051.
29. Sawamoto, K., Wichterle, H., González-Pérez, O., Cholfin, J. A., Yamada, M., Spassky, N., Murcia, N. S., García-Verdugo, J. M., Marín. O., Rubenstein, J. L., Tessier-Lavigne, M., Okano, H. and Álvarez-Buylla, A. (2006) New neurons follow the flow of cerebrospinal fluid in the adult brain. Science, 311, 629-632.
30. Shah, S. N. (1979) Fatty acid composition of lipids of human brain myelin and synaptosomes: changes in phenylketonuria and Down's syndrome. Int J Biochem, 10, 477-482.
31. Spassky, N., Merkle, F. T., Flames, N., Tramontin, A. D., García-Verdugo, J. M. and Álvarez-Buylla, A. (2005) Adult ependymal cells are postmitotic and are derived from radial glial cells during embryogenesis. J Neurosci, 25, 10-18.
32. Squire, L. R., Bloom, F. E., McConnell, S. K., Roberts, J. L., Spitzer, N. C. and Zigmond, M. J. (2003) Fundamental Neuroscience. Academic Press, London.
33. Tabernero, A., Lavado, E. M., Granda, B., Velasco, A. and Medina, J. M. (2001) Neuronal differentiation is triggered by oleic acid synthesized and released by astrocytes. J Neurochem, 79, 606-616.
34. Tabernero, A., Velasco, A., Granda, B., Lavado, E. M. and Medina, J. M. (2002) Transcytosis of albumin in astrocytes activates the sterol regulatory element-binding protein-1, which promotes the synthesis of the neurotrophic factor oleic acid. J Biol Chem, 277, 4240-4246.
35. Tramontin, A. D., García-Verdugo, J. M., Lim, D. A. and Álvarez-Buylla, A. (2003) Postnatal development of radial glia and the ventricular zone (VZ): a continuum of the neural stem cell compartment. Cereb Cortex, 13, 580-587.
36. Velasco, A., Tabernero, A. and Medina, J. M. (2003) Role of oleic acid as a neurotrophic factor is supported in vivo by the expression of GAP-43 subsequent to the activation of SREBP-1 and the up-regulation of stearoyl-CoA desaturase during postnatal development of the brain. Brain Res, 977, 103-111.