REVISIÓN |
Avizores del Sistema Inmune, Guardianes del Organismo
Francisco Sánchez Madrid1,2*, Pilar Martín2
1Servicio de Inmunología. Hospital Universitario de la Princesa. Universidad Autónoma de Madrid. 2Dpto. Biología Vascular e Inflamación. Centro Nacional de Investigaciones Cardiovasculares.
Recibido el 5 de diciembre de 2011.
e-mail: fsanchez.hipr@salud.madrid.org
RESUMEN
La respuesta inmune comienza cuando nuestro cuerpo entra en contacto con sustancias extraĖas (antígenos), por ejemplo patógenos tales como bacterias o virus. Las células implicadas en la iniciación de la respuesta (células dendríticas y macrófagos tisulares) están situadas estratégicamente en los sitios de concentración de antígeno, donde son activadas localmente. El reconocimiento de los patógenos es mediado por un conjunto de receptores de diferentes familias de moléculas tales como los de tipo Toll (TLRs), tipo Nod (NLRs), tipo RIG o lectinas tipo C. Estas células emigran a los órganos linfoides, como los ganglios linfáticos, donde alertan y activan a otras células que inician una reacción en cadena para eliminar el patógeno. Estos procesos incluyen el “recuerdo” del antígeno a través de la generación de linfocitos de memoria, que perpetúan el recuerdo del antígeno que los activó inicialmente y esperan una recurrencia del ataque. Estas células de memoria pueden actuar mucho más eficazmente, previniendo la posible re-infección. El fenómeno de la memoria inmunológica es la base de los procesos de inmunización y de las vacunas. |
Palabras clave: Respuesta inmune innata; Células dendríticas; Receptores tipo Toll; Sinapsis inmune; Vacunas.
ABSTRACT
Immune system sentinels, guardians of the body
The immune response begins when our body comes in contact with foreign substances (antigens), for example pathogens such as bacteria or viruses. The cells involved in the initiation of the response (dendritic cells and tissue macrophages) are strategically placed at sites of antigen concentration where they are locally activated. Recognition of pathogens by these cells is mediated by a plethora of receptors from different molecular families, such as Toll-like (TLRs), NLRs, RIG-like and C-lectin receptors. These cells migrate to lymphoid organs such as lymph nodes, where they alert and activate other cells initiating a cascade of processes to eliminate the pathogen. These processes include the generation of “memory lymphocytes”, which perpetuate the memory of the antigen initially recognized and wait for a recurrence of the attack. These memory cells are able to act much more effectively, preventing possible re-infection. The phenomenon of immunological memory is the base of the processes of immunization and vaccines. |
Keywords: Innate immune response; Dendritic cells; Toll-like receptors; Immune synapse; Vaccines.
1. IntroducciÓn: Respuesta inmune innata
Los linfocitos poseen componentes moleculares de reconocimiento de antígenos extraordinariamente complejos y sofisticados: el receptor de antígeno de los linfocitos T y los anticuerpos de los linfocitos B. Este mecanismo hace posible que nuestro organismo se defienda de forma específica de determinados patógenos con los que ha entrado en contacto con anterioridad. Esto es lo que denominamos la inmunidad adaptativa. Otros componentes, de menor complejidad y diversidad, pero dotados de una gran eficiencia, conforman la llamada inmunidad innata o natural. La inmunidad innata tiene como primer objetivo ser la línea de contención inmediata frente a una infección, controlando y eliminando los agentes patógenos. Su segundo objetivo consiste en advertir y activar a la respuesta inmune adaptativa.
Entre las propiedades de la respuesta inmune innata se incluyen la actuación inmediata, que no requiere una sensibilización previa, y su amplia especificidad frente a sustancias ajenas al organismo que se lleva a cabo gracias al reconocimiento de patrones moleculares microbianos (PAMPs), que tienen en común determinados grupos de microorganismos. De esta forma, la respuesta innata contiene solo un número limitado de receptores para PAMPs (del orden de 103). Este aspecto contrasta con la respuesta inmune adaptativa, que reconoce detalles estructurales de componentes tanto microbianos como no microbianos, siendo la potencialidad de su repertorio de reconocimiento mucho mayor (del orden de 109).
El grupo del Prof. C. Janeway, postuló que las estructuras y patrones microbianos que pueden ser reconocidas por la inmunidad innata, además de desempeĖar un papel crítico en la inducción de la respuesta adaptativa posterior, deben cumplir las siguientes propiedades: i) estar ausentes en el organismo huésped; ii) estar conservadas en un gran número de microorganismos, de modo que puedan ser reconocidas por un número limitado de receptores; y iii) ser componentes esenciales de los microorganismos para así evitar su posible evasión del sistema inmune mediante mutación (1). Ejemplos de estos patrones microbianos son: el lipopolisacárido de la membrana exterior de las bacterias gram-negativas, los peptidoglicanos, los lipopéptidos, las secuencias CpG no metiladas de ADN bacteriano o el ARN vírico de doble cadena (Figura 1). Curiosamente, se conocía con anterioridad que todos esos tipos de moléculas eran capaces de inducir la cascada de seĖalización que conduce a la activación del factor de transcripción nuclear–kB (NF-kB) y así como de la respuesta inflamatoria. En ausencia del conocimiento detallado de los receptores para dichas estructuras microbianas, también se enunciaron hipótesis alternativas, donde se sustituyen las estructuras microbianas extraĖas al organismo, por las seĖales de peligro que pueden surgir tanto del exterior como del interior celular (2).
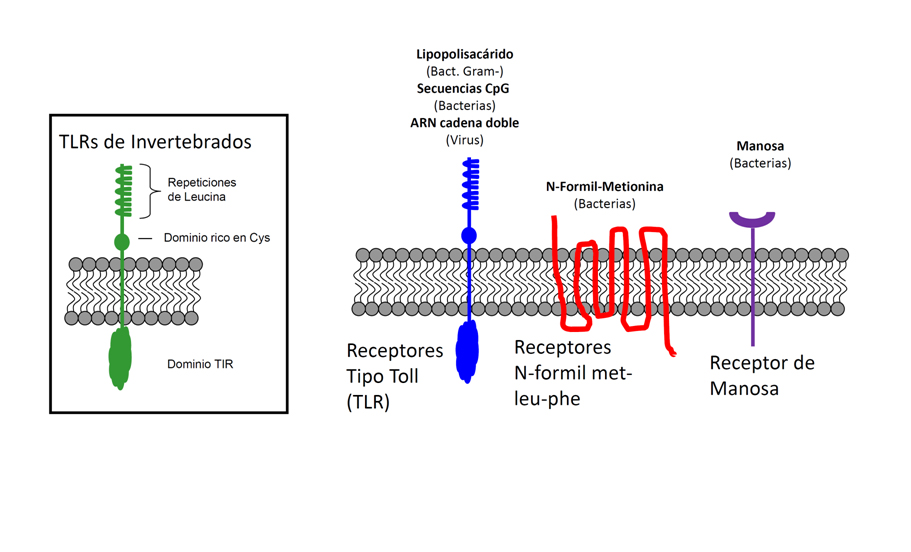
Figura 1.- Reconocimiento de patrones asociados a microorganismos patógenos (PAMPs). Tipos de PAMPs y sus receptores. En el recuadro se ilustra el esquema de la estructura de un receptor tipo Toll. Se representan los receptores para PAMPs, así como sus ligandos.
Las células que componen el sistema inmune innato, son esencialmente los fagocitos (neutrófilos, monocitos y macrófagos) y las células dendríticas (DCs) (Figura 2). Además, forman parte de la respuesta innata, las células citotóxicas naturales, o NK, y el sistema de complemento, que se ocupan de reconocer células daĖadas o infectadas y eliminarlas.
Debido al hecho de que algunos de estos tipos celulares poseen un sistema de receptores que reconoce patrones moleculares invariables, comunes para muchos microbios, su activación es considerablemente más rápida que la observada en la respuesta adaptativa. Esto las convierte en la primera barrera de la respuesta inmune, que permite el inicio de la respuesta inmunitaria. Aún así, la comunicación entre los dos tipos de inmunidad, innata y adaptativa, es necesaria para una respuesta inmune completa. El eslabón entre ambas ramas lo constituyen, precisamente, las DCs.
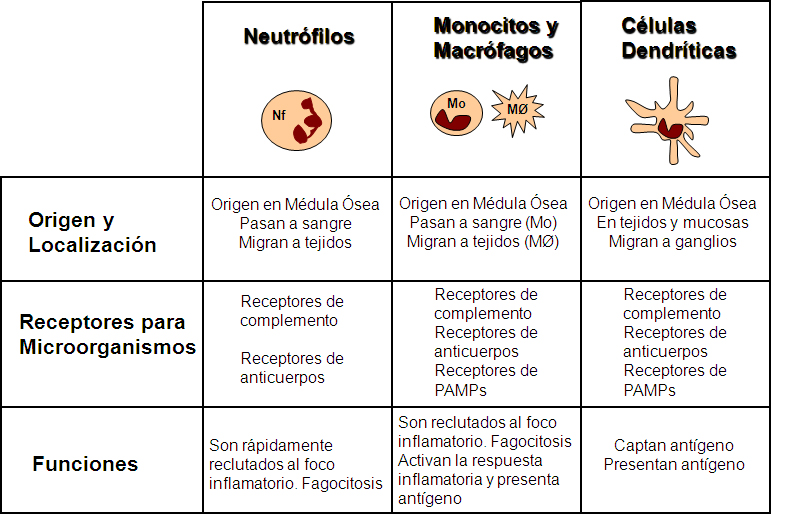
Figura 2.- Células principales del sistema inmune innato con capacidad de captura de patógenos.
El Nobel de Fisiología y Medicina 2011 premia tanto las investigaciones que asentaron las bases del reconocimiento de patógenos por parte del sistema inmune innato como el descubrimiento de las células dendríticas y su papel en la inmunidad adquirida. Los Profesores Jules Hoffman (Instituto de Biología Celular y Molecular, Universidad Estrasburgo, Francia), y Bruce A Beutler (Instituto de Investigación Scripps, La Jolla, CA) han sido galardonados por el descubrimiento de los sensores moleculares de las células del sistema inmune innato (macrófagos y células dendríticas), con los que detectan a los microbios patógenos, así como la ruta de activación intracelular que desencadena la respuesta inflamatoria. El Prof. Ralph M Steinman (Universidad Rockefeller, New York) comparte con ellos el Premio por su descubrimiento de las células dendríticas y por las investigaciones posteriores, de enorme trascendencia en medicina, que sitúan a este tipo celular como nexo entre las dos ramas de la respuesta inmune.
2. El descubrimiento del sistema de reconocimiento de los TLRs (toll y los Toll-Like Receptors)
La inmunidad innata, primera línea de defensa, opera tanto en animales invertebrados como vertebrados para contener agentes infecciosos, hallándose conservados los sensores para patógenos en ellos. Los estudios del grupo de Prof. J Hoffman en la mosca Drosophila melanogaster, parten de los estudios de la Dra C. Nusslein-Volhard, al comienzo de la década de los 80, sobre genes implicados en el desarrollo de la mosca, que organizan su simetría y polaridad, entre los que identificó el gen Toll (del alemán: Súper, Fantástico), que controla el establecimiento de su eje dorso-ventral (3).
Siguiendo la estela del trabajo del Prof. H Boman, que identificó en la hemolinfa del insecto una serie de potentes péptidos catiónicos antimicrobianos (4), el grupo del Dr. Hoffman identificó una nueva función para el gen Toll; la defensa de invertebrados frente a infecciones fúngicas (5). Concretamente, mediante el estudio de la regulación del péptido anti-fúngico drosomicina, observó que los mutantes en el gen Toll no eran capaces de expresar la drosomicina, y por tanto, eran muy susceptibles a las infecciones por el hongo Aspergillus fumigatus. Otro hallazgo de gran interés del grupo del Prof. Hoffman consistió en la identificación de motivos estucturales para NF-kB en la drosomicina (6). Conjuntamente con el grupo del Dr. Charles Janeway propusieron así la existencia de mecanismos y receptores conservados evolutivamente en invertebrados y mamíferos, responsables del control de la respuesta inmune innata (7, 8). Poco después, se revelaría la homología de las regiones citoplásmicas del receptor de IL-1 con la proteina Toll (9).
De forma independiente, el grupo del Dr. Beutler, mediante el análisis del proceso molecular de la sepsis durante la respuesta a infecciones por bacterias gram-negativas en ratones, descubrió el gen responsable de su reconocimiento por parte de los macrófagos. El receptor codificado por dicho gen, denominado TLR4 (Toll-like receptor, “receptor parecido a Toll”), por su gran homología con el gen Toll de Drosophila, reconoce el lipopolisacárido o endotoxina, componente patogénico de las bacterias. Simultáneamente, Beutler y otros describieron la serie de procesos intracelulares que se desencadena después de la activación de este receptor TLR4, que culmina en la producción de proteínas y citocinas pro-inflamatorias, como el Factor de Necrosis Tumoral (TNF-alfa). Desde entonces se consideraría a éste como indicador paradigmático de la inducción de la respuesta inflamatoria (10, 11).
3. Estructura, funciÓn y ligandos de los TLRs
Gracias a estos primeros estudios, se conocen actualmente al menos 11 genes TLRs, implicados en la defensa frente a agentes bacterianos, fúngicos y víricos (Figura 3). Se pueden agrupar en dos categorías, dependiendo de si su expresión es en la membrana plasmática o bien en compartimentos endosomales. Entre los TLRs expuestos en membrana celular, están TLR2, que puede asociarse a TLR1 o TLR6 para reconocer lipopéptidos di- o tri-acilados; TLR5 y TLR11, que detectan respectivamente las proteínas bacterianas flagelina, un componente esencial de la estructura del flagelo, o profilina del protozoo Toxoplasma. TLR4 a su vez, se encuentra en la membrana formando un complejo ternario con CD14, una molécula anclada por un enlace GPI, y la proteína de unión a lípidos MD2. La formación del complejo es necesaria para la transmisión de la seĖal intracelular (12). Los TLRs endosomales comprenden a TLR3, que reconoce ADN viral de doble cadena, TLR7 y 8, que reconocen ADN de cadena simple, y TLR9 para secuencias CpG no metiladas en ADN bacterianos (Figura 3). Estos TLRs son importantes como sistema sensor de infecciones intracelulares tanto víricas como bacterianas.
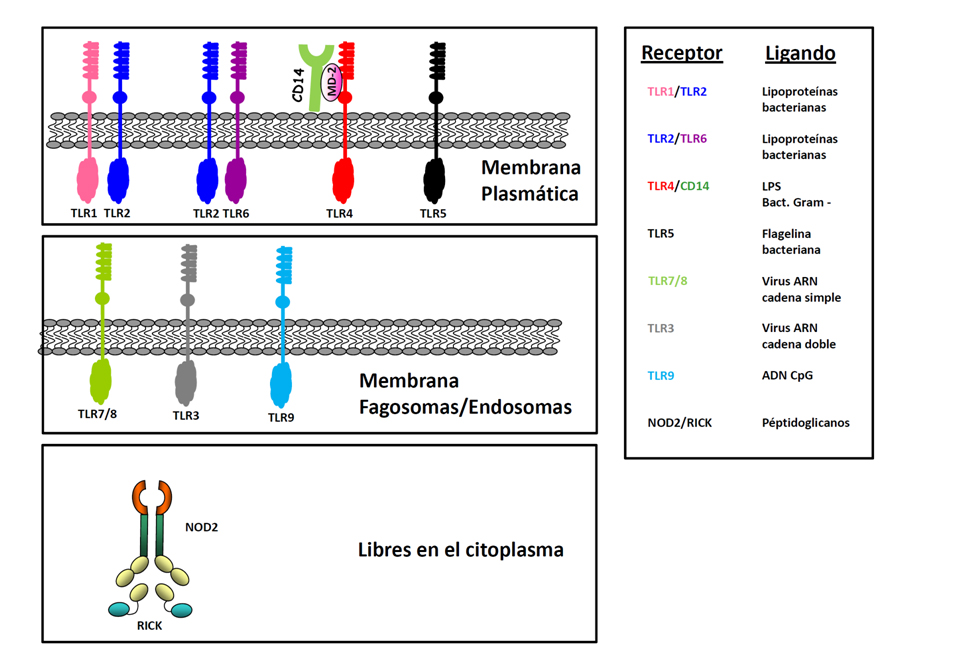
Figura 3.- Receptores TLRs de membrana plasmática e intracelulares.
Aún no se conocen los detalles precisos de cómo los TLRs pueden unir un abanico de ligandos estructuralmente tan diferentes como los ácidos nucleicos, y los lípidos. Los TLRs son proteínas integrales de membrana tipo I, que poseen secuencias repetidas ricas en leucina en sus regiones extracelulares y una corta secuencia de cisteínas. Los análisis estructurales de la interacción de algunos TLRs con sus ligandos a través de sus dominios de leucina (estructura en “herradura”) han revelado una gran versatilidad y flexibilidad para acomodar estructuras muy variadas, y transmitir en todos los casos la seĖal de unión al ligando a su región C-terminal intracelular. Pero quizás lo más característico de los TLRs sea su dominio intra-citoplásmico (dominio TIR), que tiene gran homología al del receptor de IL-1 (13).
4. TLRs y seÑales pro-inflamatorias
La disposición de un dominio TIR permite a los receptores TLRs transmitir seĖales intracelulares que conectan con la activación génica en el núcleo (Figura 4).
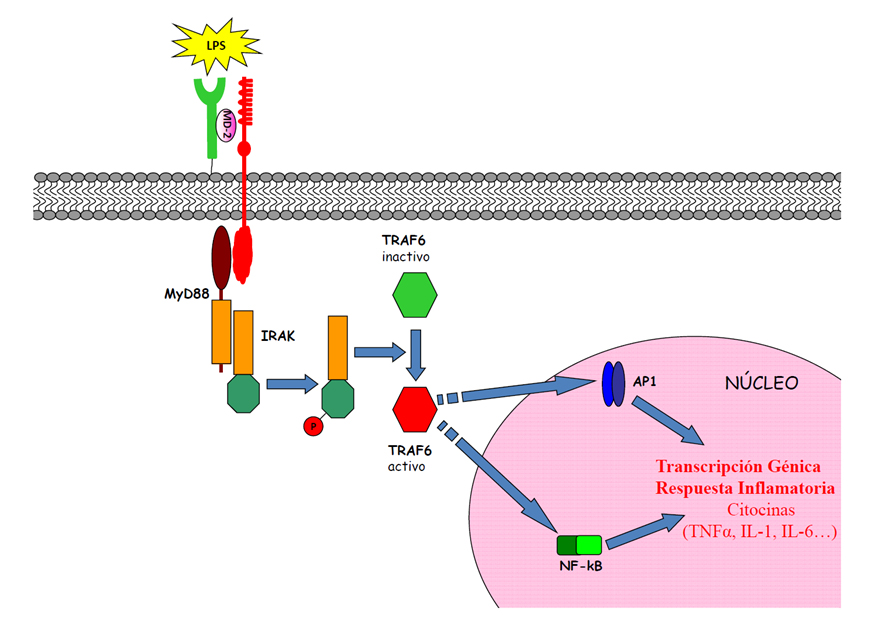
Figura 4.- Vía de SeĖalización intracelular a través de TLR4 e inducción de genes de la respuesta inflamatoria.
La cascada de seĖalización que desencadena la activación del dominio TIR se estableció en el marco del Receptor para IL-1 (14,15). Mediante este dominio, los TLRs conectan con las proteínas adaptadoras MyD88, MAL/TYRAP, TRIF o TRAM. Los diferentes TLRs, utilizan diversas combinaciones de estas proteínas que van a reclutar a su vez los complejos seĖalizadores interaccionando con IRAK (Kinasa asociada al Receptor de IL-1) y activando a TRAF6 (Factor Asociado al Receptor de TNF 6). Este factor estimula entonces a las proteínas NIK y TAK-1, que confluyen en la activación de las kinasas MAP e IkB. Finalmente, se translocan al núcleo los Factores de transcripción AP-1 y NF-kB, dando lugar a la activación de la transcripción de genes de citocinas pro-inflamatorias, como TNF alfa, IL-1, IL-6; quimiocinas y moléculas de adhesión (Figura 4).
Por tanto, los TLRs actúan como auténticos receptores para patrones estructurales microbianos y como elementos seĖalizadores desencadenantes del proceso inflamatorio.
5. Otras familias de receptores para componentes microbianos
Las líneas de investigación mencionadas anteriormente han dado pie a ampliar el concepto de la inmunidad innata como defensa frente a seĖales de peligro, tanto extracelulares como intracelulares, a otras familias de receptores estructuralmente diferentes de los TLRs, como las lectinas animales de tipo C, las proteínas de reconocimiento de peptidoglicanos y beta-glucanos, los receptores RIG-like o los NLR (receptores tipo Nod) (16). Junto a los TLRs, su proyección y relevancia se ha mostrado extraordinaria en enfermedades crónicas no infecciosas de gran prevalencia en la población, como son los trastornos autoinmunes y cardiovasculares. Así, se ha observado que los TLRs también pueden unir moléculas endógenas como LDLox, componentes de la matriz extracelular, o proteínas de choque térmico o estrés (17, 18). El conocimiento generado por estos estudios sobre los mecanismos de seĖalización de los TLRs, abren nuevas perspectivas en los tratamientos tanto para enfermedades inflamatorias crónicas como las cardiovasculares.
6. El descubrimiento de las CÉlulas Dendríticas
Tras identificar y definir por primera vez este nuevo tipo de células inmunes en el aĖo 1973 (19), el Prof. Ralph Steinman hubo de demostrar inequívocamente que se trataba de un linaje celular distinto al de los macrófagos mostrando, por tanto, características de diferenciación y función propias. La lucha del Prof. Steinman para que la relevancia de las células dendríticas, en la encrucijada de la respuesta innata con la respuesta adaptativa, fuera reconocida por la comunidad científica fue a la vez titánica y elegante. Abrió así un nuevo área de investigación, demostrando que las células dendríticas representan el eslabón perdido entre respuesta inmune innata y adaptativa, siendo esenciales para el inicio de la respuesta inmune adaptativa y por tanto para una completa y eficiente defensa del organismo.
Las células dendríticas capturan microbios, mediante su repertorio de receptores para patrones moleculares microbianos, como los TLRs, maduran como respuesta al patógeno detectado y se dirigen a los órganos linfoides, donde presentan los antígenos a los linfocitos, células del sistema inmune adaptativo. De esta manera, las células dendríticas informan de la presencia de patógenos, iniciándose así la activación y diferenciación celular que dará lugar a los diferentes tipos de linfocitos efectores.
7. Ontogenia de los MacrÓfagos y las CÉlulas dendrÍticas
Los monocitos, macrófagos y células dendríticas (DCs) son componentes esenciales en la regulación de la respuesta innata frente a infecciones por microorganismos. Los monocitos que circulan en la corriente sanguínea proceden de un precursor de la médula ósea común para monocito/macrófago/DC (MDP), con un fenotipo característico Lin- cKit+ CD115+ CX3CR1+ Flt3+. Este precursor puede originar tanto macrófagos como DCs plasmacitoides (pDCs) y DCs convencionales (cDCs) (Figura 5); estas células juegan un papel esencial en el desarrollo del proceso inflamatorio.
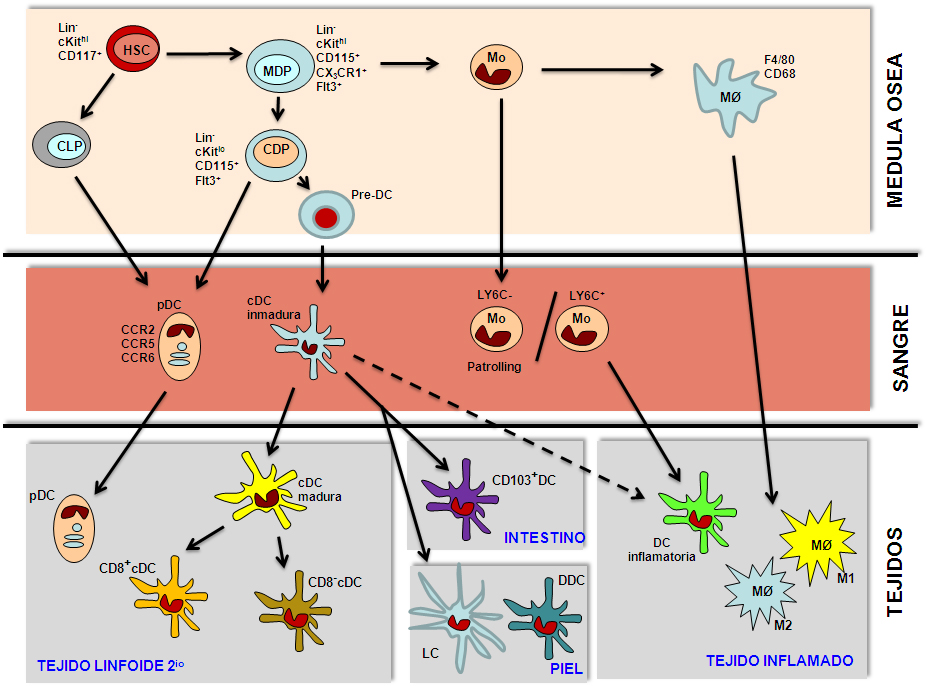
Figura 5.- Esquema de la Ontogenia de las células mieloides (macrófagos, monocitos y células dendríticas) a partir de un precursor común hematopoiético de médula ósea. Abreviaturas: HSC: célula madre hematopiética, MĮ: macrófago, Mo: monocito, MDP: precursor común de macrófago/monocito/célula, CDP: precursor común de célula dendrítica, CLP: precursor linfoide común, pDC: célula dendrítica plasmacitoide, cDC: célula dendrítica convencional, LC: célula de Langerhans, DDC: célula dendrítica dermal.
Los monocitos Ly6C- generan los macrófagos residentes de tejido que se encuentran en el bazo, hígado, pulmón, o intestino, y que realizan un papel de centinelas en dichos tejidos, mientras que los monocitos Ly6C+ se diferencian a macrófagos inflamatorios en respuesta a infecciones o estímulos inflamatorios. Estos últimos pueden ser de dos tipos: los macrófagos activados clásicos (M1) o pro-inflamatorios, con propiedades anti-microbianas, y los activados alternativos (M2) o anti-inflamatorios, que ejercen un papel muy importante en los procesos de cicatrización y generación de fibrosis (20) (Figura 5). Aunque el origen de los macrófagos asociados a los tumores (TAMs) no está claro aún, ambos tipos de macrófagos residentes o inflamatorios pueden diferenciarse a TAMs, adquiriendo propiedades inmunosupresoras (21).
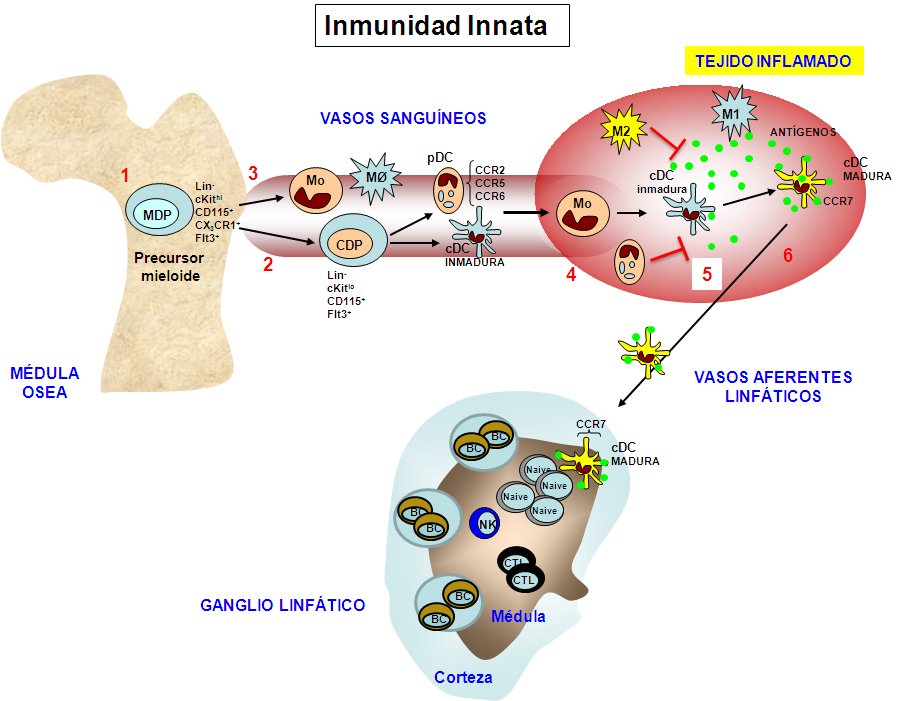
Figura 6.- Esquema de los eventos principales que tienen lugar durante la inmunidad innata. (1) Las células mieloides se originan en la médula ósea a partir de un precursor común, dando lugar a los distintos linajes de células dendríticas (2) y de monocitos /macrófagos (3). En respuesta a una inflamación/infección en un determinado tejido estas células mieloides son movilizadas hacia el sitio de inflamación (4) donde son capaces de interaccionar con el antígeno/patógeno, entre otros a través de los receptores TLR y ejercer una primera línea de defensa frente a estos eventos (5). Las células dendríticas son capaces de captar estos antígenos y migrar a los ganglios linfáticos (6) donde presentan estos antígenos a las células T, siendo así la célula clave en la iniciación de las respuestas inmunes adaptativas.
Se han descrito además otras subpoblaciones de monocitos como los Ly6C+ Gr-1+ que migran a las mucosas y participan en la inmunidad frente a protozoos, o la subpoblación Ly6C- CD115+ Gr1+ que patrulla los vasos sanguíneos (22-24). Los procesos de diferenciación mieloide poseen gran plasticidad; así, se ha observado en situaciones de infección e inflamación, la migración de los monocitos a los sitios de inflamación y su diferenciación a DCs (25). Sin embargo, en otras situaciones como en respuestas de daĖo isquémico miocárdico, los monocitos pueden ejercer un efecto anti-inflamatorio. Los monocitos Ly6C+ pueden ser movilizados desde la médula ósea hacia los tejidos inflamados por un mecanismo dependiente de CCR2, y una vez allí, pueden diferenciarse a DCs productoras de TNF(Tip DCs), macrófagos M1 o DCs inflamatorias.
La ontogenia, desarrollo y homeostasis de las DCs está controlado por el receptor FLT3, de la familia de receptores tirosina quinasa similar a fms, que es responsable de la diferenciación de DCs a partir de un precursor CX3CR1+ CD115+ común (CDP) para pDCs y cDCS (26-28) (Figura 5). La expresión diferencial de moléculas de adhesión y receptores de migración es esencial para el reclutamiento de los precursores mieloides de macrófagos y DCs a los diferentes tejidos, con el fín de ejercer allí sus funciones (29) (Figura 5 y 6).
8. Subtipos y funciones de CÉlulas dendrÍticas
El papel de las células dendríticas es crítico en el equilibrio inmunogenicidad-tolerancia. Las DCs pueden clasificarse en dos grandes categorías; convencionales (cDCs) y plasmacitoides (pDCs) (30). En primer lugar, las cDCs se han caracterizado por ser, esencialmente, células con gran capacidad presentadora de antígeno y de estimulación de la respuesta de los linfocitos T, con fenotipo CD11c+ CD11b+. La migración de cDCs inmaduras a los tejidos inflamados es dependiente de la expresión de los receptores de quimiocinas CCR2, CCR5 y CCR6 (Figura 6). Tras la captura de antígeno en tejidos inflamados o en los sitios de infección, las cDCs maduran, disminuyendo la expresión de estos receptores de quimiocinas y aumentando la de moléculas del complejo mayor de histocompatibilidad de clase II (MHC-II) y ligandos co-estimuladores CD80 y CD86. Así, aumentan su capacidad presentadora de antígeno. Además, tras su maduración, las cDCs comienzan a expresar el receptor de quimiocinas CCR7, que les permite migrar a los ganglios linfáticos para presentar allí el antígeno a los linfocitos T y así activarlos (29, 31) (Figura 7).
Por otra parte, las pDCs, identificadas en ratón como CD11cint B220+ (32), se encuentran en médula ósea, sangre, timo y ganglios, formando parte del mecanismo de defensa inicial frente a las infecciones virales ya que son capaces de producir grandes cantidades de Interferon-alfa tras reconocimiento de ácidos nucleicos virales por sus TLR7 y 9. Además, las pDCs pueden también activar a linfocitos T induciendo respuestas T antígeno específicas, así como a otros componentes del sistema inmune como las células NKs. Existen, sin embargo, evidencias de que las pDCs pueden desempeĖar una función importante no sólo en la inmunidad viral, sino también durante la inducción de tolerancia en las enfermedades autoinmunes. Debido a su menor expresión de MHC-II y de moléculas co-estimuladoras que las cDCs, se ha postulado un papel muy relevante para las pDCs en el mantenimiento de la tolerancia frente a antígenos propios. En este sentido, las pDCs inmaduras promueven la diferenciación de los linfocitos T reguladores, integrantes de la respuesta tolerogénica, tanto in vitro como in vivo en modelos de tolerancia de asma alérgica o de trasplantes cardiacos (32, 33).
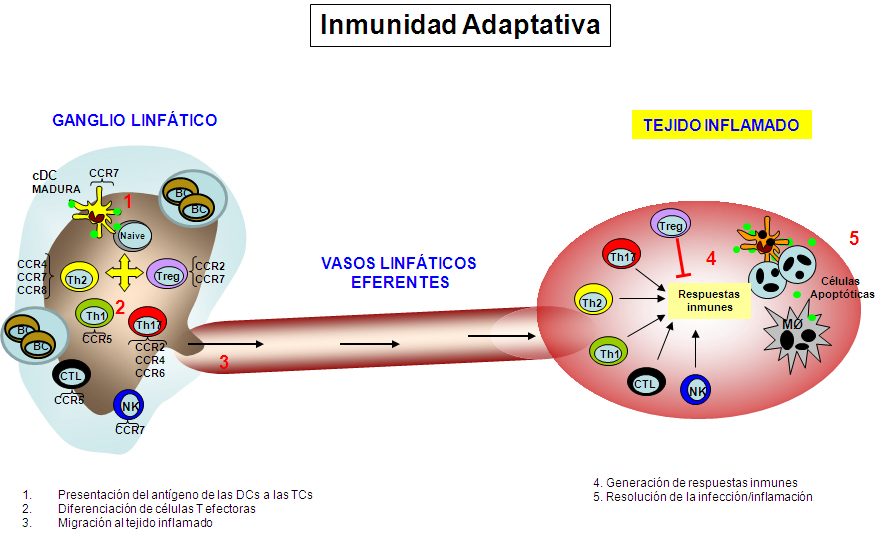
Figura 7.- Esquema de los eventos principales de la inmunidad adaptativa y generación de los diferentes tipos de células T. En los ganglios linfáticos las células dendríticas presentan los antígenos a las células T vírgenes (1), estas a su vez se activan y se diferencian a los diferentes tipos de células T efectoras Th1, Th2, Th17 o células T reguladoras (2). Las células T efectoras y de memoria que se generan en estos procesos migran a través de los vasos linfáticos aferentes a los tejidos inflamados (3) para ejercer su función en la regulación de las respuestas inmunes (4) o en la protección frente a patógenos (5), constituyendo así la segunda línea de las respuestas inmunes.
9. Interacciones DC-linfocitos T. La Sinapsis inmune
El intercambio de información entre células, homólogas o heterólogas, es uno de los ejemplos más importantes de la sofisticación de los sistemas nervioso e inmune en vertebrados. La formación de la sinapsis inmunológica, a diferencia de la sinapsis neuronal, es un proceso transitorio. La formación de la sinapsis inmunológica incluye varias etapas secuenciales. En primer lugar, se produce la exploración por parte del linfocito T de la membrana de la célula presentadora de antígeno (APC) que implica a determinadas moléculas de adhesión como la integrina LFA-1 y sus ligandos ICAM-1, e ICAM-3; esta etapa es independiente de antígeno. En segundo lugar, cuando el receptor de los linfocitos T (TCR) reconoce al antígeno presentado por las moléculas MHC de la APC, se inducen seĖales activadoras y se produce la segregación de los SMACs (Complejos Supra-moleculares de Activación). Por último, se lleva a cabo la secreción polarizada guiada por la translocación del centro organizador de microtúbulos (MTOC) (34-37) (Figura 8).
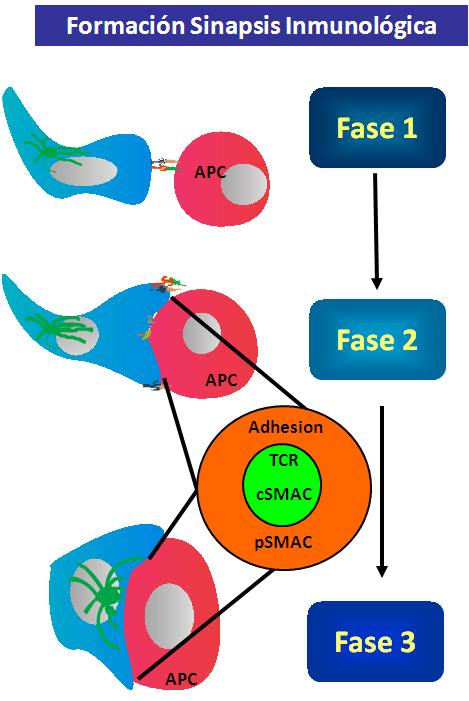
Figura 8.- Etapas en la formación y maduración de la sinapsis inmunológica: congregación, segregación de receptores y secreción polarizada.
Las moléculas implicadas en la formación de la sinapsis inmunológica se reorganizan espacial y temporalmente en la célula T formando una plataforma especializada en la zona de la célula T que está en contacto estrecho con la APC y que permite el diálogo celular. Este reconocimiento específico conlleva que se establezcan de múltiples interacciones concertadas entre parejas de receptores de superficie en ambas células. Una observación detallada al microscopio de la sinapsis inmune revela la distribución de las moléculas implicadas en el lado del linfocito T en dos anillos concéntricos: un anillo central (cSMAC), donde se agrupan el receptor de las células T (TCR) unido al complejo antígeno-MHC de la célula presentadora; y un anillo periférico de adhesión denominado pSMAC (complejo supra-molecular de activación periférico) donde se concentran los receptores de adhesión celular, entre ellos LFA-1 y su ligando ICAM-1. Esta distribución diferencial es necesaria para la completa activación de la célula T ya que permite la regulación y amplificación espacio-temporal de las rutas de seĖalización intracelular provenientes del TCR. Este proceso de distribución de receptores es posible gracias a su integración en pequeĖas islas en la membrana plasmática que favorecen la formación de agregados así como su interacción con el citoesqueleto celular, que proporciona la plataforma física que sustenta toda la estructura de la sinapsis (38-40). Por otra parte, en la APC, en la zona de contacto con el linfocito T, las moléculas de MHC que presentan el antígeno y las moléculas de adhesión ICAM-1 y -3 también se disponen congregadas y organizadas, facilitando así su interacción con los receptores en la parte simétrica de la célula T (41). Se ha descrito además, que existen estrictas jerarquías temporales en el reclutamiento de moléculas de seĖalización a la sinapsis, de forma que se produce una ordenación temporal de las seĖales. Tanto las cDCs como las pDCs poseen la capacidad de formar sinapsis productivas y completas con los linfocitos T de forma antígeno-específica (42).
Una vez efectuado el reconocimiento entre la célula T y la APC y establecidos los contactos adherentes y antígeno-dependientes, la célula T se activa y pasa a diferenciarse hacia uno de los subtipos de células T, ya sean efectoras o colaboradoras (T-helper, Th), que son fundamentales para el desarrollo de la respuesta inmune adquirida (43, 44). Dependiendo del microambiente de citocinas y el tipo de célula APC que los activa, los linfocitos T CD4 pueden dar lugar a: i) Células Th1: que producen grandes cantidades de IFN gamma con el que activan propiedades microbicidas en los macrófagos para así resistir infecciones intracelulares de patógenos facultativos u obligados (ej: bacterias intracelulares). ii) Células Th2: Productoras de citocinas IL-4, -5 y -13 que permiten reclutar otros leucocitos para resistir infecciones por helmintos así como cooperar con los linfocitos B para producir diferentes isotipos de inmunoglobulinas. iii) Células Th17: Productoras de IL-17, que movilizan a fagocitos, neutrófilos, para resistir infecciones por bacilos extracelulares. iv)
Células T reguladoras (Treg): algunas células T CD4+ son inducidas a producir IL-10, diferenciándose a células Foxp3+ con capacidad de suprimir la función de las demás Th1, Th2 y Th17 (Figura 9).
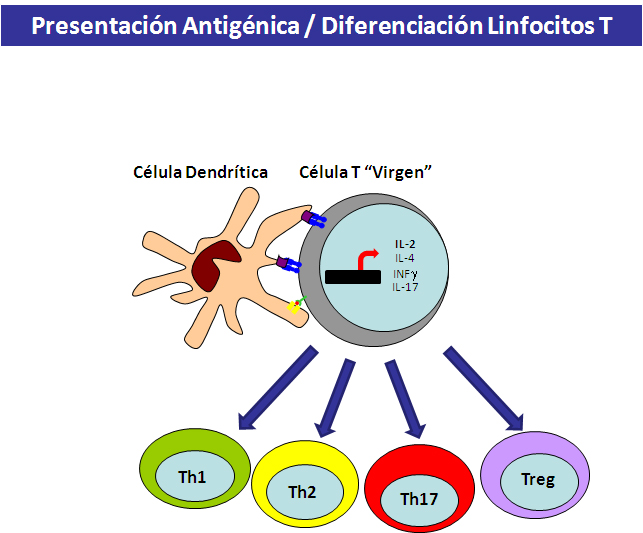
Figura 9.- Interacción linfocito T- Célula dendrítica y diferenciación de linfocitos T CD4 efectores.
La interfaz de contacto entre una célula T y una APC se forma para facilitar la comunicación entre ambas células. Sin embargo, se desconoce por qué las moléculas se reordenan formando los SMACs característicos de la sinapsis inmunológica madura. Una posibilidad es que la formación y maduración de los SMACs faciliten la activación secuencial del linfocito T mediante el agrupamiento selectivo de moléculas de superficie, así como el cese y la terminación adecuada de la seĖal de activación. Además, este reagrupamiento de moléculas de la célula T en SMACs supone la formación de un área especializada para que vesículas cargadas de mediadores se anclen y sean secretadas a la zona de contacto con la célula presentadora de antígeno. Existen numerosas evidencias que apuntan a que la secreción polarizada es una de las funciones principales de la sinapsis inmune (45, 46).
Los mensajes que se transmiten las células inmunes mediante la sinapsis inmunológica pueden ser mensajes de vida o mensajes de muerte. Así, las seĖales que recibe, desde un linfocito T colaborador, una APC, tipo célula dendrítica o linfocito B, favorecen su supervivencia y permiten que una célula específica, que está transmitiendo mensajes sobre antígenos presentes en el organismo permanezca más tiempo activa, de modo que cumpla su función comunicadora con mayor eficiencia. Estas seĖales implican tanto la proliferación y activación como la secreción y transferencia de citocinas y factores de crecimiento y supervivencia (45-48). Por el contrario, las seĖales que emite un linfocito T citotóxico a una célula infectada por un virus o bacteria o a una célula tumoral, son inductoras de muerte, que ponen en marcha programas de muerte celular, como la apoptosis (46).
10. Terapias basadas en la inmunomodulaciÓn por cÉlulas dendrÍticas de la respuesta inmune
El potencial de las DCs es indudable en protocolos de vacunación, así como en nuevas terapias de inmunopotenciación frente a tumores. El uso de células dendríticas, estimuladas y expandidas in vitro, o bien combinadas con otras terapias más convencionales, es un área emergente y en expansión en medicina.
Actualmente, se está intentado desarrollar nuevas terapias para producir vacunas contra el cáncer que permitan mejorar los tratamientos actuales. Por ejemplo, existen ensayos con distintos adyuvantes que son inyectados en la zona lesionada por el tumor para aumentar su inmunogenicidad. Además se están poniendo a punto sistemas que incluyen la administración sistémica o local de células dendríticas que reaccionan frente al tumor, o agentes que causan la depleción o eliminación de células T reguladoras. También se ha estudiado el efecto de fármacos que eliminan células mieloides supresoras en el área del tumor. Estos tipos de inmunoterapias intentan coordinar la comunicación entre células del sistema inmune, de modo que sean capaces de reconocer y hacer desaparecer el tumor, igual que ocurre frente a determinados virus o bacterias para los que existen vacunas efectivas (49).
Conseguir vacunas efectivas frente a determinados procesos como el cáncer, implica poder modular el sistema inmune adaptativo de modo que sea más inmunogénico y menos tolerogénico (Figura 10). Igualmente, se está estudiando el posible uso de poblaciones de células dendríticas con potencial tolerogénico, es decir, capaces de mantener inactivo al sistema inmune, para combatir procesos donde el sistema inmune se activa de forma no deseada, dando lugar a una patología como es el caso de las enfermedades autoinmunes, alergias y trasplantes de órganos (Figura 10) (50, 51).
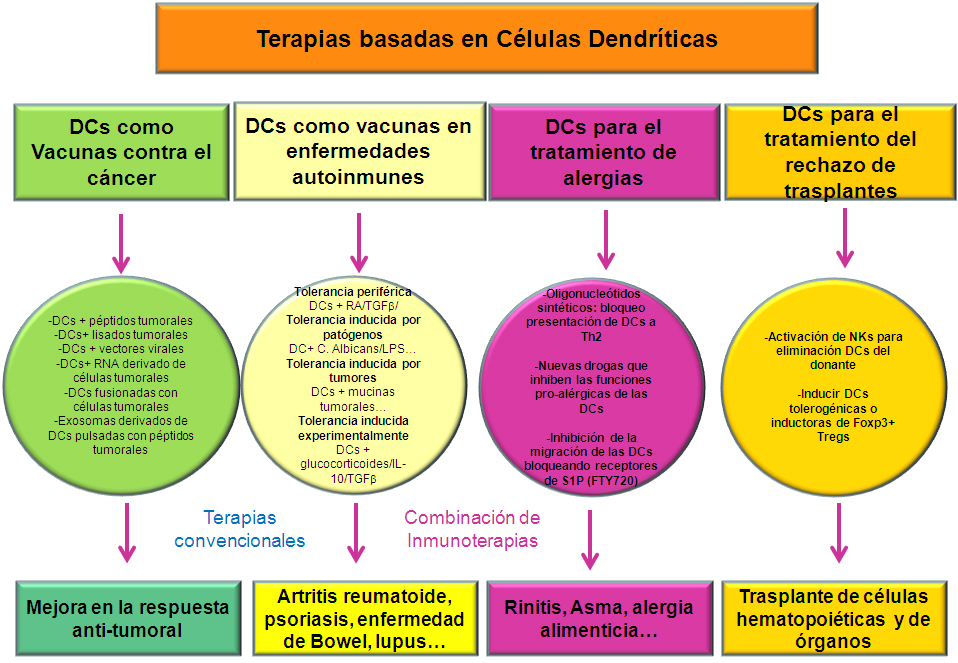
Figura 10.- Terapias basadas en la inmunomodulación por células dendríticas.
11. REFERENCIAS
1. Janeway, C. (1989). Evolution and revolution in immunology. Cold Spring Harbor Symp Quant Biol., 54, 1-13.
2. Matzinger, P. (1994). Tolerance, danger and the extended family. Annu Rev Immunol., 12, 991-1045.
3. Anderson, K.V., Bokla, L., & Nüsslein-Volhard, C. (1985). Establishment of dorsal-ventral polarity in the Drosophila embryo: the induction of polarity by the Toll gene product. Cell, 42, 791-798.
4. Steiner, H., Hultmark, D., Engström, A., Bennich, H., & Boman, H.G. (1981). Sequence and specificity of two antibacterial proteins involved in insect immunity. Nature, 292, 246-248.
5. Lemaitre, B., Nicolas, E., Michaut, L., Reichhart, & J.M., Hoffmann, J.A. (1996). The dorsoventral regulatory gene cassette spätzle/Toll/cactus controls the potent antifungal response in Drosophila adults. Cell, 86, 973-983.
6. Hoffmann, J.A., & Reichhart, J.M. (2002) Drosophila innate immunity: an evolutionary perspective. Nat Immunol., 3, 121-126.
7. Medzhitov, R., Preston-Hurlburt, P., & Janeway, C.A. Jr. (1997). A human homologue of the Drosophila Toll protein signals activation of adaptive immunity. Nature, 388, 394-397.
8. Hoffmann, J,A, Kafatos, F.C., Janeway, & C.A., Ezekowitz, R.A. (1999). Phylogenetic perspectives in innate immunity. Science, 284, 1313-1318.
9. Gay, N.J., Keith, F.J. (1991). Drosophila Toll and IL-1 receptor. Nature, 351, 355-356.
10. Poltorak, A., He, X., Smirnova, I., Liu, M.Y., Van Huffel, C., Du, X., Birdwell, D., Alejos, E., Silva, M., Galanos, C., Freudenberg, M., Ricciardi-Castagnoli, P., Layton, & B., Beutler, B. (1998). Defective LPS signaling in C3H/HeJ and C57BL/10ScCr mice: mutations in Tlr4 gene. Science, 282, 2085-2088.
11. Beutler, B.A. (2009). TLRs and innate immunity. Blood, 13, 1399-1407.
12. da Silva Correia, J., Soldau, K., Christen, U., Tobias, P.S., & Ulevitch, R.J. (2001). Lipopolysaccharide is in close proximity to each of the proteins in its membrane receptor complex. transfer from CD14 to TLR4 and MD-2. J Biol Chem., 276, 21129-21135.
13 Heguy, A., Baldari, C.T., Macchia, G., Telford, J.L., & Melli, M. (1992). Amino acids conserved in interleukin-1 receptors (IL-1Rs) and the Drosophila toll protein are essential for IL-1R signal transduction. J Biol Chem., 267, 2605-2609.
14. Muzio, M., Ni, J., Feng, P., Dixit, V.M., IRAK (Pelle) family member IRAK-2 and MyD88 as proximal mediators of IL-1 signaling. Science. 1997, 278, 1612-1615.
15. Muzio, M., Natoli, G., Saccani, S., Levrero, & M., Mantovani, A. (1998). The human toll signaling pathway: divergence of nuclear factor kappaB and JNK/SAPK activation upstream of tumor necrosis factor receptor-associated factor 6 (TRAF6). J Exp Med., 187, 2097-2101.
16. Takeuchi, O., & Akira, S. (2010) Pattern recognition receptors and inflammation. Cell, 140, 805-820.
17. Seimon, T.A., Nadolski, M.J., Liao, X., Magallon, J., Nguyen, M., Feric, N.T., Koschinsky, M.L., Harkewicz, R., Witztum, J.L., Tsimikas, S., Golenbock, D., Moore, K.J., & Tabas, I. (2010). Atherogenic lipids and lipoproteins trigger CD36-TLR2-dependent a.poptosis in macrophages undergoing endoplasmic reticulum stress. Cell Metab., 12, 467-482.
18. Cole, J.E., Navin, T.J., Cross, A.J., Goddard, M.E., Alexopoulou, L., Mitra, A.T., Davies, A.H., Flavell, R.A., Feldmann, M., & Monaco, C. (2011). Unexpected protective role for Toll-like receptor 3 in the arterial wall. Proc Natl Acad Sci U S A, 108, 2372-2377.
19. Steinman, R.M., & Cohn, Z.A. (1973). Identification of a novel cell type in peripheral lymphoid organs of mice. I. Morphology, quantitation, tissue distribution. J. Exp. Med., 137, 1142-1162.
20. Geissmann, F., Gordon, S., Hume, D.A., Mowat, A.M., & Randolph, G.J. (2010). Unravelling mononuclear phagocyte heterogeneity. Nat Rev Immunol., 10, 453-460.
21. Auffray, C., Sieweke, M.H., Geissmann, F., Blood monocytes: development, heterogeneity, and relationship with dendritic cells. Annu Rev Immunol. 2009, 27, 669–692.
22. Swirski, F.K., Nahrendorf, M., Etzrodt, M., Wildgruber, M., Cortez-Retamozo, V., Panizzi, P., & al. (2009). Identification of splenic reservoir monocytes and their deployment to inflammatory sites. Science, 325, 612–616.
23. Dunay, I.R., Damatta, R.A., Fux, B., Presti, R., Greco, S., Colonna, M., & al. (2008). Gr1(þ) inflammatory monocytes are required for mucosal resistance to the pathogen Toxoplasma gondii. Immunity, 29, 306–317.
24. Auffray, C., Fogg, D., Garfa, M., Elain, G., Join-Lambert, O., Kayal, S., & al. (2007). Monitoring of blood vessels and tissues by a population of monocytes with patrolling behavior. Science, 317, 666–670.
25. Shi, C., & Pamer, E.G., Monocyte recruitment during infection and inflammation. (2011). Nat. Rev. Immunol., 11, 762-774.
26. Liu, K., Victora, G.D., Schwickert, T.A., Guermonprez, P., Meredith, M.M., Yao, K. & al. (2009). In vivo analysis of dendritic cell development and homeostasis. Science, 324, 392–397.
27. Auffray, C. , Fogg, D.K. , Narni-Mancinelli, E. , Senechal, B. , Trouillet, C., Saederup, N. & al. (2009). CX3CR1þ CD115þ CD135þ common macrophage/DC precursors and the role of CX3CR1 in their response to inflammation. J Exp Med., 206, 595–606.
28. Darrasse-Jeze, G., Deroubaix, S., Mouquet, H., Victora, G.D., Eisenreich, T., Yao, K.H. & al. (2009). Feedback control of regulatory T cell homeostasis by dendritic cells in vivo. J Exp Med., 206:1853–1862.
29. Alvarez, D., Vollmann, E.H., & von Andrian, U.H. (2008). Mechanisms and consequences of dendritic cell migration. Immunity. 29, 325–342.
30. Steinman, R.M., & Banchereau, J. (2007). Taking dendritic cells into medicine. Nature, 449, 419-426.
31. Barreiro, O., Martín, P., González-Amaro, & R., Sánchez-Madrid, F. (2010). Molecular cues guiding inflammatory responses. Cardiovasc Res., 86, 174-182.
32. Martín, P., Del Hoyo, G.M., AnjuŹre, F., Arias, C.F., Vargas, H.H., Fernández-L, A., Parrillas, V., & Ardavín, C. (2002). Characterization of a new subpopulation of mouse CD8alpha+ B220+ dendritic cells endowed with type 1 interferon production capacity and tolerogenic potential. Blood, 100, 383-390.
32. Lambrecht, B.N., & Hammad, H. (2009). Biology of lung dendritic cells at the origin of asthma. Immunity, 31, 412–424.
33. Ochando, J.C., Homma, C., Yang, Y., Hidalgo, A., Garin, A., Tacke, F., & al. (2006). Alloantigenpresenting plasmacytoid dendritic cells mediate tolerance to vascularized grafts. Nat Immunol., 7, 652–662.
34. Monks, C.R., Freiberg, B.A., Kupfer, H., Sciaky, N., & Kupfer, A. (1998). Three-dimensional segregation of supramolecular activation clusters in T cells. Nature., 39582-39586.
35. Fooksman ,D.R., Vardhana, S., Vasiliver-Shamis, G., Liese, J., Blair, D.A., Waite, J., Sacristán, C., Victora, G.D., Zanin-Zhorov, A., & Dustin, M.L., (2010). Functional anatomy of T cell activation and synapse formation. Annu Rev Immunol., 28, 79-105.
36. Montoya, M.C., Sancho, D., Vicente-Manzanares, M., & Sánchez-Madrid, F. (2002). Cell adhesion and polarity during immune interactions. Immunol. Rev., 186, 68-82.
37. Martín-Cófreces, N.B., Robles-Valero, J., Cabrero, J.R., Mittelbrunn, M., Gordón-Alonso, M., Sung, C.H., Alarcón, B., Vázquez, J., & Sánchez-Madrid, F. (2008). MTOC translocation modulates IS formation and controls sustained T cell signaling. J Cell Biol., 182, 951-962.
38. Sánchez-Madrid, F., & del Pozo, M.A. (1999). Leukocyte polarization in cell migration and immune interactions. EMBO J. , 18, 501-511.
39. Billadeau, D.D., Nolz, J.C., & Gomez, T.S. (2007). Regulation of T-cell activation by the cytoskeleton. Nat Rev Immunol., 7, 131-143.
40. Vicente-Manzanares, M., & Sánchez-Madrid, F. (2004). Role of the cytoskeleton during leukocyte responses. Nature Rev. Immunol., 4, 110-122.
41. de la Fuente, H., Mittelbrunn, M., Sánchez-Martín, L., Vicente-Manzanares, M., Lamana, A., Pardi, R., CabaĖas, C., & Sánchez-Madrid, F. (2005). Synaptic clusters of MHC class II molecules induced on DCs by adhesion molecule-mediated initial T-cell scanning. Mol Biol Cell., 16, 3314-3322.
42. Mittelbrunn, M., Martínez del Hoyo, G., López-Bravo, M., Martín-Cofreces, N.B., Scholer, A., Hugues, S., Fetler, L., Amigorena, S., Ardavín, C., & Sánchez-Madrid, F. (2009). Imaging of plasmacytoid dendritic cell interactions with T cells. Blood, 113, 75-84.
43. Zhu, J., & Paul, W.E. (2008). CD4 T cells: fates, functions, and faults. Blood, 112, 1557-1569.
44. O'Shea, J.J., & Paul, W.E. (2010). Mechanisms underlying lineage commitment and plasticity of helper CD4+ T cells. Science, 327, 1098-1102.
45. Huse, M., Quann, & E.J., Davis, M.M. (2008). Shouts, whispers and the kiss of death: directional secretion in T cells. Nat Immunol., 9, 1105-11.
46. Stinchcombe, J.C., & Griffiths, G.M. (2007). Secretory mechanisms in cell-mediated cytotoxicity. Annu Rev Cell Dev Biol., 23, 495-517.
47. Mittelbrunn, M., Gutierrez-Vazquez, C., Villarroya-Beltri, C., Gonzalez, S., Sanchez-Cabo, F., Gonzalez, M.A., Bernad, A., & Sanchez-Madrid, F. (2011). Unidirectional transfer of microRNA-loaded exosomes from T cells to antigen-presenting cells. Nat Commun., 2, 282.
48. Riol-Blanco, L., Delgado-Martin, C., Sanchez-Sanchez, N., Alonso, C.L., Gutierrez-Lopez, M.D., Del Hoyo, G.M., Navarro, J., Sanchez-Madrid, F., Cabanas, C., Sanchez-Mateos, P., & Rodriguez-Fernandez, J.L. (2009). Immunological synapse formation inhibits, via NF-kappaB and FOXO1, the apoptosis of dendritic cells. Nat Immunol., 10, 753-760.
49. Perez-Gracia, J.L., Berraondo, P., Martínez-Forero, J., Alfaro, C., Suarez, N., Gurpide, A., Sangro, B., Hervas-Stubbs, S., Ochoa, C., Melero, J.A., & Melero, I. (2009). Clinical development of combination strategies in immunotherapy: are we ready for more than one investigational product in an early clinical trial? Immunotherapy, 1, 845-853.
50. Maldonado, R.A., & von Andrian, U.H. (2010) How tolerogenic dendritic cells induce regulatory T cells. Adv Immunol., 108, 111-65.
51. Manicassamy, S., & Pulendran, B. (2011). Dendritic cell control of tolerogenic responses. Immunol Rev., 241, 206-227.