ARTêCULO |
S’ntesis de Inhibidores Selectivos de MMP-2 utilizando Qu’mica Click
JosŽ Mar’a Zapico1, Pilar Serra1, Josune Garc’a Sanmart’n2, Kamila Filipiak1, 3, Alfredo Mart’nez2, Sonsoles Mart’n Santamar’a1, Beatriz de Pascual-Teresa1, Ana Ramos1*
1Departamento de Qu’mica, Facultad de Farmacia, Universidad San Pablo CEU, Urbanizaci—n Montepr’ncipe, 28668 Boadilla del Monte, Madrid, Spain. 2Centro de Investigaci—n BiomŽdica de La Rioja (CIBIR) C/ Piqueras 98, 26006 Logro–o, Spain.3Department of Molecular Biology, Faculty of Mathematics and Natural Sciences, The John Paul II Catholic University of Lublin, 20-718 Lublin, Poland.
Recibido el 4 de abril de 2011.
e-mail: bpaster@ceu.es
RESUMEN
Siguiendo una estrategia de dise–o basado en fragmentos, se describe la s’ntesis de una nueva serie de inhibidores de MMP-2. Para ello, se parte de un fragmento que contiene simult‡neamente un grupo hidroxamato como Zinc Binding Group (ZBG) y un grupo azida. Esta subunidad se conecta mediante qu’mica Òclick" con otros fragmentos lip—filos que contienen un alquino terminal y que han sido seleccionados para interaccionar de manera selectiva con el subsitio S1Õ de la MMP-2. Los compuestos sintetizados m‡s activos, 20 y 21, presentan una alta potencia inhibitoria en MMP-2. Adem‡s, el compuesto 20 presenta un prometedor perfil de selectividad frente a algunas metaloproteasas consideradas anti-diana en c‡ncer, como MMP-8 y MMP-9. |
Palabras clave: Inhibidores MMP-2; Hidroxamatos; Qu’mica ÒclickÓ; Modelado molecular; Evaluaci—n biol—gica.
abstract
Synthesis of Selective MMP-2 Inhibitors Using Click Chemistry
A new series of selective MMP-2 inhibitors is described, following a fragment-based drug design approach. A fragment containing an azide group and a well known hydroxamate ZBG, was synthesized. A click chemistry reaction was used to connect the azide to lipophilic alkynes selected to interact selectively with the S1Õ subunit of MMP-2. The most active compounds, 20 and 21, displayed high values of IC50 against MMP-2. In addition, compound 20 has shown also a promissing selectivity profile against some antitarget metalloproteinases in cancer, such as MMP-8, and MMP-9. |
Key words: MMP-2 inhibitors; Hydroxamates; Click chemistry; Docking; Biological evaluation.
1. introducCIîn
Las Metaloproteasas de la Matriz (MMPs), tambiŽn conocidas como matrixinas, son una familia de enzimas estructuralmente relacionadas que poseen zinc en su centro catal’tico. Las MMPs son responsables del remodelado y la degradaci—n de la matriz extracelular, por lo que est‡n implicadas en una gran variedad de procesos biol—gicos, tales como el desarrollo embrionario, enfermedades neurol—gicas (1, 2), artritis (3), enfermedades cardiovasculares (4, 5), y varios procesos relacionados con el c‡ncer, como la angiogŽnesis, apoptosis, proliferaci—n celular y met‡stasis (6-8).
En la actualidad, se conocen en vertebrados al menos 26 MMPs (9), 23 de las cuales han sido detectadas en humanos (10). Est‡n clasificadas en seis grupos: colagenasas: MMP1, MMP8, MMP13 y MMP18; gelatinasas: MMP2 y MMP9; estromelisinas: MMP3, MMP10 y MMP11; matrilisinas: MMP7 y MMP26; MMPs de la membrana: MMP14 a MMP17, MMP24 y MMP25 y otras MMPs (10).
Originalmente, se pens— que las MMPs estaban implicadas fundamentalmente en la invasi—n y met‡stasis, debido al remodelado que provocan en la matriz extracelular, permitiendo de ese modo a las cŽlulas tumorales acceder a los vasos sangu’neos y linf‡ticos. Este mecanismo se propuso debido al incremento de la capacidad de invasi—n que poseen las l’neas celulares que sobreexpresan MMPs. M‡s recientemente, se ha visto que las MMPs pueden estar implicadas tambiŽn en el crecimiento de tumores primarios. La remodelaci—n de la matriz extracelular en las proximidades de un tumor primario puede proporcionarle los requerimientos especiales necesarios para su crecimiento (11).
Se ha descrito un gran nœmero de compuestos que actœan como inhibidores de MMPs y que han permitido deducir cu‡les son las caracter’sticas estructurales necesarias para presentar actividad y que se pueden resumir en:
-Un grupo funcional conocido como Zinc-Binding Group, ZBG (‡cido hidrox‡mico, ‡cido carbox’lico, sulfhidrilo, etc.), capaz de unirse al Zn2+ catal’tico.
-Al menos un grupo funcional capaz de formar un enlace de hidr—geno con el esqueleto de la prote’na.
-Una o m‡s cadenas laterales que puedan establecer interacciones de van der Waals con los subsitios de la enzima.
Los hidroxamatos han sido los ZBGs m‡s utilizados en el desarrollo de inhibidores de MMPs, ya que se coordinan al zinc formando un quelato a travŽs de dos enlaces. La capacidad de uni—n de estos inhibidores no se debe œnicamente a esta coordinaci—n con el Zn2+ catal’tico, sino que la afinidad y, sobre todo, la selectividad entre las diferentes MMPs, se debe fundamentalmente a la interacci—n de otros grupos de la molŽcula con diferentes subsitios de la enzima. Especialmente interesante, es la regi—n conocida como sitio S1Õ, por ser una de las que m‡s diferencias presenta entre las diferentes MMPs (12, 13). Modificaciones realizadas sobre la parte del inhibidor que interacciona con este subsitio (P1Õ) han llevado a un aumento (14, 15) o disminuci—n de la selectividad (16, 17).
Por el momento, solamente se han validado experimentalmente como dianas contra el c‡ncer las MMPs 1, 2 y 7 (9, 18). De ellas, la MMP-2 se est‡ erigiendo en los œltimos a–os en la m‡s interesante para el dise–o de agentes antitumorales. La MMP-1 parece ser la causante del s’ndrome musculo esquelŽtico observado cl’nicamente con inhibidores poco selectivos de MMPs (19). Por otro lado, la inhibici—n de otras MMPs como la 3 y 8 puede incrementar la tumorigŽnesis y met‡stasis (20, 21). La MMP-9 es una enzima muy particular, ya que su inhibici—n puede ser œtil en el tratamiento de pacientes con c‡ncer en una etapa inicial, sin embargo debe evitarse en pacientes en etapas avanzadas de la enfermedad (9).
El papel de la MMP-2 en c‡ncer est‡ relacionado con la estimulaci—n del crecimiento tumoral, angiogŽnesis y met‡stasis, a travŽs de su implicaci—n en la degradaci—n de la matriz extracelular (22). Adem‡s, se ha visto que en muestras de tumor humano est‡ sobreexpresada y se ha identificado en asociaci—n con cŽlulas altamente invasivas. Por estas razones se ha considerado como una importante diana contra el c‡ncer, y el dise–o de inhibidores selectivos de esta enzima puede conducir a interesantes agentes anticancerosos (23).
El objetivo de nuestro trabajo, es la bœsqueda de inhibidores selectivos de MMP-2 y especialmente frente a MMP-9, otra gelatinasa con una gran homolog’a de secuencia en el sitio activo y cuya inhibici—n, como ya hemos mencionado, nos interesa evitar.
Entre los inhibidores de MMP-2 descritos en la bibliograf’a, cabe destacar los hidroxamatos de estructura general 1 (Figura 1), que poseen un ciclo de tetrahidropirano y una sulfona en posici—n a respecto al grupo hidroxamato (24-27). Algunos de ellos, presentan una elevada actividad en MMP-2, MMP-9 y MMP-13, mientras que son inactivos frente a MMP-1.
Por esta raz—n, hemos empleado el esqueleto de a-sulfona-a-tetrahidopiranil hidroxamato en el dise–o de nuevos inhibidores que, manteniendo la potente actividad frente a MMP-2 y selectividad frente a MMP-1, sean tambiŽn selectivos frente a otras metaloproteasas, especialmente MMP-9.
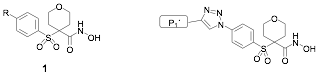
Figura 1.- Inhibidores de MMP-2 descritos con estructura general 1 (izquierda) y estructura general de los inhibidores descritos en este trabajo.
Para ello, hemos utilizado una estrategia basada en el uso de qu’mica ÒclickÓ para conectar el fragmento que contiene el ZBG con otros fragmentos de car‡cter lip—filo, seleccionados para interaccionar con el subsitio S1«de la enzima, de acuerdo a los datos recogidos en la bibliograf’a sobre inhibidores de MMP-2 (28).
La qu’mica ÒclickÓ y, concretamente, la reacci—n de cicloadici—n 1,3-dipolar entre una azida y un alquino catalizada por cobre (I) (Copper Azide Alkyne Cycloaddition, CuAAC) se ha utilizado en el descubrimiento de inhibidores de diferentes enzimas, como por ejemplo acetilcolinesterasa (29-31), proteasa del HIV-1 (32, 33), tirosina quinasa de Abelson (34), trans-sialidasa de tripanosoma cruzi(35), y caspasas (36). Se ha empleado tambiŽn esta estrategia en la bœsqueda de inhibidores selectivos de MMP-7 frente a termolisina y colagenasa (37).
2. MATERIAL Y MƒTODOS
2.1. S’ntesis general
Las reacciones sensibles al aire se realizaron bajo atm—sfera de arg—n. Los disolventes utilizados se purificaron por destilaci—n antes de su uso: el tetrahidrofurano sobre sodio-benzofenona bajo atm—sfera de arg—n y el acetonitrilo sobre hidruro c‡lcico.
La separaci—n de los crudos de reacci—n y la purificaci—n de los compuestos obtenidos se llev— a cabo por cromatograf’a en columna utilizando gel de s’lice Merck 230-240 mesh y el eluyente indicado en cada caso. El an‡lisis de los productos de reacci—n se realiz— por cromatograf’a en capa fina (kiesegel 60F-254). Para la detecci—n de los compuestos se utiliz— luz ultravioleta (λ = 254 y 365 nm) y PMA al 5% en etanol.
Los puntos de fusi—n se determinaron en un tubo capilar abierto en un aparato Stvert Scientific SMP3 y est‡n sin corregir. Los compuestos se caracterizaron por 1H RMN, 13C RMN, espectrometr’a de masas y an‡lisis elemental.
2.2. S’ntesis del fragmento F1 (azida2)
[(4-Nitrofenil)sulfanil]acetato de metilo (3). A una disoluci—n de 4-nitrobencenotiol (5,05 g, 26,01 mmol) en DMF (50 mL) y a 0 ¼C se a–ade K2CO3 (5,39 g, 39,02 mmol). La mezcla de reacci—n se agita 15 min a 0 ¼C, a continuaci—n se a–ade bromoacetato de metilo (2,65 mL, 28,62 mmol) y se agita a temperatura ambiente toda la noche. Posteriormente, se diluye con AcOEt (200 mL) y la disoluci—n se lava sucesivamente con una disoluci—n acuosa saturada de NH4Cl y salmuera. La fase org‡nica se seca (MgSO4), filtra y evapora a sequedad. El residuo obtenido se purifica por cromatograf’a en columna sobre gel de s’lice, empleando como eluyente hexano: AcOEt 85:15 para dar 3 (5,80 g, 98%) como un s—lido blanco, P.F. 69,8-71.2 ¼C (EtOH).
[(4-Nitrofenil)sulfonil]acetato de metilo (4). A una disoluci—n de 3 (5,72 g, 25,17 mmol) en MeOH (50 mL) y agua (5 mL), se a–ade a 0 ¼C Oxone (38,69 g, 62,93 mmol). La reacci—n se agita a temperatura ambiente durante 2 h. Los restos de Oxone se eliminan por filtraci—n y se lavan con MeOH. La fracci—n metan—lica se concentra a vac’o, se disuelve en AcOEt y se lava con una disoluci—n acuosa saturada de NaHCO3 y salmuera. La fase org‡nica se seca (MgSO4), se filtra, se evapora a sequedad y se recristaliza en AcOEt para dar 4 (5,84 g, 90%) como un s—lido amarillento, P.F. 130,3-131,8 ¼C (AcOEt).
4-[(4-Nitrofenil)sulfonil]tetrahidro-2H-pirano-4-carboxilato de metilo (5). A una disoluci—n de 4 (3,00 g, 11,57 mmol) en DMF (30 mL) a 0 ¼C se a–ade K2CO3 (4,00 g, 28,93 mmol). La mezcla de reacci—n se agita a temperatura ambiente durante 15 min y a continuaci—n se a–aden bis-(2-bromoetil)eter (2,95 g, 12,73 mmol), DMAP (85 mg, 0,69 mmol) y yoduro de tetrabutilamonio (256 mg, 0,69 mmol). La mezcla de reacci—n se agita a temperatura ambiente 24 h y a continuaci—n se vierte sobre HCl 1N (100 mL). El s—lido obtenido se filtra y se lava con hexano para dar, tras recristalizaci—n en AcOEt, 5 como un s—lido amarillento (4,66 g, 76%), P.F. 192,8-194,6 ¼C.
çcido 4-[(4-nitrofenil)sulfonil]tetrahidro-2H-pirano-4-carbox’lico (6). A una disoluci—n de 5 (3,94 g, 11,96 mmol) en THF (40 mL) se a–ade una disoluci—n de NaOH 1N (120 mL) y la mezcla se agita 4 h a temperatura ambiente. A continuaci—n se concentra, se suspende en H2O y se lava con AcOEt. La fase acuosa se acidifica a pH 2 con HCl 3N y se extrae con AcOEt. La fase org‡nica se seca (MgSO4), se filtra y evapora a sequedad para dar 6 (3,40 g, 90%) como un s—lido blanco, P.F. 239,3-240,3 ¼C (descompone).
çcido 4-[(4-aminofenil)sulfonil]tetrahidro-2H-pirano-4-carbox’lico (7). A una disoluci—n de 6 (3,94 g, 12,50 mmol) en EtOH (150 mL) y H2O (50 mL) se a–ade Pd/C (10%) (250 mg) y se introduce en un sistema de hidrogenaci—n Parr, manteniendo una presi—n de hidr—geno de 60 p.s.i durante 5 h a temperatura ambiente. Se elimina el paladio por filtraci—n y a continuaci—n el disolvente a vac’o para obtener 7 (3,40 g, 95%) como un s—lido blanco, P.F. 227,6-228,8 ¼C.
çcido 4-[(4-azidofenil)sulfonil]tetrahidro-2H-pirano-4-carbox’lico (8). El compuesto 7 (1,99 g, 6,98 mmol) se disuelve en CH3CN anhidro (50 mL) y bajo argon y a 0 ¼C se a–aden ButONO (1,24 mL, 10,47 mmol) y TMSN3 (1,10 mL, 8,38 mmol) gota a gota. La mezcla de reacci—n se agita a 0 ¼C durante 30 min y posteriormente 3 h a temperatura ambiente. A continuaci—n, se evapora a sequedad y el residuo se purifica por cromatograf’a en columna sobre gel de s’lice, empleando como eluyente CH2Cl2:MeOH 97,5:2,5 para obtener 8 (2,04 g, 94%) como un s—lido amarillento, P.F. 191,4-192,4 ¼C (descompone).
4-[(4-Azidofenil)sulfonil]-N-(tetrahidro-2H-piran-2-iloxi)tetrahidro-2H-pirano-4-carboxamida (9). A una disoluci—n de 8 (1,65 g, 5,30 mmol) en DMF (20 mL) se a–aden HOBT (859 mg, 6,36 mmol), NMM (1,75 mL, 15,90 mmol), NH2-OTHP (1,24 g, 10,60 mmol) y EDCI (1,42 g, 7,42 mmol). La reacci—n se deja agitando toda la noche a temperatura ambiente y a continuaci—n se diluye con AcOEt (60 mL) y se lava sucesivamente con una disoluci—n acuosa saturada de NH4Cl y salmuera. La fase org‡nica se seca (MgSO4), filtra y evapora a sequedad. El s—lido obtenido se recristaliza en EtOH y agua para obtener 9 (1,97 g, 91%) como un s—lido anaranjado, P.F. 194,2-195,8 ¼C.
4-[(4-Azidofenil)sulfonil]-N-hidroxitetrahidro-2H-pirano-4-carboxamida (2). A una disoluci—n de 9 (1,92 g, 4,69 mmol) en dioxano (10 mL) se a–aden HCl 4N en dioxano (5,86 mL, 23,43 mmol) y MeOH (10 mL). La reacci—n se agita 2 h a temperatura ambiente y a continuaci—n se concentra a vac’o. El s—lido obtenido se recristaliza de EtOH y agua para dar 2 (1,36 g, 89%) como un s—lido naranja, P.F. 197,2-198,1 ¼C (descompone).
2.3. S’ntesis del fragmento F2 (alquinos)
N-(Prop-2-in-1-ilcarbamoil)bencenosulfonamida (10). A una disoluci—n de propargilamina (1,48 g, 26,38 mmol) en CH3CN anhidro (40 mL) se a–ade, bajo arg—n, isocianato de bencenosulfonilo (5,09 g, 26,38 mmol). La mezcla de reacci—n se agita toda la noche a temperatura ambiente. A continuaci—n, se concentra a vac’o y el s—lido obtenido se recristaliza de AcOEt para dar 10 (5,47 g, 87%) como un s—lido blanco, P.F. 161,8-163,6 ¼C.
[3-(4-Pentilfenil)prop-1-inil] trimetilsilano (13) A una mezcla de virutas de magnesio (0,34 g, 14,04 mmol) y yodo (10 mg) en THF anhidro (2 mL), se a–ade en atm—sfera de arg—n una fracci—n (1 mL) de una disoluci—n de 1-bromo-4-pentilbenceno (3,00 g, 12,81 mmol) en THF anhidro (10 mL). Una vez empezada la formaci—n del magnesiano y tras la posterior adici—n de 10 mL de THF anhidro, se completa la adici—n, gota a gota, de la disoluci—n del bromuro de arilo. La mezcla de reacci—n se calienta a reflujo 2 h y, una vez fr’a, el exceso de magnesio se elimina por filtraci—n v’a c‡nula. A la disoluci—n restante se le a–ade (3-bromoprop-1-inil)trimetilsilano (2,0 g, 10,25 mmol) y la mezcla se calienta a reflujo 12 h, se enfr’a y se concentra a vac’o. Se a–ade una disoluci—n de HCl 1N (50 mL) al crudo y se extrae con Et2O. La fase org‡nica se seca (MgSO4), filtra y evapora a sequedad. El residuo obtenido se purifica por cromatograf’a en columna sobre gel de s’lice, empleando como eluyente hexano, para obtener (13) (708 mg, 21%) como un l’quido incoloro.
[3-(4-Fenoxifenil)prop-1-inil]trimetilsilano (14) Siguiendo el mŽtodo anterior se parte de 1-bromo-4-fenoxibenceno (4,00 g, 16,06 mmol), virutas de magnesio (0,42 g, 17,29 mmol), yodo (10 mg) y (3-bromoprop-1-inil)trimetilsilano (2,36 g, 12,35 mmol). Tras la purificaci—n cromatogr‡fica con hexano:CH2Cl2 (95:5) como eluyente se obtiene 14 (1,15 g, 33%) como un l’quido incoloro.
1-Pentil-4-(2-propin-1-il) benceno (11) El alquino 13 (618 mg, 2,39 mmol) se disuelve en EtOH (10 mL) y se le a–aden gota a gota una disoluci—n de nitrato de plata (609 mg, 3,59 mmol) en agua (3 mL) y EtOH (7 mL). La mezcla de reacci—n se agita a temperatura ambiente 30 min y a continuaci—n se a–ade una disoluci—n de KCN (1,58 g, 23,91 mmol) en agua (3 mL). La mezcla se extrae con Et2O, y la fase org‡nica se lava con agua y salmuera, se seca (MgSO4), filtra y evapora a sequedad. Se obtiene un residuo que se purifica por cromatograf’a en columna sobre gel de s’lice, empleando hexano como eluyente, para obtener 11 (430 mg, 97%) como un aceite incoloro que descompone con el tiempo.
1-Fenoxi-4-(2-propin-1-il)benceno (12) Siguiendo el mŽtodo anterior, se parte de 14 (1,15 g, 4,10 mmol), AgNO3 (1,05 g, 6,15 mmol) y KCN (2,67 g, 41,01 mmol). Tras la purificaci—n cromatogr‡fica empleando como eluyente hexano:CH2Cl2 9:1 se obtiene 12 (734 mg, 86%) como un aceite incoloro que descompone con el tiempo.
2.4. S’ntesis general de triazoles
A una mezcla de la azida 2 (1 equiv) y alquino (1,2-1,3 equiv.) en ButOH y H2O (V/V = 1:1, 5 mL) y bajo arg—n, se a–ade ascorbato s—dico (2 equiv. de una disoluci—n acuosa 1 M recientemente preparada) y sulfato de cobre (II) pentahidratado (0,5 equiv. de una disoluci—n acuosa 0,25 M). La mezcla de reacci—n se agita vigorosamente toda la noche, tras lo que se a–ade agua (20 mL) y hielo. El precipitado obtenido se filtra y se lava con agua (2 x 10 mL) y hexano (2 x 10 mL). El s—lido obtenido se disuelve en una mezcla de CH2Cl2:MeOH:NH3 (acuoso) 6:3:1, se filtra sobre gel de s’lice y se concentra a vac’o para obtener los compuestos deseados (15-25).
2.5. Estudios de modelado molecular
Estudios de docking: GLIDE (grid-based ligand docking with energetics) (38).
La diana utilizada para los estudios de docking, ha sido la estructura resuelta por RMN del dominio catal’tico de la MMP2 con un inhibidor de tipo hidroxamato, el compuesto i52 (1hov.pdb) (39). Para estos estudios, se ha utilizado el modelo 1 de la estructura depositada en el pdb, de acuerdo con los resultados obtenidos en estudios previos con esta misma diana (40, 41). Esta estructura se optimiza y minimiza usando la aplicaci—n Protein Preparation Wizard intregrada en el paquete de GLIDE. Seguidamente, se crean los mapas de interacci—n del sitio activo de la MMP-2 usando la aplicaci—n Receptor Grid Generation y se selecciona al ligando i52 como centro de la caja. Todos los compuestos a estudiar se preparan usando la aplicaci—n Ligprep. El campo de fuerzas OPLS-2005 se selecciona para la preparaci—n de ambos, prote’na y ligandos. Los estudios de docking se establecen para llevarse a cabo de forma aleatoria.
Para cada estudio se selecciona que el programa busque 10.000 conformaciones por pose (o soluci—n de docking) y un nœmero m‡ximo de 10 poses por compuesto. El mŽtodo seleccionado para el estudio es el XP (Extra-Precision) docking (42).
2.6. Zimograf’a
Como fuente de gelatinasas se emplea suero de sangre humana perteneciente a voluntarios sanos. En cada pocillo del gel para zimograf’a, con un 10% de gelatina, se a–ade la misma cantidad de suero (1,5 ml) (Invitrogen, Carlsbad, CA,USA). Tras la electroforesis, el gel se incuba durante 30 min en un tamp—n renaturalizante y otros 30 min en un tamp—n de revelado, ambos a temperatura ambiente. A continuaci—n, los geles se cortan en l’neas individuales y se incuban en presencia de los inhibidores en el tamp—n de revelado toda la noche a 37 ¼C. Tras varios lavados los fragmentos del gel se revelan con Simply Blue (Invitrogen), se elimina el revelador y se escanean con Odyssey (Li-cor, Lincoln, Nebraska, USA). La actividad sobre la gelatina de cada enzima (MMP2, 72 kDa; MMP9, 92 kDa) se cuantifica por an‡lisis de imagen (Image-J, NIH, Bethesda, MD, USA) y los valores de CI50 se calculan con MS Excel en XLfit (IDBS, UL, Vs. 5.0).
2.7. Ensayo de inhibici—n en MMPs
Las medidas de actividad en las diferentes MMPs se lleva a cabo usando el ensayo colorimŽtrico comercial MMP Inhibitor Profiling Kit (Enzo Life Science International, Inc.). La absorbancia se mide a 414 nm (microplate photometer Thermo Scientific Multiscan FC). La reacci—n enzim‡tica se lleva a cabo a 37 ¼C. Las correspondientes MMPs, se incuban por triplicado con al menos seis concentraciones de cada inhibidor. Tras la adici—n del sustrato, el incremento de absorbancia se recoge cada minuto durante 20 min. Se representa gr‡ficamente la densidad —ptica frente al tiempo para obtener la ecuaci—n de velocidad. El porcentaje de actividad residual para cada compuesto se calcula usando la siguiente f—rmula: % de actividad remanente = velocidad en presencia del inhibidor / velocidad del control x 100. Se emplea como control positivo el inhibidor NNGH (43).
3. RESULTADOS Y DISCUSIîN
En el esquema 1 se muestra la reacci—n Òclick" utilizada en las s’ntesis de los inhibidores que se describen en este trabajo. Se parte del fragmento F1, que contiene simult‡neamente el ZBG (hidroxamato) y el grupo funcional azida, y de diferentes fragmentos F2, que contienen un alquino terminal de naturaleza generalmente hidr—foba para interaccionar con el subsitio S1Õ de la enzima. Ambos fragmentos se han unido utilizando la CuAAC, dando lugar a los correspondientes 1,2,3-triazoles 1,4-disustituidos.
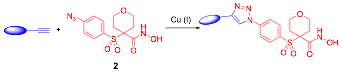
Esquema 1.- MŽtodo general de s’ntesis de los 1,2,3-triazoles 1,4-disustituidos.
El fragmento F1 que contiene el ZBG posee adem‡s un grupo sulfona. Este grupo es muy importante por su capacidad de establecer un enlace de hidr—geno con el esqueleto pept’dico de la enzima, dirigiendo el sustituyente hidr—fobo hacia el bolsillo S1Õ. Los alquinos utilizados se han seleccionado en un trabajo previo en el que se ha realizado una bœsqueda bibliogr‡fica de inhibidores de MMP-2, cuyas interacciones con la enzima se analizaron mediante tŽcnicas de modelado molecular (44). Algunos de los alquinos son comerciales y otros son f‡cilmente asequibles mediante la s’ntesis que se detalla m‡s adelante.
La s’ntesis de la azida 2 se muestra en el esquema 2. El primer paso consiste en la alquilaci—n del 4-nitrobencenotiol, que conduce al sulfuro 3 con un rendimiento excelente (98%). A continuaci—n, se obtiene la sulfona 4 por oxidaci—n con oxone¨ y se forma el tetrahidropirano 5 por dialquilaci—n en la posici—n a de la sulfona. La saponificaci—n del Žster met’lico con hidr—xido s—dico para dar 6 y la posterior hidrogenaci—n catal’tica del grupo nitro conduce al amino‡cido 7, que se convierte en el producto final tras las etapas de transformaci—n del grupo amino en azida para dar 8, acoplamiento con o-THP hidroxilamina formando 9 y posterior desprotecci—n del grupo THP para dar 2. El rendimiento global del proceso es del 46% para los ocho pasos de reacci—n.
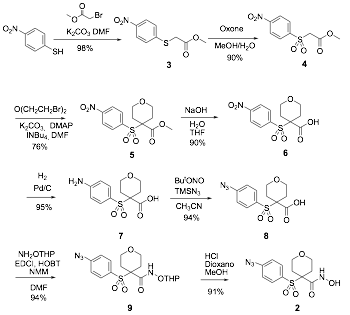
Esquema 2.- S’ntesis de la azida 2.
La mayor’a de los alquinos elegidos son comerciales (Figura 2). Sin embargo ha sido necesaria la s’ntesis de 10-12 (esquema 3).
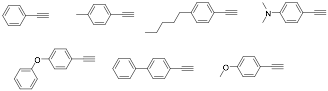
Figura 2.- Alquinos disponibles comercialmente.
El alquino 10 se obtiene f‡cilmente y con buen rendimiento a partir de propargilamina e isocianato de bencenosulfonilo. Para la s’ntesis de 11 y 12, en primer lugar se sintetiza el magnesiano del correspondiente bromuro de arilo, que se hace reaccionar con bromuro de propargilo protegido con el grupo trimetilsililo, obteniendose los alquinos 13 y 14. En un segundo paso, se elimina el grupo protector para dejar libre el alquino terminal.
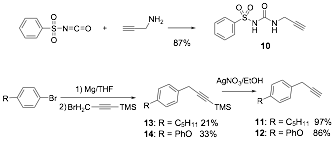
Esquema 3.- S’ntesis de los alquinos 10-12.
Una vez sintetizada la azida 2 y los alquinos, se procedi— a su acoplamiento mediante la reacci—n de cicloadici—n 1,3-dipolar catalizada por cobre para obtener los triazoles 15-25 con rendimientos moderados (27-79%) (esquema 4).
Se utiliz— el sistema cobre (II)/ascorbato s—dico como catalizador, ensay‡ndose una gran variedad de condiciones para optimizar la reacci—n. El empleo de bajas cantidades de CuSO4 (0,25-2 mol%) en ButOH/H2O y ‡cido asc—rbico (5-10 mol %) condujo a una baja conversi—n de los productos de partida y no se observ— progreso en la reacci—n, incluso despuŽs de 3 d’as o bajo calentamiento moderado.
Como consecuencia, la cantidad de catalizador se increment— progresivamente, obteniŽndose los mejores resultados tras la adici—n de 0,5 equivalentes de CuSO4 y dos equivalentes de ‡cido asc—rbico y en atm—sfera inerte, ya que en presencia de ox’geno fue necesario el calentamiento de la mezcla de reacci—n a 80 ¼C para una conversi—n total. Como disolvente para la reacci—n se emple— una mezcla 1:1 de H2O:ButOH, ya que otros disolventes como N,N-dimetilformamida no condujeron a mejores resultados.
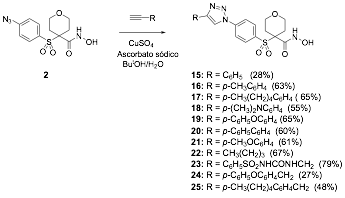
Esquema 4.- S’ntesis de los triazoles 15-25.
Evaluaci—n Biol—gica de los triazoles
A continuaci—n, se emple— la tŽcnica de zimograf’a para la evaluaci—n de la inhibici—n de la actividad enzim‡tica de MMP-2 y MMP-9 de todos los triazoles 15-25. Los resultados se muestran en la Tabla 1.
Hay que destacar que todos los compuestos presentan una actividad inhibitoria muy alta frente a MMP-2, con valores de CI50 del orden picomolar para los compuestos 15-21 y superior a la obtenida para el BiPS en este mismo ensayo (inhibidor comercial de MMP-2 y MMP-9).
Por otro lado, los compuestos 23, 24 y 25 presentan peores valores de inhibici—n que el resto de triazoles, con valores de CI50 en el rango de nanomolar.
Tabla 1. Actividad inhibitoria frente a MMP-2 y MMP-9 para los tetrahidropiranos 15-25.
Compuesto |
R |
MMP-2 CI50, nM |
MMP-9 CI50, nM |
Selectividad MMP9/MMP2 |
15 |
|
1.034«10-2 |
3.06«10-2 |
2.96 |
16 |
|
2.45«10-3 |
11.11«10-3 |
4.53 |
17 |
|
7.75«10-3 |
13.57«10-3 |
1.75 |
18 |
|
1.91«10-3 |
14.63«10-3 |
7.65 |
19 |
|
10.02«10-3 |
32.69«10-3 |
3.26 |
20 |
|
1.94«10-3 |
18.83«10-3 |
9.69 |
21 |
|
9.47«10-3 |
51.47«10-3 |
5.43 |
22 |
|
53.25«10-3 |
127.54«10-3 |
2.40 |
23 |
|
1.05 |
> 50.00 |
- |
24 |
|
1.18 |
> 50.00 |
- |
25 |
|
6.79 |
-* |
- |
BiPS |
22.28«10-3 |
53.40«10-3 |
2.40 |
*No fue posible calcular un valor espec’fico de CI50 para la MMP-9. Sin embargo, el valor de inhibici—n ha sido menor que el obtenido para MMP-2.
El valor espec’fico de CI50 en MMP-2 para todos los compuestos ha sido m‡s bajo que los valores para MMP-9, presentando en algunos casos una relaci—n de inhibici—n MMP-2/MMP-9 muy interesante. Por ello, se seleccionaron 20 y 21 para un estudio posterior del perfil de inhibici—n en una bater’a de MMPs.
Estudios de modelado molecular de los triazoles
Para explicar los resultados de actividad observados y tratar de elucidar el modo de uni—n de estos compuestos a MMP-2, se ha llevado a cabo un estudio de modelado molecular mediante tŽcnicas de docking. Todos los compuestos con una actividad del orden picomolar (15-22) tienen, segœn los experimentos de docking, un comportamiento similar a i52 (Figura 3) (inhibidor de MMP-2 presente en la estructura de RMN del PDB 1hov).
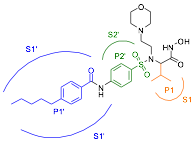
Figura 3.- Estructura qu’mica de i52 donde se muestran las interacciones con los principales subsitios del centro activo de MMP-2.
En la Figura 4 (amarillo) se representa el modo de uni—n del compuesto 20, que es uno de los m‡s activos de la serie (CI50 = 1,94 pM) y selectivo frente a MMP-9. Analizando los datos obtenidos, se observa que los dos ‡tomos de ox’geno del grupo funcional hidroxamato se coordinan con el zinc catal’tico adoptando, junto con las histidinas, una disposici—n de bipir‡mide trigonal distorsionada. Adem‡s, la cadena lateral se dirige hacia el subsitio S1Õ de la MMP-2, estableciendo interacciones hidr—fobas en dicho bolsillo. Se destacan las interacciones con los amino‡cidos Phe148, Phe115, Leu150 y Thr145, ya que son los m‡s implicados en la selectividad. La Thr145 est‡ presente exclusivamente en gelatinasas (MMP-2 y MMP-9), mientras que la Phe148 distingue entre ambas, ya que solo se encuentra presente en el sitio activo de la MMP-2, por lo que las interacciones con estos amino‡cidos pueden explicar la selectividad observada.
En el caso del compuesto 15 (verde, Figura 4), cuya actividad baja en un orden de 10 unidades en el ensayo de zimograf’a, los diferentes resultados del estudio del modo de uni—n no muestran una clara interacci—n entre el grupo hidroxamato y el ‡tomo de zinc catal’tico. Ello puede deberse a que la cadena lateral m‡s corta, permite un acceso profundo del compuesto dentro del bolsillo hidr—fobo S1Õ que est‡ favorecido por la formaci—n de un enlace de hidr—geno entre el grupo hidroxamato y el grupo NH de la Leu83 (Figura 4). Segœn este modo de uni—n, parece que es uno de los ox’genos del grupo sulfona el que establece una coordinaci—n con el ‡tomo de zinc. En la Figura 4 se representan los resultados de docking del compuesto 15 (verde) y se comparan con los resultados obtenidos para 20 (amarillo).
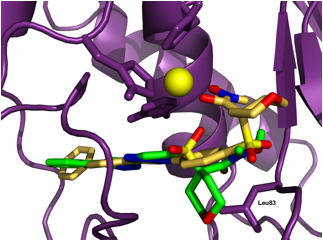
Figura 4.- Modelo del modo de uni—n obtenido para los compuestos 15 (verde) y 20 (amarillo).
La diferencia m‡s significativa en los valores de actividad se encuentra al pasar a los compuestos 24 y 25, que son an‡logos de 19 y 17, respectivamente, en los que se ha introducido un grupo metileno adicional entre el fenilo y el triazol. Los resultados de actividad en zimograf’a mostraron que esa peque–a variaci—n de la estructura conduce a un descenso acusado de la inhibici—n frente a MMP-2 (1000 unidades de actividad), y MMP-9 (CI50 > 50 nM). En el caso de 24 los estudios de docking muestran que en ninguna de las soluciones de menor energ’a el sustituyente p-fenoxifenilo se sitœa en el bolsillo S1Õ, mientras que para 25, aquellas soluciones que colocan la cadena de p-pentilfenilo en el bolsillo S1Õ, no permiten una coordinaci—n eficaz con el ‡tomo de zinc.
Estudios de actividad en diferentes MMPs
Los compuestos 20 y 21 se seleccionaron para llevar a cabo estudios m‡s amplios de selectividad. Este experimento se realiz— sobre 10 MMPs diferentes, utilizando un ensayo colorimŽtrico comercial de la compa–’a Biomol, que permite la medida cuantitativa de la inhibici—n de las diferentes MMPs como un porcentaje de la actividad remanente de cada una de ellas.
En la Tabla 2 se recogen los valores de las actividades inhibitorias de estos dos compuestos.
El compuesto 20 muestra un valor de CI50 = 1,4 nM para MMP-2 en estas condiciones. Sin embargo, es aœn m‡s interesante la alta selectividad que presenta en su interacci—n frente a otras MMPs. As’, su actividad frente a MMP-1 (CI50>1000) y MMP-7 (CI50>100), dos metaloproteasas que poseen un subsitio S1Õ poco profundo es muy inferior (45). Adem‡s, es tambiŽn selectivo frente a otras MMPs caracterizadas por poseer, al igual que la MMP-2, un bolsillo S1Õ profundo como son la MMP-8 (CI50>100 nM), MMP-14 (CI50 = 65 nM) y MMP-9 (CI50 = 98 nM). La presencia del grupo bifenilo, que confiere una gran rigidez y adecuada hidrofobicidad y longitud para introducirse e interaccionar perfectamente en el subsitio S1Õ, debe ser la responsable de la gran actividad y selectividad frente a otras MMPs. En cuanto al compuesto 21, en el que el sistema de bifenilo r’gido se ha sustituido por un grupo p-metoxifenilo m‡s flexible, presenta una potencia ligeramente mayor en MMP-2 (0,3 nM). Sin embargo, su patr—n de selectividades frente a otras MMPs es algo mas reducida.
Tabla 2. Actividad inhibitoria de 20 y 21 en diferentes MMPs.
20 CI50, nM |
21 CI50, nM |
|
MMP-1 |
>1000 |
>1000 |
MMP-2 |
1.4 |
0.3 |
MMP-3 |
17.2 |
9.6 |
MMP-7 |
>100 |
70 |
MMP-8 |
>100 |
6.1 |
MMP-9 |
98 |
11.3 |
MMP-10 |
51 |
7.8 |
MMP-12 |
3.2 |
1.2 |
MMP-13 |
0.9 |
1.4 |
MMP14 |
65 |
8.2 |
En resumen, este estudio nos ha permitido describir un nuevo inhibidor de MMP-2 (20) con una gran potencia (nanomolar en el ensayo colorimŽtrico y picomolar en zimograf’a) y una interesante selectividad frente a MMP-9. Adem‡s, es inactivo frente a MMP-1, MMP-7 y MMP-8 y presenta una actividad considerablemente menor frente a MMP-3, MMP-4 y MMP-10. Por lo tanto, el dise–o basado en fragmentos que hemos utilizado ha resultado muy eficaz para obtener nuevos inhibidores selectivos de esta importante familia de enzimas.
4. CONCLUSIONES
Utilizando una aproximaci—n de dise–o basado en fragmentos, y el potencial de la qu’mica ÒclickÓ, se ha llevado a cabo la s’ntesis de una serie de inhibidores potentes y selectivos de MMP-2. En primer lugar, se ha sintetizado un fragmento que contiene el grupo hidroxamato que actœa como Zinc Binding Group y un grupo azida necesario para la reacci—n CuAAC. Este fragmento se une a diferentes alquinos, seleccionados para unirse al bolsillo hidr—fobo S1Õ de la enzima. La actividad inhibitoria de los compuestos obtenidos frente a MMP-2 y MMP-9 se ha evaluado mediante un ensayo de zimograf’a. Se seleccionaron los dos compuestos con mejor perfil de inhibici—n para estudiar su actividad y selectividad frente a un panel de 10 metaloproteasas en un ensayo colorimŽtrico. Entre todos los inhibidores seleccionados cabe destacar el hidroxamato 20 con una actividad del orden nanomolar frente a MMP-2 y MMP-13 en este ensayo, mientras que es totalmente inactivo frente a MMP-1 y MMP-7 y 70 veces menos activo frente a MMP-9. Asimismo presenta una menor actividad frente a MMP-10 y MMP-14.
5. AGRADECIMIENTOS
Este trabajo ha sido financiado por el Ministerio de Ciencia e Innovaci—n (SAF2005-02608, SAF2008-00945, y SAF2009-13240). Al Ministerio de Educaci—n (programa FPU) por la beca a P. S., a la Fundaci—n Universitaria San Pablo CEU por la beca de J. M. Z. y a la empresa EADS-CASA por la beca a K. F.
6. REFERENCIAS
1. Niebroj-Dobosz, I., & al. (2010). Matrix metalloproteinases and their tissue inhibitors in serum and cerebrospinal fluid of patients with amyotrophic lateral sclerosis. European Journal of Neurology, 17(2), 226-231.
2. Yang, Y., & al. (2010). Increased intranuclear matrix metalloproteinase activity in neurons interferes with oxidative DNA repair in focal cerebral ischemia. Journal of Neurochemistry, 112(1), 134-149.
3. Zhou, H., & al. (2008). Sinomenine ameliorates arthritis via MMPs, TIMPs, and cytokines in rats. Biochemical and Biophysical Research Communications, 376(2), 352-357.
4. Nicolescu, A.C., & al. (2009). Inhibition of matrix metalloproteinase-2 by PARP inhibitors. Biochemical and Biophysical Research Communications, 387(4), 646-650.
5. Seo, K.W., & al. (2010). Participation of 5-lipoxygenase-derived LTB4 in 4-hydroxynonenal- enhanced MMP-2 production in vascular smooth muscle cells. Atherosclerosis, 208 (1).
6. Chetty, C., & al. (2008). Tissue inhibitor of metalloproteinase 3 suppresses tumor angiogenesis in matrix metalloproteinase 2-down-regulated lung cancer. Cancer Research, 68(12), 4736-4745.
7. Overall, C.M., & al. (2006). Towards third generation matrix metalloproteinase inhibitors for cancer therapy. British Journal of Cancer, 94(7), 941-946.
8. Binker, M.G., & al. (2009). EGF promotes invasion by PANC-1 cells through Racl/ROS- dependent secretion and activation of MMP-2. Biochemical and Biophysical Research Communications, 379(2), 445-450.
9. Overall, C.M., & O. Kleifeld (2006). Tumour microenvironment - Opinion - Validating matrix metalloproteinases as drug targets and anti-targets for cancer therapy. Nature Reviews Cancer, 6(3), 227-239.
10. Xi, L., & al. (2009). A combined molecular modeling study on gelatinases and their potent inhibitors. Journal of Computational Chemistry, 31(1), 24-42.
11. Summers, J.B. (1998). in Annual Reports in Medicinal Chemistry, 33, D. Robertson and J. Plattner, Editors, Academic Press: San Diego, 131-149.
12. Terp, G.E., & al. (2000). Structural differences of matrix metalloproteinases. Homology modeling and energy minimization of enzyme-substrate complexes. Journal of Biomolecular Structure & Dynamics, 17(6), 933-946.
13. Bode, W., & al. (1999). Structural properties of matrix metalloproteinases. Cellular and Molecular Life Sciences: CMLS, 55(4), 639-652.
14. Natchus, M.G., & al. (2000). Development of new hydroxamate matrix metalloproteinase inhibitors derived from functionalized 4-aminoprolines. Journal of Medicinal Chemistry, 43(26), 4948-63.
15. Scozzafava, A., & al. (2000). Protease inhibitors: Synthesis of potent bacterial collagenase and matrix metalloproteinase inhibitors incorporating N-4- nitrobenzylsulfonylglycine hydroxamate moieties. Journal of Medicinal Chemistry, 43(9), 1858-1865.
16. Almstead, N.G., & al. (1999). Design, synthesis, and biological evaluation of potent thiazine- and thiazepine-based matrix metalloproteinase inhibitors. Journal of Medicinal Chemistry, 42(22), 4547-4562.
17. Pikul, S., & al. (1998). Discovery of potent, achiral matrix metalloproteinase inhibitors. Journal of Medicinal Chemistry, 41(19), 3568-71.
18. Kessenbrock., K, & al. (2010). Matrix Metalloproteinases: Regulators of the Tumor Microenvironment. Cell, 141(1), 52-67.
19. Tuccinardi, T., & al. (2006). Amber force field implementation, molecular modelling study, synthesis and MMP-1/MMP-2 inhibition profile of (R) and (S)-N-hydroxy-2-(N- isopropoxybiphenyl-4-ylsulfonamido)-3-methylbutanamid es. Bioorganic & Medicinal Chemistry, 14(12), 4260-4276.
20. Martin, M.D., & al. (2007). The other side of MMPs: Protective roles in tumor progression. Cancer and Metastasis Reviews, 26(3-4), 717-724.
21. Almholt, K., & al. (2008). Metastasis is strongly reduced by the matrix metalloproteinase inhibitor Galardin in the MMTV-PymT transgenic breast cancer model. Molecular Cancer Therapeutics, 7(9), 2758-2767.
22. Dashevsky., O, & al. (2009). Platelet-derived microparticles promote invasiveness of prostate cancer cells via upregulation of MMP-2 production. International Journal of Cancer, 124(8), 1773-1777.
23. Pfaffen, S., & al. (2010). Isolation and characterization of human monoclonal antibodies specific to MMP-1A, MMP-2 and MMP-3. Experimental Cell Research, 316(5), 836-847.
24. Whittaker., M, & al. (1999). Design and therapeutic application of matrix metalloproteinase inhibitors. Chemical Reviews, 99(9), 2735-2776.
25. Becker, D., & al. (2005). Synthesis and structure-activity relationships of beta- and alpha- piperidine sulfone hydroxamic acid matrix metalloproteinase inhibitors with oral antitumor efficacy. Journal of Medicinal Chemistry, 48(21), 6713-6730.
26. Kolodziej., S.A, & al. (2010). Orally bioavailable dual MMP-1/MMP-14 sparing, MMP-13 selective alpha-sulfone hydroxamates. Bioorganic & Medicinal Chemistry Letters, 20(12), 3557-3560.
27. Kolodziej, S.A., & al. (2010). MMP-13 selective isonipecotamide alpha-sulfone hydroxamates. Bioorganic & Medicinal Chemistry Letters, 20(12), 3561-3564.
28. Skiles, J.W., & al. (2004). The design, structure, and clinical update of small molecular weight matrix metalloproteinase inhibitors. Current Medicinal Chemistry, 11(22), 2911-2977.
29. Manetsch, R., & al. In situ click chemistry: Enzyme inhibitors made to their own specifications. Journal of the American Chemical Society, (2004). 126(40), 12809-12818.
30. Lewis, W.G, et al. (2002). Click chemistry in situ: Acetylcholinesterase as a reaction vessel for the selective assembly of a femtomolar inhibitor from an array of building blocks. Angewandte Chemie-International Edition, 41(6), 1053-1057.
31. Krasinski, A., & al. (2005). In situ selection of lead compounds by click chemistry: Target- guided optimization of acetylcholinesterase inhibitors. Journal of the American Chemical Society, 127(18), 6686-6692.
32. Whiting, M., & al. (2006). Inhibitors of HIV-1 protease by using in situ click chemistry. Angewandte Chemie-International Edition, 45(9), 1435-1439.
33. Giffin, M.J., & al. (2008). A Copper(I)-Catalyzed 1,2,3-Triazole Azide-Alkyne Click Compound is a Potent Inhibitor of a Multidrug-Resistant HIV-1 Protease Variant. Journal of Medicinal Chemistry, 51(20), 6263-6270.
34. Kalesh, K.A., & al. (2009). Rapid synthesis of Abelson tyrosine kinase inhibitors using click chemistry. Organic & Biomolecular Chemistry, 7(24), 5129-36.
35. Carvalho, I., & al. (2010). 'Click chemistry' synthesis of a library of 1,2,3-triazole- substituted galactose derivatives and their evaluation against Trypanosoma cruzi and its cell surface trans-sialidase. Bioorganic & Medicinal Chemistry, 18(7), 2412-2427.
36. Ng, S.L., & al. (2008). Click synthesis of small-molecule inhibitors targeting caspases. Organic & Biomolecular Chemistry.
37. Wang., J, & al. (2006). Rapid assembly of matrix metalloprotease inhibitors using click chemistry. Organic Letters, 8(17), 3821-3824.
38. GLIDE (2003). Glide v 2.5021. Schršdinger, L.L.C., New York, USA.
39. Feng, Y.Q., & al. (2002). Solution structure and backbone dynamics of the catalytic domain of matrix metalloproteinase-2 complexed with a hydroxamic acid inhibitor. Biochimica Et Biophysica Acta-Proteins and Proteomics, 1598(1-2), 10-23.
40. Garcia, M.A., & al. (2007). Are adrenomedullin positive modulators novel matrix metalloproteinase inhibitors? Anales de la Real Academia de Farmacia; Instituto de Espa–a, 73, 703-724.
41. Garcia, M.A. (2007). Estudio de interacciones ligando-receptor mediante tŽcnicas computacionales. La adrenomedulina y las metaloproteasas de la matriz como dianas para el dise–o racional de f‡rmacos. Tesis Doctoral Universidad San Pablo CEU.
42. Friesner, R.A., & al. (2006). Extra precision glide: docking and scoring incorporating a model of hydrophobic enclosure for protein-ligand complexes. J Med Chem, 49(21), 6177-96.
43. MacPherson, L.J., & al. (1997). Discovery of CGS 27023A, a non-peptidic, potent, and orally active stromelysin inhibitor that blocks cartilage degradation in rabbits. J Med Chem, 40(16), 2525-2532.
44. Serra. (2009). Estrategias computacionales para el estudio de la inhibici—n de metaloproteasa de la matriz-2. Dise–o de inhibidores. DEA Universidad San Pablo CEU.
45. Overall, C.M., & Lopez-Otin, C. (2002). Strategies for MMP inhibition in cancer: Innovations for the post-trial era. Nature Reviews Cancer, 2(9), 657-672.