Page 6 - Anales_81_1_2015
P. 6
Carmen Avendaño
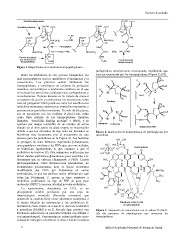
ÁcidoN-acetilmurámico CH2OH
O
N-acetilglucosamina CH2OH CH2OH O
O O
O H3C
O D-Ala O
H3C L-Ala
CH2OH O H3C CH2OH O O NHCOCH3
OH O NHCOCH3 OH L-Ala Glu-D
L-Ala
O O Glu-D L-Lys
Glu-D Pentapéptido
NHCOCH3 L-Lys (Gly)5 NH2 NHCOCH3 L-Lys (Gly)5 NH D-Ala
Porción de sustrato D-Ala D-Ala Transpeptidación
que reconocen las D-Ala D-Ala (enlace cruzado)
transpeptidasas
Figura 1. Etapas finales en la biosíntesis del péptidoglicano. polipeptídica anteriormente mencionada, impidiendo que
ésta sea reconocida por las transpeptidasas (Figura 3) (10).
Entre los inhibidores de este proceso biosintético, los
más representativos son los antibióticos β-lactámicos y la O CH3
vancomicina. Los primeros actúan inhibiendo las R CH3
transpeptidasas, y constituyen un conjunto de productos H NH
naturales, semisintéticos o totalmente sintéticos en el que NH S
se incluyen las penicilinas, cefalosporinas, carbapenemas y O CO2H O CO2H
monobactamas. Durante décadas se ha tratado de mejorar NH S
su espectro de acción y contrarrestar las resistencias, sobre H NH
todo en patógenos Gram positivos como los estafilococos R CH3
meticilina-resistentes, enterococos ampicilina-resistentes y CH3 Ser-O O
pneumococos penicilina-resistentes. El ciclo de β-lactama, Penicilinas
por su semejanza con los residuos D-Ala-D-Ala, actúa
como falso sustrato de las transpeptidasas (también O R CH3
llamadas “penicillin binding proteins” o PBPs), y su CH3
apertura por ataque nucleófilo de un residuo de serina H3C NH H NH
situado en el sitio activo de éstas origina su inactivación S
debido a que los derivados de tipo éster así formados se O CO2H O CO2H
hidrolizan muy lentamente (ver el mecanismo de este NH CH3 H
proceso para las penicilinas en la Figura 2). Las bacterias D-Ala-D-Ala NH
Péptidoglicano Ser-O H
se protegen de estos fármacos expresando β-lactamasas,
unas peptidasas similares a las PBPs que, una vez aciladas, O
se hidrolizan rápidamente, lo que conduce a que el
antibiótico se inactive (9). Esta semejanza explica que sea Acilación de las PBPs
difícil diseñar antibióticos β-lactámcos poco sensibles a β- Figura 2. Inactivación de transpeptidasas de péptidoglicano por
lactamasas que se enlacen eficazmente a PBPs. Ciertos penicilinas.
microorganismos, como Streptococcus pneumoniae, no
OH OH
biosintetizan β-lactamasas, pero se hacen resistentes
modificando sus PBPs por mutaciones en varios H3C HO O Vancomicina
aminoácidos, lo que les confiere menor afinidad por casi Cl
H3C O O O
todas las β-lactamas. S. aureus se hace resistente a HO H2N O O
meticilina codificando un tipo de PBP de gran peso
molecular (PBP2’) con poca afinidad por este antibiótico. HO Cl OH
O H
La vancomicina, descubierta en 1955, es un N O
glicopéptido soluble producido por una cepa de ON
Amycolatopsis orientalis (Nocardia orientalis) que O NH O NH
desarrolló la empresa Lilly como alternativa terapéutica a NN
HO OH H HO
la rápida difusión de resistencias a los antibióticos β- NHCH3
lactámicos, como ocurre en cepas de S. Aureous resistentes
a meticilina (SARM) y en E. faecalis (que produce con O O CH3
frecuencia infecciones en pacientes tratados con diálisis o NH2
con quimioterapia). Vancomicina se enlaza mediante cinco
enlaces de hidrógeno al extremo D-Ala-D-Ala de la cadena CH3
OH
HO O H3C H H O
RN N O
H O H3C H
Residuos D-Ala-D-Ala
del glicopéptido
Figura 3. Interacción de vancomicina con la cadena D-Ala-D-
Ala del precursor de péptidogicano que reconocen las
transpeptidasas.
6 @Real Academia Nacional de Farmacia. Spain
ÁcidoN-acetilmurámico CH2OH
O
N-acetilglucosamina CH2OH CH2OH O
O O
O H3C
O D-Ala O
H3C L-Ala
CH2OH O H3C CH2OH O O NHCOCH3
OH O NHCOCH3 OH L-Ala Glu-D
L-Ala
O O Glu-D L-Lys
Glu-D Pentapéptido
NHCOCH3 L-Lys (Gly)5 NH2 NHCOCH3 L-Lys (Gly)5 NH D-Ala
Porción de sustrato D-Ala D-Ala Transpeptidación
que reconocen las D-Ala D-Ala (enlace cruzado)
transpeptidasas
Figura 1. Etapas finales en la biosíntesis del péptidoglicano. polipeptídica anteriormente mencionada, impidiendo que
ésta sea reconocida por las transpeptidasas (Figura 3) (10).
Entre los inhibidores de este proceso biosintético, los
más representativos son los antibióticos β-lactámicos y la O CH3
vancomicina. Los primeros actúan inhibiendo las R CH3
transpeptidasas, y constituyen un conjunto de productos H NH
naturales, semisintéticos o totalmente sintéticos en el que NH S
se incluyen las penicilinas, cefalosporinas, carbapenemas y O CO2H O CO2H
monobactamas. Durante décadas se ha tratado de mejorar NH S
su espectro de acción y contrarrestar las resistencias, sobre H NH
todo en patógenos Gram positivos como los estafilococos R CH3
meticilina-resistentes, enterococos ampicilina-resistentes y CH3 Ser-O O
pneumococos penicilina-resistentes. El ciclo de β-lactama, Penicilinas
por su semejanza con los residuos D-Ala-D-Ala, actúa
como falso sustrato de las transpeptidasas (también O R CH3
llamadas “penicillin binding proteins” o PBPs), y su CH3
apertura por ataque nucleófilo de un residuo de serina H3C NH H NH
situado en el sitio activo de éstas origina su inactivación S
debido a que los derivados de tipo éster así formados se O CO2H O CO2H
hidrolizan muy lentamente (ver el mecanismo de este NH CH3 H
proceso para las penicilinas en la Figura 2). Las bacterias D-Ala-D-Ala NH
Péptidoglicano Ser-O H
se protegen de estos fármacos expresando β-lactamasas,
unas peptidasas similares a las PBPs que, una vez aciladas, O
se hidrolizan rápidamente, lo que conduce a que el
antibiótico se inactive (9). Esta semejanza explica que sea Acilación de las PBPs
difícil diseñar antibióticos β-lactámcos poco sensibles a β- Figura 2. Inactivación de transpeptidasas de péptidoglicano por
lactamasas que se enlacen eficazmente a PBPs. Ciertos penicilinas.
microorganismos, como Streptococcus pneumoniae, no
OH OH
biosintetizan β-lactamasas, pero se hacen resistentes
modificando sus PBPs por mutaciones en varios H3C HO O Vancomicina
aminoácidos, lo que les confiere menor afinidad por casi Cl
H3C O O O
todas las β-lactamas. S. aureus se hace resistente a HO H2N O O
meticilina codificando un tipo de PBP de gran peso
molecular (PBP2’) con poca afinidad por este antibiótico. HO Cl OH
O H
La vancomicina, descubierta en 1955, es un N O
glicopéptido soluble producido por una cepa de ON
Amycolatopsis orientalis (Nocardia orientalis) que O NH O NH
desarrolló la empresa Lilly como alternativa terapéutica a NN
HO OH H HO
la rápida difusión de resistencias a los antibióticos β- NHCH3
lactámicos, como ocurre en cepas de S. Aureous resistentes
a meticilina (SARM) y en E. faecalis (que produce con O O CH3
frecuencia infecciones en pacientes tratados con diálisis o NH2
con quimioterapia). Vancomicina se enlaza mediante cinco
enlaces de hidrógeno al extremo D-Ala-D-Ala de la cadena CH3
OH
HO O H3C H H O
RN N O
H O H3C H
Residuos D-Ala-D-Ala
del glicopéptido
Figura 3. Interacción de vancomicina con la cadena D-Ala-D-
Ala del precursor de péptidogicano que reconocen las
transpeptidasas.
6 @Real Academia Nacional de Farmacia. Spain