
Teixobactine, a new antibiotic that would hardly produce resistance
Title in Spanish: Teixobactina, un nuevo antibiótico que difícilmente podría originar resistencias
Carmen AvendaĖo1
1Académica de Número de la Real Academia Nacional de Farmacia, Madrid
*Corresponding Author: avendano@farm.ucm.es An Real Acad Farm Vol. 81, Nľ 1 (2015), pp. 4-10
Received: February 26, 2015 Accepted: Mars 3, 2015 Language of Manuscript: Spanish
![]()
1. INTRODUCCIÓN
Desde que en los aĖos 1940 se introdujo la penicilina en la práctica clínica, los antibióticos han salvado la vida de millones de seres humanos, pero en los últimos tiempos el arsenal contra los microorganismos patógenos se ha estancado. La dificultad de encontrar antibióticos que penetren la pared bacteriana y la falta de interés de la industria farmacéutica debida a la impredecible aparición de resistencias, son algunos de los motivos que pueden justificar este estancamiento. Otro es que los microbiólogos no han detectado nuevos antibióticos naturales debido a que el número de especies que se pueden cultivar en laboratorio representa un pequeĖo porcentaje de todas las que se pueden encontrar en el suelo, el caladero en que habitualmente se han encontrado aquéllos, y que los antibióticos sintéticos no han sido capaces de sustituir a los naturales (2). La mayoría de los antibióticos utilizados en terapéutica son productos naturales que proceden de diferentes especies de hongos y bacterias, especialmente del grupo de los actinomicetos, que en su mayoría se encuentran en la tierra, y se han aislado por cribado de estos microorganismos una vez cultivados.
2. BREVE COMENTARIO SOBRE LAS RESISTENCIAS A LOS ANTIBIÓTICOS
El problema de las resistencias a los antibióticos es antiguo. Ya en 1955, el 13% de las infecciones por Staphylococcus aureus eran insensibles al tratamiento con penicilina, una cifra que ascendió hasta el 91% en 1988. Esta bacteria es la causante de la mayoría de las infecciones debidas a estafilococos, pudiendo originar neumonía, meningitis, shock tóxico, infecciones de las válvulas cardiacas, conjuntivitis, abcesos cutáneos, etc. Muchas cepas de S. aureus son ahora resistentes también a otros antibióticos como oxacillina y amoxicilina, y han comenzado a desarrollar resistencias a meticilina (methicillin resistant Staphylococcus aureus, MRSA) y vancomicina, antibióticos que en otros tiempos se consideraban como “último recurso” para las infecciones más serias. En EEUU se ha estimado que casi 2 millones de personas adquieren cada aĖo alguna infección hospitalaria, y que un 70% de estas infecciones son insensibles al menos a uno de los antibióticos utilizados habitualmente. Un estudio bastante reciente ha seĖalado que en 2011 murieron durante su hospitalización más 11.000 personas con infecciones MRSA (3). F
El creciente problema de la aparición de bacterias resistentes a antibióticos ha comprometido su eficacia. Sin embargo, en 1967 se pensaba que los antibióticos, junto a otros agentes quimioterápicos, podían eliminar cualquier microorganismo patógeno y se declaró oficialmente que el problema de las infecciones había terminado. Esta visión optimista menospreció la increíble capacidad que tienen las bacterias para intercambiar su material genético y adaptarse a situaciones adversas por selección natural, y que las mutaciones que originan resistencias a los antibióticos pueden transferirse a las sucesivas generaciones en los procesos de reproducción bacteriana (4).
Además de su importancia clínica, los antibióticos son uno de los grupos farmacológicos más utilizados en la terapéutica, profilaxis y promoción del crecimiento de animales destinados al consumo humano, lo que ha contribuido a la selección de poblaciones microbianas resistentes. La European Federation of Animal Health Industries (FEDESA) estimó en 1997 que en la UE se consumían anualmente unas 10.500 toneladas de antibióticos, de las que el 52% eran para uso humano (ambulatorio y hospitalario), un 33% se destinaba al uso terapéutico en animales, y un 15% eran aditivos de piensos utilizados como promotores del crecimiento (5). Como los antibióticos se eliminan en general antes de que sean metabolizados, se excretan al medio ambiente en cantidades masivas y continúan actuando sobre las bacterias presentes en las aguas fecales, cuyas cepas resistentes pueden pasar a frutas y vegetales y después al hombre y animales. Estas son las razones por las que la Unión Europea ha prohibido el uso de los antibióticos para fomentar el crecimiento de los animales (6), y la FDA y la EMA vienen produciendo periódicamente diversos documentos dirigidos al uso juicioso de los mismos para minimizar la aparición de microorganismos resistentes. Dentro de un ciclo de 5 conferencias organizado por el Instituto de EspaĖa que dicté del 9 al 13 de diciembre de 2002, me referí en dos de ellas a este problema (7).
La Organización Mundial de la Salud (OMS), en un informe presentado en abril del aĖo pasado, advertía de que el problema de la resistencia microbiana es tan grave que pone en peligro los logros de la medicina moderna. Cada vez se producen más infecciones causadas por gérmenes que se han hecho resistentes a los tratamientos habituales, y hoy sabemos que el desarrollo de resistencias para cada nuevo antibacteriano que se introduce en el mercado es sólo cuestión de tiempo. La selección de bacterias resistentes se traduce en un fracaso terapéutico tanto en personas como en animales, y los problemas sanitarios que origina son a veces irreparables. No menos importantes son los cambios que producen los antibióticos no absorbibles y los de amplio espectro administrados oralmente en la flora intestinal. Se considera que en la flora intestinal de la especie humana hay más de 200 especies diferentes de bacterias en un difícil equilibrio, y su modificación puede provocar graves consecuencias de carácter patológico debido a que muchas de estas especies participan en el metabolismo y la producción de distintas sustancias, afectando a la morfología de la mucosa intestinal y al sistema linfoide asociado y constituyendo una defensa contra la implantación de bacterias exógenas que se denomina “efecto barrera”.
Las bacterias resistentes a antibióticos causan buena parte de las 4,1 millones de infecciones hospitalarias que se registran en Europa cada aĖo y alargan las estancias hospitalarias, pudiendo llegar a ocasionar la muerte de hasta la mitad de los infectados en los casos más virulentos (se estima que originan unas 25.000 muertes al aĖo y generan unos costes sanitarios de 1.500 millones de euros). Las infecciones por bacterias resistentes a los antibióticos de último recurso están creciendo también en EspaĖa, según un informe elaborado en 2013 por el Centro Europeo de Control de las Enfermedades (ECDC) tras recabar información en 39 países europeos. Actualmente, la Unión Europea está financiando un proyecto de búsqueda de antibióticos más efectivos con técnicas que combinan la química, la biología y la computación.
3. ANTIBIÓTICOS Β-LACTÁMICOS Y VANCOMICINA. MECANISMOS RESPONSABLES DE SU ACCIÓN Y DE LA APARICIÓN DE RESITENCIAS
Dentro de los antibióticos de origen natural destacan dos importantes mecanismos de acción: la inhibición de la síntesis de la pared bacteriana y la inhibición de la síntesis de proteínas (8). Comentaremos brevemente el primero de estos mecanismos. El péptidoglicano es un componente esencial de la pared bacteriana que determina su rigidez y resistencia frente a las diferencias de presión osmótica. Se trata de un polisacárido en el que se alternan unidos mediante enlaces a-1,4 monómeros de N-acetilglucosamina y ácido N-acetilmurámico, este último enlazado a una cadena pentapeptídica. Este disacárido-péptido se une posteriormente a un transportador lipídico y se trasloca dentro del periplasma bacteriano para que varias enzimas completen su polimerización y se realice la transpeptidación catalizada por enzimas denominadas transpeptidasass. En esta reacción se origina un enlace cruzado entre el resto D-Ala penúltimo del pentapéptido y un aminoácido básico de otra cadena (L-Lys en la Figura 1) con eliminación del residuo D-Ala terminal. Esta malla porosa permite el paso de nutrientes desde el exterior y de enzimas catalíticas y productos de secreción hacia el exterior celular. Muchos antibióticos naturales tienen como diana enzimas o sustratos implicados en su biosíntesis.
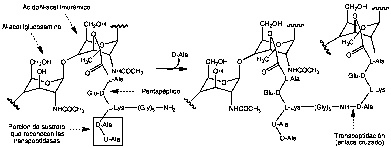
Figura 1. Etapas finales en la biosíntesis del péptidoglicano.
Entre los inhibidores de este proceso biosintético, los más representativos son los antibióticos a-lactámicos y la vancomicina. Los primeros actúan inhibiendo las transpeptidasas, y constituyen un conjunto de productos naturales, semisintéticos o totalmente sintéticos en el que se incluyen las penicilinas, cefalosporinas, carbapenemas y monobactamas. Durante décadas se ha tratado de mejorar su espectro de acción y contrarrestar las resistencias, sobre todo en patógenos Gram positivos como los estafilococos meticilina-resistentes, enterococos ampicilina-resistentes y pneumococos penicilina-resistentes. El ciclo de -lactama, por su semejanza con los residuos D-Ala-D-Ala, actúa como falso sustrato de las transpeptidasas (también llamadas “penicillin binding proteins” o PBPs), y su apertura por ataque nucleófilo de un residuo de serina situado en el sitio activo de éstas origina su inactivación debido a que los derivados de tipo éster así formados se hidrolizan muy lentamente (ver el mecanismo de este proceso para las penicilinas en la Figura 2). Las bacterias se protegen de estos fármacos expresando -lactamasas, unas peptidasas similares a las PBPs que, una vez aciladas, se hidrolizan rápidamente, lo que conduce a que el antibiótico se inactive (9). Esta semejanza explica que sea difícil diseĖar antibióticos -lactámcos poco sensibles a -lactamasas que se enlacen eficazmente a PBPs. Ciertos microorganismos, como Streptococcus pneumoniae, no biosintetizan -lactamasas, pero se hacen resistentes modificando sus PBPs por mutaciones en varios aminoácidos, lo que les confiere menor afinidad por casi todas las -lactamas. S. aureus se hace resistente a meticilina codificando un tipo de PBP de gran peso molecular (PBP2’) con poca afinidad por este antibiótico.
La vancomicina, descubierta en 1955, es un glicopéptido soluble producido por una cepa de Amycolatopsis orientalis (Nocardia orientalis) que desarrolló la empresa Lilly como alternativa terapéutica a la rápida difusión de resistencias a los antibióticos -lactámicos, como ocurre en cepas de S. Aureous resistentes a meticilina (SARM) y en E. faecalis (que produce con frecuencia infecciones en pacientes tratados con diálisis o con quimioterapia). Vancomicina se enlaza mediante cinco enlaces de hidrógeno al extremo D-Ala-D-Ala de la cadena polipeptídica anteriormente mencionada, impidiendo que ésta sea reconocida por las transpeptidasas (Figura 3) (10).
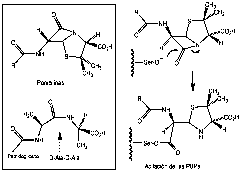
Figura 2. Inactivación de transpeptidasas de péptidoglicano por penicilinas.
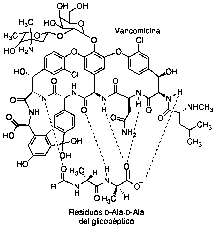
Figura 3. Interacción de vancomicina con la cadena D-Ala-D-Ala del precursor de péptidogicano que reconocen las transpeptidasas.
La aparición en los aĖos 80 de infecciones severas originadas por Staphylococcus aureus resistentes a meticilina (MRSA) y el aumento en el número de pacientes susceptibles de presentar infecciones por microorganismos Gram positivos, convirtieron a la vancomicina en el antibiótico de primera elección para su tratamiento, pero en 1986 se aislaron las primeras cepas de Enterococcus faecium resistentes a vancomicina (VRE) (11) y desde entonces la incidencia de VRE se está extendiendo en el medio hospitalario, sobre todo en casos de inmunodeficiencia por SIDA, quimioterapia y estados postoperatorios.
Las bacterias se hacen resistentes a vancomicina reemplazando la porción D-Ala-D-Ala por D-Ala-D-lactato, de forma que el antibiótico sólo puede enlazarse con 4 enlaces de hidrógeno (no existe el grupo NH del residuo D-Ala terminal). Esta mutación se realiza por activación de los genes que codifican una a-cetorreductasa que convierte el piruvato en D-lactato, así como de una ligasa dependiente de ATP que cataliza la unión de D-lactato a D-alanina. El complejo formado entre la vancomicina y la porción D-Ala-D-lactato es unas 3 veces más débil que el formado con D-Ala-D-Ala, y al romperse fácilmente se pierde la actividad antibacteriana. La resistencia a vancomicina también puede producirse por sobreexpresión de una D-Ala-D-Ala dipeptidasa dependiente de Zn2+ que hidroliza selectivamente este dipéptido, permitiendo que se acumule D-Ala-D-lactato y se incorpore al péptidoglicano.
La oxazolidinona linezolida (Zyvox®) es un antibiótico sintético inhibidor de la síntesis proteica que se comercializó en el aĖo 2000 para tratar VRE (12).
4. DESCUBRIMIENTO DEL NUEVO ANTIBIÓTICO TEIXOBACTINA
Se estima que alrededor del 99% de las especies bacterianas que habitan fuera de los seres vivos son una fuente de antibióticos que no se ha explotado todavía porque estas bacterias no han podido cultivarse, y esta idea ha incentivado el desarrollo de métodos para conseguirlo. Con este objetivo, la compaĖía biotecnológica estadounidense NovoBiotic Pharmaceuticals, desarrolló unas membranas semipermeables para construir cámaras de difusión que restringen el movimiento de las células pero permiten por difusión el libre intercambio con el medio externo de compuestos (13) así como la inclusión de factores de crecimiento naturales, por ejemplo los sideróforos quelantes de hierro, un metal necesario para muchos procesos biológicos de tipo oxidativo (14). Si los cultivos se realizaban en una placa Petri se obtenía un 1% de las células que contiene una muestra de suelo, mientras que el uso de estas membranas semipermeables permite obtener aproximadamente un 50% (15). Tras desarrollar un chip de aislamiento que dispone de varios cientos de cámaras de difusión en miniatura para inocular en cada una de ellas una única célula (isolation chip, ichip) (16), un equipo de investigadores de las universidades de Northeastern y Harvard en Boston encontró el antibiótico peptídico lasomicina, que tiene como diana a la proteasa ClpC1P1P2 dependiente de ATP y posee actividad bactericida frente a todas las formas de M. tuberculosis, incluidas las resistentes (17).
En esta publicación que comentamos, se han unido dos grupos de las universidades de Northeastern y de Bonn para analizar la actividad antimicrobiana frente a Staphylococcus aureus de unas 10.000 cepas de bacterias procedentes de muestras de suelos, observando que el extracto de una nueva proteobacteria denominada de forma provisional Eleftheria térrea, mostraba una buena actividad. La secuenciación de su genoma permitió clasificarla dentro de un nuevo género relacionado con las Aquabacteria, un grupo de microorganismos Gram-negativos de los que hasta el momento no se conocía su capacidad para producir antibióticos. En una fracción parcialmente purificada de sus cultivos se encontró un compuesto con una masa de 1.242 Da que no aparecía en las bases de datos disponibles. Una vez aislado, se determinó su estructura y estereoquímica y se denominó teixobactina. Es un depsipéptido (con estructura mixta de péptido y éster) que contiene cuatro D-aminoácidos, N-metilfenilalanina, y el aminoácido enduracididina (Figura 4) (18).
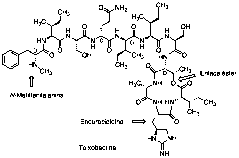
Figura 4. Estructura de teixobactina.
5. ACTIVIDAD BACTERICIDA DE TEIXIBACTINA
Las bacterias Gram negativas, por tener una doble membrana, son impermeables a grandes moléculas y son más difíciles de atacar que las Gram positivas. La teixobactina mostró una excelente actividad frente a varios microorganismos patógenos Gram-positivos, incluidas sus cepas resistentes, y sus dianas son precursores de péptidogicano y de ácidos teicoicos de la pared celular, fácilmente accesibles para el antibiótico.
La concentración mínima inhibitoria (MIC) de teixobactina frente a la mayoría de las especies ensayadas, incluyendo enterococos y M. tuberculosis, fue menor de 1 mg ml-1, siendo excepcionalmente activa frente a Clostridium difficile (causante de diarreas), y Bacillus anthracis (que provoca el ántrax), con MIC de 5 y 20 ng ml-1, respectivamente. Su actividad frente a S. aureus fue superior a la de vancomicina, manteniendo la actividad bactericida frente cepas de resistencia intermedia. Aunque no fue activa frente a bacterias Gram negativas, sí lo fue frente a la cepa asmB1 de E. coli, que carece de la membrana más externa, y no fue tóxica para las células de mamífero NJH/3T3 y HepG2 a 100 mg ml-1, que fue la mayor dosis ensayada. Por otra parte, tras su uso repetido, no se hallaron mutantes de S. aureus o M. tuberculosis.
6. MECANISMO DE ACCIÓN DE TEIXOBACTINA
Pronto se observó que la teixobactina inhibe algún paso en la síntesis de péptidoglicano sin afectar a la síntesis de ADN, ARN o proteínas y, de forma similar a la vancomicina, el tratmiento de S. aureus con teixobactina a dosis entre una a cinco veces superiores a la MIC produjo la acumulación de undecaprenil-N-acetilmurámico pentapéptido. Otros experimentos pusieron de manifiesto que teixobactina no actúa como inhibidor enzimático, sino que interacciona con el grupo pirofosfato y el primer resto de azúcar presentes en precursores poliprenilados de la pared bacteriana. De hecho, originó complejos estables con los lípidos I y II (Figura 5) que pudieron analizarse.
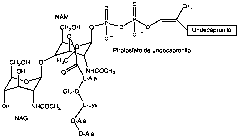
Figura 5. Estructura del lípido II.
También se enlazó eficazmente a undecaprenilpirofosfato de N-acetilglucosamina (lípido III, Figura 6), que es precursor del ácido teicoico de la pared.
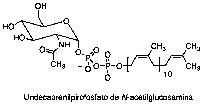
Figura 6. Estructura del lípido III.
Los ácidos teicoicos son grandes polímeros de tipo fosfodiéster formados por ribitol y glicerol fundamentalmente, enlazados covalentemente a través de un grupo fosfato al péptidoglicano (Figuras 7 y 8).
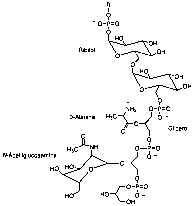
Figura 7. Estructura representativa de un ácido teicoico.
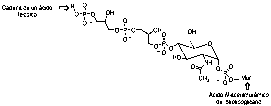
Figura 8. Estructura representativa de un ácido teicoico enlazado a péptidoglicano.
Aunque el ácido teicoico de la pared no es esencial per se para la vida de las bacterias (19), la inhibición de los últimos pasos de su biosíntesis es letal porque produce la acumulación de compuestos tóxicos. Además, dado que los ácido teicoicos se enlazan a autolisinas evitando así la hidrólisis incontrolada del péptidoglicano (20), la inhibición de su biosíntesis provocada por teixobactina puede ayudar a liberar autolisinas y contribuir a la lisis bacteriana. Teixobactina podría enlazarse también a intermedios de la biosíntesis de polisacáridos de la cápsula bacteriana de tipo prenil-PP-azúcar, que son importantes para la virulencia de estafilococos y estreptococos (21).
7. ACTIVIDAD IN VIVO Y EXPECTATIVAS
Los estudios in vivo se ralizaron en un modelo de ratón con septicemia originada por S. aureus resistente a meticilina. Los valores PD50 (dosis protectora a la que sobreviven la mitad de los animales) fue de 0.2 mg/kg, un valor menor que el de vancomicina (2.75 mg/Kg) que, como ya se ha dicho, es el principal antibiótico utilizado para el tratamiento de bacterias MRSA. La teixobactina fue también eficaz en ratones infectados con Streptococcus pneumoniae.
El desarrollo de resistencias frente a teixobactina parece en principio poco probable porque su mecanismo de acción en la pared bacteriana es semejante semejante al de vancomicina, y las bacterias tardaron unos treinta aĖos en desarrollar resistencia frente a ella. El periodo de tiempo antes de la aparición de resistencias podría ser aún mayor en la teixobactina, ya que sus dianas son más variadas.
A pesar de la euforia que ha producido esta noticia y su gran repercusión mediática (22), hay que tener en cuenta que el desarrollo de teixobactina requiere muchos más estudios y ensayos clínicos para evaluar su toxicidad y eficacia en humanos, lo que requerirá en el mejor de los casos que transcurran unos cinco aĖos. Además, como ya se ha mencionado, tiene la limitación de muchos otos antibióticos: no ser activo frente a bacterias Gram negativas.
8 REFERENCIAS
1. Ling LL, Schneider T, Peoples AJ, Spoering AL, Engels I, Conlon BP, Mueller A, Schäberle TF, Hughes DE, Epstein S, Jones M, Lazarides L, Steadman VA, Cohen DR, Felix CR, Fetterman KA, Millett WP, Nitti AG, Zullo AM, Chen Ch, Lewis K. A new antibiotic kills pathogens without detectable resistance. Nature 2015; 517: 455-459.
2. Payne DJ, Gwynn MN, Holmes DJ, Pompliano DL. Drugs for bad bugs: confronting the challenges of antibacterial discovery. Nature Rev Drug Discov 2007; 6: 29-40.
3. Dantes R, Mu Y, Belflower R, Aragon D, Dumyati G, Harrison LH, Lessa FC, Lynfield R, Nadle J, Petit S, Ray SM, Schaffner W, Townes J, Fridkin S. National Burden of Invasive Methicillin-Resistant Staphylococcus aureus Infections United States 2011 JAMA Intern Med 2013; 173: 1970-1978.
4. See for instance: Touchon M, Hoede C, Tenaillon O, Barbe V, Baeriswy S, Bidet Ph, Bingen E, Bonacorsi S, Bouchier Ch, Bouvet O, Calteau A, Chiapello H, Clermont O, Cruveiller S, Danchin A, Diard M, Dossat C, El Karoui M, Frapy E, Garry L, Ghigo J M, Gilles AM, Johnson J, Le Bouguénec Ch, Lescat M, Mangenot S, Martinez-Jéhanne V, Matic I, Nassif X, Oztas S, Petit M A, Pichon Ch, Rouy Z, Saint Ruf C, Schneider D, Tourret J, Vacherie B, Vallenet D, Médigue G, Rocha EPC, Denamur E. Organised Genome Dynamics in the Escherichia coli Species Results in Highly Diverse Adaptive Paths. PLoS Genet 2009; 5: e1000344.
5. Follet G. Antibiotic resistance in the EU-Science politics and policy. AgBioForum 2000; 3: 148-155.
6. Gilbert N. Rules tighten on use of antibiotics on farms. Nature 2012; 481: 125.
7. AvendaĖo C. El poder de la química: cómo se transforma la información a nivel molecular en fármacos innovadores. Madrid: Instituto de EspaĖa 2003.
8. Peláez F, Genilloud O. Nuevos fármacos basados en productos naturales de origen microbiano. In: Nuevos avances en medicamentos. Madrid: Real Academia Nacional de Farmacia 2004; pp. 123-166.
9. Spratt BG. In: Ghuyen JM, Hakeubeck R, Eds. Bacterial Cell Wall. Elsevier 1994; pp. 517-534.
10. Hubbard BK, Walsh ChT. Vancomycin Assembly: Nature's Way Angew. Chem Int Ed 2003; 7: 706-712.
11. Uttley AHC, Collins CH, Naidoo J, George RC. Vancomycin–resistant enterococci. Lancet 1988; 1: 57-58.
12. Chien JW, Kucia ML, Salata RA. Use of linezolid an oxazolidinone in the treatment of multidrug-resistant gram-positive bacterial infections. Clin Infect Dis 2000; 30: 146-151.
13. Bollmann A, Lewis K, Epstein SS. Incubation of Environmental Samples in a Diffusion Chamber Increases the Diversity of Recovered Isolates. Appl Environ Microbiol 2007; 73: 6386-6390.
14. Xiao R, Kisaalite WS. Iron acquisition from transferrin and lactoferrin by P aeruginosa pioverdin. Microbiology 1997; 143: 2509-2515.
15. Nichols D, Lewis K, Orjala J, Mo S, Ortenberg R, O’Connor P, Zhao C, Vouros P, Kaeberlein T, Epstein SS. Short peptide induces an ‘‘uncultivable’’ microorganism to grow in Vitro. Appl Environ Microbiol 2008; 74: 4889-4897.
16. Nichols D, Cahoon N, Trakhtenberg EM, Pham L, Mehta A, Belanger A, Kanigan T, Lewis K, Epstein SS. Use of ichip for high-throughput in situ cultivation of ‘‘uncultivable’’ microbial species. Appl Environ Microbiol 2010; 76: 2445-2450.
17. Gavrish E, Sit CS Cao S, Kandror O, Spoering A, Peoples A, Ling L, Fetterman A, Hughes D, Bissell A, Torrey H, Acopian T, Mueller A, Epstein S, Goldberg A, Clardy J, Lewis K. Lassomycin a ribosomally synthesized cyclic peptide kills mycobacterium tuberculosis by targeting the ATP-dependent protease ClpC1P1P2. Chem Biol 2014; 21: 509-518.
18. a) Bhushan R, Brückner H. Marfey's reagent for chiral amino acid analysis: a review. Amino Acids 2004; 27: 231-247. b) Bhushan R, Brückner H. Use of Marfey's reagent and analogs for chiral amino acid analysis: Assessment and applications to natural products and biological systems. J Cromatog 2011; 29: 3148-3161.
19. D’Elia MA, Pereira MP, Chung YS, Zhao W, Chau A, Kenney TJ, Sulavik MC, Black TA, Brown ED. Lesions in teichoic acid biosynthesis in Staphylococcus aureus lead to a lethal gain of function in the otherwise dispensable pathway. J Bacteriol 2006; 188: 4183-4189.
20. Bierbaum G, Sahl HG. Induction of autolysis of staphylococci by the basic peptide antibiotics Pep 5 and nisin and their influence on the activity of autolytic enzymes. Arch Microbiol 1985; 141: 249-254.
21. a) O’Riordan K, Lee JC. Staphylococcus aureus capsular polysaccharides. Clin Microbiol Rev 2004; 17: 218-234. b) Xayarath B, Yother J. Mutations blocking side chain assembly polymerization or transport of a Wzy-dependent Streptococcus pneumoniae capsule are lethal in the absence of suppressor mutations and can affect polymer transfer to the cell Wall. J Bacteriol 2007; 189: 3369-3381.
22. Ver por ejemplo: a) First new antibiotic in 30 years discovered in major breakthrough The Thelegraph 7 de enero de 2015 b) El primero de una nueva clase de antibióticos ABCsalud 7 de enero de 2015 c) Un nuevo y potente antibiótico 7 de enero de 2015 d) Gallagher J BBC 7 de enero de 2015 Grady D Antibiotics: US discovery labelled 'game-changer' for medicinehttp://www.nytimes.com/2015/01/08/health/from-a-pile-of-dirt-hope-for-a-powerful-new-antibiotic.html http://wwwnytimescom The New York Times 7 de enero de 2015.