
New concepts on the functionality of the nervous system: the revolution of the glial cells. I. The neuro-glial relationships
Title in Spanish: Nuevos conceptos sobre la funcionalidad del sistema nervioso: la revolución de las células gliales. I. Las relaciones neuro-gliales
Adolfo Toledano1,2, María-Isabel Álvarez1, Adolfo Toledano-Díaz3
1Instituto Cajal, CSIC Madrid. 2Académico correspondiente RANF. 3Departamento Reproducción, INIA, Madrid Madrid, Spain
*Corresponding Author: atoledano@cajal.csic.es An Real Acad Farm Vol. 81, Nľ 1 (2015), pp. 11-18
Received: January 28, 2015 Accepted: February 24, 2015 Language of Manuscript: Spanish
![]()
1. LA REVOLUCIÓN DE LAS CÉLULAS GLIALES
Los resultados de los estudios llevados a cabo en los últimos aĖos sobre las células gliales han revolucionado los conceptos sobre la funcionalidad del SNC (1). Dos han sido los aspectos que más han atraído la atención, la total implicación de las células gliales en todos los procesos del Sistema Nervioso (SN) que hasta ahora se creían de exclusiva competencia de las neuronas (cuyo ejemplo más relevante es la neurotransmisión) (2-14) y su grande y complejo protagonismo en las patologías más específicas del SN (especialmente las neurodegenerativas) (15-23).
Se puede decir que uno de los aspectos más sobresaliente y llamativo de estas células es que ya participan, con pleno derecho y en lugar prominente, en el enunciado de todas las teorías que se han propuesto para explicar cualquier aspecto o faceta, fisiológico o patológico, de la función del SNC. Sabíamos, desde el principio (no olvidemos que Cajal llega a definir la “teoría neuronal” partiendo del estudio de animales en desarrollo), que estás células están presentes en el desarrollo embrionario y la modelación de la citoarquitectonia de cada región del SNC. Luego fuimos aprendiendo que no sólo la astroglía y la oligodendroglía era un soporte mecánico y protector sino que también eran cooperadores metabólicos y mantenedores de la homeostasis del SN, que es fundamental para el correcto funcionamiento del componente neuronal. En los últimos aĖos se ido comprobando como las células gliales se comunican con las neuronas, y éstas con las células gliales, para regularse mutuamente en sus funciones y hacer que las respuestas globales de los circuitos neuronales sean las más adecuadas (Figura 1). Así, se ha ampliado la participación de cada una de las familias gliales (astroglía, oligodendroglía y microglía) a prácticamente todas las funciones neuronales, de forma que, actualmente, hay que considerar que en todos los procesos neuronales, tanto sencillos como complejos, desde un reflejo monosináptico hasta la más sofisticada de las funciones superiores cognoscitivas, están operando diversas células gliales.
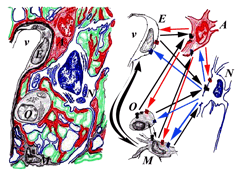
Figura 1. Elementos celulares en el SN y sus relaciones. En la parte derecha, se ha esquematizado la imagen que se observa del SN a nivel de la microscopía electrónica: neuronas (N, en azul), astrocitos (A, en rojo), oligodendrocitos (U, en negro) y células de microglia (M, en negro). Las prolongaciones de estas células forman el neuropilo, donde establecen sinapsis axones con dendritas de diferentes neuronas. En las sinapsis se produce la comunicación celular entre las neuronas, la neurotransmisión, que es la que caracteriza al SN y la base de su funcionalidad. Las prolongaciones de las células gliales envuelven los somas y las prolongaciones neuronales. En la parte izquierda del esquema se han representado las diferentes células (neuronas, células neurogliales y células endoteliales -E) para seĖalar que, aparte de la neurotransmisión, existen multitud de procesos de comunicación celular entre todas estas células para que funcionen de una manera coordinada y produzcan las respuestas globales óptimas del SN ante cualquier cambio fisiológico o patológico. Los elementos clave en este proceso son mensajeros (inter)celulares (quimioquinas, citoquinas y otros péptidos; NO, eicosanoides, prostaglandinas, radicales libres, etc) y sus respectivos receptores.
Hasta hace pocos aĖos, la neurotransmisión a nivel de las sinapsis, es decir, el fenómeno característico de comunicación entre las neuronas, era la base sobre la que se asentaba el funcionamiento del SN, y se consideraba que las células gliales no intervenían de manera directa aunque sí cooperaban en muchos procesos neuronales relacionados. Sin embargo, en la actualidad, no sólo se reconoce que existe una directa implicación de la glía para caracterizar la forma y manera en la que se produce la neurotransmisión entre neuronas, sino que, incluso, ciertas células gliales producen y liberan verdaderos transmisores (“gliotransmisores”) operativos en sinapsis “glio-neuronales” y “glio-gliales” similares a las neuro-neuronales clásicas (Figuras 2 y 3). Se han identificado gliotransmisores excitadores (glutamato, ATP, serina, eicosanoides y proteínas) y también gliotransmisores inhibidores (péptidos y adenosina) (1,8,9,14,22-24). Aunque todavía queda mucho por investigar, y algunos autores ponen en duda estos cambios trascendentes para comprender la funcionalidad del SN (25), ya se comienza a substituir el concepto de “redes neuronales” como base de las funciones cerebrales por el de “redes neuro-gliales” (26,27).
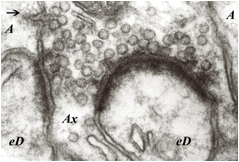
Figura 2. Imagen de sinapsis y gliotransmisión. Cerebelo de rata. Capa molecular. Terminal de fibra paralela (Ax) que hace sinapsis sobre dos espinas dendríticas de célula de Purkinje (eD). Se aprecian las estructuras características (vesículas sinápticas del axón, membranas pre- y post-sinápticas y “cepillo” postsináptico). El conjunto sináptico está envuelto por láminas astrocitarias (A) que también presentan algunas estructuras vesiculares similares a las vesículas sinápticas del axón terminal (Ax) e imágenes de exocitosis (→), todo ello sugerente de “gliotransmisión” sobre las dendritas y/o axón. X50.000
La interrelación entre mecanismos y procesos neuronales y gliales es tan estrecha que los procesos plásticos y adaptativos que acaecen en las neuronas para optimizar sus respuestas fisiológicas o hacer frente a cambios patológicos, automáticamente tienen un correlato de cambios plásticos y adaptativos en las células gliales. Así pues, estas células tienen una elevada capacidad de modificarse, morfológica y funcionalmente, (“glioplasticidad” o “plasticidad glial” - “glial plasticity” o “glioplasticity”) al igual que las neuronas (neuroplasticidad” - “neuroplasticity”) (3-16). Muchas veces es difícil precisar quién es el inductor de los cambios plásticos neuro-gliales para el cumplimiento de una función del SN. Astrocitos, oligodendrocitos y células microgliales modelan neuronas, sinapsis y circuitos de manera directa; pero también el componente neuronal modifica las propiedades y funciones de las células gliales. Y esto ocurre también en la involución del SNC (tanto en la senilidad fisiológica como en la patológica/enfermedad de Alzheimer y en todas las situaciones patológicas de cualquier etiología (trauma, enfermedades tóxicas e infecciosas, enfermedades neurodegenerativas no Alzheimer, etc).
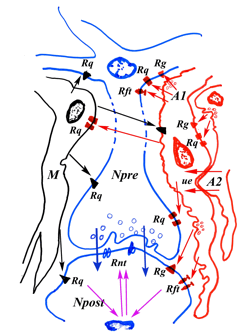
Figura 3. Esquema sobre la integración de diversos sistemas de comunicación celular glio-neuronal y la gliotransmisión en la neurotransmisión. Dos neuronas, una presináptica (Npre) y otra postsináptica (Npost) establecen una comunicación neurotransmisora sináptica mediatizada por neurotrnasmisores (flechas azules) liberadas por vesículas sinápticas en la mayoría de las casos y que actúan sobre receptores específicos de la membrana psotsináptica (Rnt). La sinapsis está envuelta por prolongaciones gliales de astrocitos (A) y células de microglia (M) que liberan mensajes de comunicación celular que producen cambios en la neurona presináptica (en el soma o sobre el propio botón sináptico) y en la postsinápica, tras activar receptores específicos (Rq). Estos receptores producen cambios en estas neuronas al activar las vías intracelulares de segundos mensajeros (o vías de seĖalamiento celular) de modo que la respuesta neurotransmisora sináptica queda modulada por cambios citoquímicos a nivel sináptico. Actualmente, se ha puesto de manifiesto que también las células gliales, especialmente los astrocitos, son capaces de producir “gliotransmisores” que tras ser liberados activan zonas neuronales sinápticos con receptores específicos (Rq) produciendo activación o inhibición de las membranas neuronales. Por los canales de las uniones estrechas de los astrocitos (ue; “gap junctions”) también pasan moléculas entre los astrocitos que llegan a liberarse cerca de los receptores neuronales para afectar la neurotransmisión. Un sistema de modulación de características especiales parece ser el mediatizado por factores neurotróficos que activan receptores para neurotrofinas (Rft). Las vías de seĖalización intracelular para factores neurotróficos incluyen activación de genes nucleares, lo mismo que muchas vías intracelulares para cito/quimioquinas).
Simultáneamente, en estas situaciones de lesión, involución, degeneración o reparación del SN se producen cambios gliales muy profundos en todos los tipos gliales (“gliosis”) que tienen grandes repercusiones en la estructura funcional del SN (16-22) (estos cambios serán tratados en la segunda parte de este comentario). Estos cambios tienen una muy diferente significación, desde la neuroprotección a la neurotoxicidad y pueden ser base para el diagnóstico o el tratamiento de las enfermedades del SN, especialmente aquellas que todavía no tienen tratamiento, como las enfermedades neurodegenerativas. El problema surge cuando no podemos distinguir los cambios adaptativos (neuroprotectores) de las alteraciones “glioinvolutivas”/”gliodegenerativas” (neurotóxicas) (28).
Nuestros conocimientos sobre la patogenia de la EA y enfermedades neurodegenerativas asociadas han aumentado, en gran manera, cuando se han ido incorporando los resultados de las investigaciones sobre los cambios producidos en los elementos de las tres familias de células gliales (16-22,28). En el enunciado de las teorías o en la descripción de las cascadas patogénicas que intentan explicar la EA figuran, de manera sistemática, astrocitos, oligodendrocitos y células de microglia, así como las sustancias normales o patológicas que fabrican y segregan (factores de crecimiento, citoquinas, quimioquinas, radicales libres, óxido nítrico, etc). Sin embargo, todavía nuestros conocimientos no son lo suficientemente pormenorizados como para definir dianas terapéuticas gliales para diferentes fases de este proceso.
2. LAS CÉLULAS GLIALES. LAS FAMILIAS, TIPOS Y SUBTIPOS MORFOFUNCIONALES DE LA NEUROGLIA
El primitivo concepto de “neuroglia” (“cemento nervioso” de Wirchow, 1858, (29)) se refería especialmente a una especie de sustancia o tejido conectivo cerebral en el que se apreciaban corpúsculos, núcleos y un cierto número de células. Los estudios posteriores, entre los que destacan los de los neurohistólogos espaĖoles (30-38), hicieron que se definiera la “neuroglia” como un complejo conjunto de tipos celulares, agrupados en tres distintas familias, que acompaĖaban a las neuronas y que no comprendía ningún tipo de sustancia intersticial. Simultáneamente, y con la excepción del último componente celular diferenciado, la microglia, la sensación de que la “neuroglia” derivaba del mesodermo como otros tejidos conectivos se esfumaba y daba paso a la teoría neuroepitelial.
La primera familia, que actualmente denominamos astroglia (y a sus elementos, astrocitos) comprende diferentes subtipos, tanto descritos bien de manera general en todo el SNC (astrocitos protoplasmáticos de la sustancia gris y astrocitos fibrosos de la substancia blanca), bien de forma restrictiva situados en zonas muy concretas del SNC (las células de Müller en la retina, las células epiteliales de Golgi que dan origen a las fibras de Bergmam) y las células de la glia radial, probable origen de muchos tipos estrellados. La segunda y tercera familia de células gliales nacen emparentadas tras los trabajo de Pio del Rio Hortega (36-38) (“El tercer elemento” después de las neuronas (“primer elemento”) y de las “células (astro-)gliales”- Cajal (33) y del Río-Hortega (36)). Los estudios más pormenorizados sobre estas nuevas células gliales concluyeron en la definición de dos nuevas familias: la oligodendioglia, de origen neuroepitelial, con elementos celulares de gran tamaĖo (junto a la astroglia cofiguran la macroglia) y relacionados especialmente con la mielinización, y la microglia, de origen mesodérmico, formada por elementos pequeĖos de diferentes morfologías.
Cada una de las tres familias de células neurogliales incluye diferentes tipos celulares con características bien definidas en algunos casos pero no en otros. Los criterios que se utilizan en la tipificación son variados: morfológicos, funcionales o morfofuncionales. Las primeras clasificaciones de las células gliales se basaban en la morfología de las células tras tinciones “específicas” (especialmente impregnaciones metálicas). Posteriormente, con la llegada de la inmunocitoquímica se pudo precisar mejor las diferentes tipos y subtipos de cada familia aunque se perdiera la caracterización morfológica precisa.

Figura 4. Esquema sobre los tipos morfológicos de astroglía y sus posibles relaciones. De manera general, en el mamífero adulto, se puede considerar que existen dos tipos principales: a) células con una larga prolongación, o un corto número deellas en paralelo, que, en principio, se dirigen hacia la piamadre y se ponen en contacto con ella, y b) células estrelladas con gran número de prolongaciones cortas, y algunas largas, que se ponen en contacto con los vasos sanguíneos. En el primer grupo se incluyen los tanicitos(1) (células similares a las células primitivas ependimarias radiales que dan origen a neuronas y células gliales, y que están restringidas, en mamíferos adultos, a zonas del SNC de escaso espesor, como los órganos periventriculares); las células radiales del hipocampo (2, 3) ylas “células epiteliales de Golgi” del cerebelo (o “células productoras de las fibras de Bergmann -mal llamada “glia de Bergmann”) (5), que forman empalizadas de fibras ascendentes hacia la piamadre; y los astrocitos marginales (4) de las primeras capas de las cortezas cerebrales, que poseen fibras radiales muy cortas hacia la pia y otras prolongaciones hacia el interior de las capas corticales. En el segundo grupo de las células estrelladas (o de forma de araĖa) se encuentran los dos tipos más frecuentes, los astrocitos protoplasmáticos de la substancia gris (6) (con prolongaciones muy ramificadas que cubren amplias áreas, especialmente en los humanos, creando “microdominios” sinápticos neuronales) y los astrocitos fibrosostípicos de la sustancia blanca (9) (con prolongaciones largas y poco ramificadas). Existen en la substancia gris elementos transicionales mixtos (7) así como astrocitos velamentosos(8) con láminas no fibrilares recubriendo las neuronas o sus prolongaciones. Cada región del SN posee una especial astroglioarquitectonia. También existen células germinales o astroblastos, generalmente periventriculares, que pueden dar lugar a nuevos astrocitos en la edad adulta y células de un nuevo tipo descrito, NGR2+ (con características de astrocito y oligodendrocito), e incluso, neuronas o células de estirpe oligodendroglial. Las flechas seĖalan las posibles relaciones evolutivas entre los distintos elemento. Mediante técnicas inmunocitoquímicas, se diferencian dentro de muchos subtipos morfológicos diversos subconjuntos con fenotipos característicos.
2.1. Astroglia.
Comprende el mayor número de tipos y elementos celulares (Figuras 4 y 5). Morfológicamente los astrocitos son muy variados en tamaĖo y forma, y muchos de los tipos son muy específicos de concretas regiones del SNC. Inmunocitoquímicamente, se ha querido identificar el astrocito como célula que contiene proteína fibrilar acidófila (GFAP), específica de las gliofibrillas, pero existen subtipos que no expresan o acumulan esta proteína (28). Además, existen diversas isoformas de GFAP con funcionalidad distinta (39). Un tipo morfológico de “astrocito” que no expresa GFAP pero que tiene algunas otras características astrocitarias (40) y que tiene expresión de NGD chondriotin-sulfato proteoglicano (41), es la célula glial NG2+. Parece ser un tipo bien definido que pudiera establecer un nexo con la otra familia de la macroglía, la oligodendroglia, pues es capaz de actuar como pro-oligodendrocito así como dar lugar a neuronas.
En el desarrollo prenatal sus células están implicadas en la neurogénesis y la migración de neuroblastos/neuronas para constituir las capas o zonas de las diversas regiones del SNC y en la conducción de axones para establecer los circuitos neuronales. En el desarrollo postnatal, se ocupan de la configuración de áreas específicas de contacto sináptico (“microdominios”, “compartimentos” o “territorios gliales”) tutelados por una o varias células astrocitarias. Los astrocitos humanos son mucho más complejos que los que existen en otros mamíferos, y los “dominios” comprenden un número mucho más elevado de sinapsis (43). En el adulto, la modulación de la neurotransmisión y la gliotransmisión, tal como se ha dicho, son cruciales en la funcionalidad de los circuitos neuronales. El óptimo funcionamiento de las neuronas y de sus contactos neuronales, que son la clave para que los circuitos nerviosos cumplan su cometido durante toda la vida del ser, se asienta en gran medida sobre dos pilares, la estrecha relación/cooperación astroglio-neuronal y la interrelación de los cambios adaptativos neuronales y gliales.
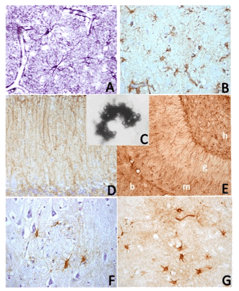
Figura 5. Diferentes tipos de células astrocitarias. A) Células astrocitarias protoplasmáticas estrelladas, normales e hipertróficas, de la capa V de la corteza cerebral frontal humana senil normal, delimitando “microdominios” en los que existen diverso número de neuronas (espacios circulares en blanco). Muchos de las prolongaciones finalizan sobre los vasos formando los “pies chupadores”. Inmunotinción con anti-Proteina Fibrilar Acidófila intensificada con níquel para mostrar las finas ramificaciones de las prolongaciones gliales principales. B) Células astrogliales estrelladas hipertróficas presentes en la corteza cerebral de un enfermo de Alzheimer. Se observan como elementos astrogliales estrellados hipertróficos que parecen rodear una estructura anómala no teĖida (depósitos de amiloide difuso) o se sitúan entre las neuronas de la capa V. Inmunotinción con anti-Proteina Fibrilar Acidófila contrastada con hematoxilina. C) Astrocito velamentoso cuya prolongaciones laminares rodean células grano de la capa granular cerebelosa humana. Impregnación metálica (variante de Golgi) D) Fibras de Bergmann, prolongaciones de la glía epitelial de Golgi situada en la capa de Purkinje de la corteza cerebelosa. Inmunotinción con anti-Proteina Fibrilar Acidófila contrastada con hematoxilina. E) Diferentes tipos de astroglía radial en la capa granular (g) y molecular (m) del girus dentatus del hipocampo, y de astrocitos estrellados en el hilus/C4 (h) y cuerpo calloso (b). Inmunotinción con anti-Proteina Fibrilar Acidófila sin contraste. F-G) Células astrogliales que rodean una placa amiloide en CA3 del hipocampo (F) y en capa V de la corteza cerebral (G), de un enfermo de Alzheimer. Los astrocitos hipertróficos rodean las placas, como si quisieran formar una cicatriz glial, y sus prolongaciones penetran en ellas, aunque en G se observa que algunas formaciones amiloideas no tienen esta relación de los elementos gliales con los acúmulos neuropatológicos. Inmunotinción con anti-Proteina Fibrilar Acidófila con contraste con hematoxilina (F) y sin contraste (G). Ampliación 250x.
Esta estrecha relación neuro-astroglial es súmamente compleja y comprende múltiples procesos de comunicación celular neuro-gliales, glio-neuronales, neuro-neuronales y glio-gliales, no neurotransmisores y neurotransmisores, en los que participan gran número de substancias muy diversas (neurotransmisores, neurotrofinas quimioquinas, citoquinas, NO, prostaglandinas, iones, radicales libres, etc, así como están implicadas todas las vías intracelulares de segundos mensajeros) (Figuras 1-3) (44). Además de las interrelaciones de las neuronas con sus astrocitos acompaĖantes, la conexión entre astrocitos mediante las “uniones estrechas” (“gap junctions”) y sus relaciones con los vasos mediante los pies vasculares, permiten establecer unidades metabólicas y funcionales neuro-glio-vaculares bien definidas en muchas regiones del SN (26). Algunos autores han descrito un “sistema glinfático” (“glymphatic system”) (45) basado en la astroglía, que haría las veces del sistema linfático en el resto de tejidos que poseen componente conjuntivo, en donde la captación de substancias del espacio intercelular del neuropilo mediatizada por aquaporinas, su flujo a través de las gap junctions y su eliminación por los pies vasculares serviría de sistema de depuración de substancias tóxicas del cerebro como el amiloide. En la adaptación de las conexiones neuronales y en los fenómenos de neuroplasticidad, es fundamental la glioplasticidad de los elementos astrocitarios para optimizar las respuestas tanto a las fluctuaciones normales del medio interno como a las seĖales que provienen de fuera del cerebro. En situaciones más complejas, como agresiones traumáticas o toxoinfeccionsas, procesos involutivos seniles o enfermedades neurodegenerativas, las células astrocitarias sufren cambios mucho más profundos (astrogliosis) que se manifiestan histológica e histoquímicamente de manera más llamativa.
2.2. Oligodendroglia
Puede ser definida esta familia glial, como la glía encargada de producir las envolturas mielínicas de los axones del SNC. Sin embargo, también se incluyen tipos de células que no producen mielina y que tienen diferentes funciones neurometabólicas o de otro tipo (por ejemplo, como precursores gliales). Desde los primeros trabajos de Rio-Hortega (36-38) las células mielinizantes fueron subdivididas en cuatro subtipos I-IV con los criterios relacionados con el número de axones que se envuelven y el grosor de los mismos. Actualmente se consideran solo dos tipos I-II y III-IV que envuelven, respectivamente, muchos finos axones o pocos axones de gran diámetro. Sólo algunos subtipos mielinizantes han podido ser identificados específicamente con anticuerpos.
2.3. Microglía
La tercera familia glial difiere grandemente de las dos anteriores por su procedencia mesodérmica (36-38). La similitud de comportamiento de las células de microglía con algunas de las células que intervienen en los procesos inmunitarios y la inflamación en los tejidos periféricos que poseen componentes celulares mesodérmicos, así como la utilización de macromoléculas (citoquinas y quimioquinas, y sus receptores) claves en estos procesos, han llevado a la microglia al pimer plano de los estudios neuropatológicos y neurodegenerativos. Se ha definido, un proceso degenerativo denominado “neuroinflamación” donde la pieza angular es la célula de microglía (46,47).
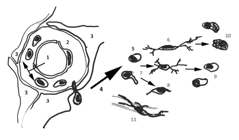
Figura 6. Esquema sobre los tipos morfológicos de microglía y sus posibles relaciones. En el parénquima nervioso existen tipos morfológicos diferentes, desde formas alargadas con prolongaciones más o menos ramificadas (6) hasta formas redondeadas con muy escasas prolongaciones (5, 7, 9, 10). Ha sido muy discutida la identidad o diferencia entre los monocitos/macrófagos que se encuentran en otros tejidos y fuera del parénquima del SN (2) y las células de microglía del parénquima (siendo la frontera la glia limitans perivascular o pial de carácter astrocitario -3), tanto las formas ramificadas como redondeadas. En la actualidad se considera que en las primeras fases del desarrollo embrionario, macrófagos procedentes del saco embrionario colonizan el SNC, pasando de la luz vascular (1) a los espacios de Virchow-Robin (2) y de allí al parénquima nervioso (4, 5), diferenciándose en células de microglía adultas, generalmente con muchas ramificaciones (6), aunque algunas de ellas mantienen formas más redondeadas (7, 8) que se extienden por el parénquima o bien quedándose adosados a los vasos sanguíneos (11). Algunos elementos ramificados, al activarse ante cambios del medio ambiente, cambian a formas redondeadas sin prolongaciones, que son especialmente células fagocitarias (9, 10). También permanecen durante toda la vida formas blásticas que se dividen en las situaciones patológicas en que existe microgliosis. Todos estos tipos se consideran la “microglía residente” ya que en circunstancias patológicas, nuevos monocitos/macrófagos generados en la médula ósea dan lugar a una nueva “microglía invasora”. Inmunocitoquímicamente se diferencian muchos subtipos/subconjuntos con fenotipos característicos.
Desde su descripción inicial se consideran dos tipos morfológicos básicos de microglía a) células pequeĖas con prolongaciones cortas y ramificadas y b) células redondeadas sin prolongaciones (Figuras 6 y 7). Ambas se sitúan en neuropilo o bordeando los vasos sanguíneos. De alguna manera se consideraba que ambos tipos de elementos estaban relacionados y que eran diferentes estados funcionales, así como que existía una transición de la microglía residente, generalmente con prolongaciones, a la activada sin prolongaciones. Al ME distinguen 2 subtipos: a) productor de amiloide b) fagocitico (48). Los cambios plásticos y reactivos de las células de microglia se acompaĖan casi siempre con cambios en la expresión génica, de manera que pueden diferenciarse muchos fenotipos con características morfológicas, inmunoreactividad general y patrones específicos de depósitos intracelulares empleando diversos sistemas de inmunotinción de distintas proteínas mesodérmicas (CD45; CD68; Iba1, LN3; etc) (49,50). Asimismo, la caracterización de los subconjuntos de células de microglía según las citoquinas/quimioquinas que poseen o los receptores para estas sustancias que existen en sus membranas, es una herramienta de gran utilidad para el estudio del papel de la microglia.
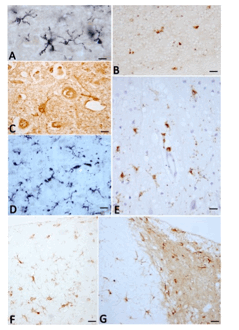
Figura 7. Diferentes tipos de células de microglía. Las células de microglía presentan diferentes morfologías según las diferentes técnicas de impregnación metálica o de inmunotinción que se emplean. Ello se debe a que muchas de las substancias que las tiĖen solo detectan algunos subtipos funcionales, normales o hipertróficos, y también a que las substancias inmunorreactivas tienen localizaciones precisas en el cuerpo o en las prolongaciones. La mayoría de las técnicas inmunocitoquímicas tienden a detectar substancias antigénicas solo encontradas en células de estirpe mesodérmica. A) Células microgliales con prolongaciones ramificadas inmunoteĖidas con LN3 (anticuerpo contra el antígeno mayor histocompatibilidad) en la corteza cerebral humana, capa V. B) Células microgliales redondeadas pequeĖas infiltradas entre las células grano de la corteza cerebelosa humana inmunoteĖidas con CD45 (glicoproteína de los leucocitos). C) Células microgliales hipertróficas con prolongaciones o del tipo redondeado sin prolongaciones inmunoteĖidas con lectina de tomate, en corteza cerebral humana. D) células fusiformes con finas prolongaciones en la corteza cerebral humana inmunoteĖidas con CD68 (glicoproteína conocida como macrosialina, sialomucina de células mesodérmicas) e intensificado con níquel. E) Células microgliales hipertróficas con grandes prolongaciones ramificadas detectable por la acumulación de granos de proteína CD45 en corteza cerebral humana. F-G) Células de microglía con prolongaciones ramificadas, algunas de las cuales asemejan astrocitos radiados en la corteza cerebral (capa I-III) (F) y capa molecular de la región del girus dentatus del hipocampo (G), inmunoteĖidas con Iba-1 (proteína inflamatoria AIF-1). A-C: cerebro humano de un caso de Alzheimer. D-E: cerebro humano de un caso de Creuztfeldt-Jakob. F-G: cerebro de mono (Macaca fascilularis) de 36 aĖos de edad. Barras: A y E=30Ķm; B=20Ķm; C= 12Ķm; C, F y G= 60 Ķm.
3. LA PLASTICIDAD GLIAL Y LA ACTIVACIÓN O RESPUESTA GLIAL
Vivir supone responder adecuadamente a las circunstancias normales y anormales del medio ambiente externo e interno. Los circuitos neuronales encargados de promover y dirigir las respuestas del organismo deben adaptarse continuamente para optimizar estas respuestas. Las neuronas que integran estos circuitos deben realizar cambios morfológicos y funcionales para adaptarse. Podemos considerar que las neuronas son las células que poseen la mayor capacidad adaptativa de las células de los organismos. Sin embargo, muchos de los cambios, por no decir todos, que tienen lugar no sólo implican modificaciones neuronales (neuroplasticidad) sino que también implican modificaciones de los elementos de las tres familias gliales acompaĖantes (glioplasticidad). En muchas ocasiones no podremos decir si el promotor del cambio es un elemento neuronal o un elemento glial, pero si se observa que las modificaciones neuronales y gliales corren en paralelo. Una falta de adaptación glial o un exceso en la respuesta adaptativa puede generar una situación patológica. Un claro ejemplo de acoplamiento de neuroplasticidad-glioplasticidad lo tenemos en los cambios que ocurren a nivel sináptico en circuitos que realizan funciones cognitivas. Las envolturas astrogliales perisinápticas cambian de tamaĖo y forma alrededor de los complejos sinápticos al tiempo que neurotrofinas producidas por estas células y macromoléculas relacionadas con la neurotransmisión intervienen en la regulación de la transmisión sináptica a este nivel. Pero no sólo estos elementos gliales son las que cooperan en la adaptación, sino que también las células de microglia.
Como se dijo, en situaciones anormales, con grandes cambios del medio interno o externo en los que se requieren cambios adaptativos más importantes, las modificaciones de las células gliales se hacen mucho más notorias (“gliosis”). Estos cambios se analizan en la segunda parte.
4. REFERENCIAS
1. Volterra A, Meldolesi J. Astrocytes, from brain glue to communication elements: the revolution continues. Nat Rev Neurosci 2005; 6:626-40.
2. Nedergaard M, Ransom B, Goldman SA. New roles for astrocytes: redefining the functional architecture of the brain. Trends Neurosci 2003; 26:523-30.
3. Vernadakis A. Glia-neuron intercommunications and synaptic plasticity. ProgNeurobiol 1996; 49:185-214.
4. Viola GG, Rodrigues L, Américo JC, et al. Morphological changes in hippocampal astrocytes induced by environmental enrichment in mice. Brain Res 2009; 1274:47-54.
5. Ota Y, Zanetti AT, Hallock RM. The role of astrocytes in the regulation of synaptic plasticity and memory formation. Neural Plast 2013, Article 2013:185463 doi: 10.1155/2013/185463.
6. Allaman I, Belanger M, Magistretti PJ. Astrocyte-neuron metabolic relationships:for better and for worse. Trends Neurosci 34(2):76–87 (2011).
7. Nagelhus EA, Amiry-Moghaddam M, Bergersen LH, Bjaalie JG, Eriksson J, Gundersen V, et al. The glia doctrine: addressing the role of glial cells in healthy brain ageing. Mech Ageing Dev 2013; 134:449-59.
8. Perez-Alvarez A, Navarrete M, Covelo A, et al. Structural and functional plasticity of astrocyte processes and dendritic spine interactions. J Neurosci 2014; 34:12738-44.
9. Araque A, Carmignoto G, Haydon PG, et al. Gliotransmitters travel in time and space. Neuron 2014; 81:728-39.
10. Stuchlik A. Dynamic learning and memory, synaptic plasticity and neurogenesis: an update. Front Behav Neurosci. 2014 8:106. doi: 10.3389/ fnbeh.2014.00106. eCollection.
11. Xavier AL, Menezes JR, Goldman SA, et al. Fine-tuning the central nervous system: microglial modelling of cells and synapses. Philos Trans R SocLond B BiolSci 2014; 369(1654).
12. Salter MW, Beggs S. Sublime microglia: expanding roles for the guardians of the CNS. Cell 2014; 158:15-24.
13. Tremblay Mť, Stevens B, Sierra A, et al. The role of microglia in the healthy brain. J Neurosci 2011; 31:16064-69.
14. Morris GP, Clark IA, Zinn R, et al. Microglia: a new frontier for synaptic plasticity, learning and memory, and neurodegenerative disease research. Neurobiol Learn Mem 2013; 105:40-53.
15. Papa M, De Luca C, Petta F, et al. Astrocyte-neuron interplay in maladaptive plasticity. NeurosciBiobehav Rev 2014; 42:35-54.
16. Benarroch EE. Microglia: Multiple roles in surveillance, circuit shaping, and response to injury. Neurology 2013; 81:1079-88.
17. Parpura V, Heneka MT, Montana V, et al. Glial cells in (patho)physiology. J Neurochem 2012; 121:4-27.
18. Mosher KI, Wyss-Coray T. Microglial dysfunction in brain aging and Alzheimer's disease. Biochem Pharmacol 2014; 88(4):594-604.
19. Rodríguez JJ, Olabarria M, Chvatal A, et al. Astroglia in dementia and Alzheimer's disease. Cell Death Differ 2009; 16(3):378-85.
20. Verkhratsky A, Rodríguez JJ, Parpura V. Astroglia in neurological diseases. Future Neurol 2013; 8:149-58.
21. Verkhratsky A, Marutle A, Rodríguez-Arellano JJ, et al. Glial Asthenia and Functional Paralysis: A New Perspective on Neurodegeneration and Alzheimer's Disease. Neuroscientist 2014. pii: 1073858414547132.
22. Mitew S, Kirkcaldie MT, Dickson TC, et al. Altered synapses and gliotransmission in Alzheimer's disease and AD model mice.Neurobiol Aging 2013; 34:2341-51.
23. Martineau M. Gliotransmission: focus on exocytotic release of L-glutamate and D-serine from astrocytes. Biochem Soc Trans 2013; 41:1557-61.
24. Martineau M, Shi T, Puyal J, et al. Storage and uptake of D-serine into astrocyticsynaptic-like vesicles specify gliotransmission. J Neurosci 2013; 33:3413-3423.
25. Sloan SA, Barres BA. Looks can be deceiving: reconsidering the evidence for gliotransmission. Neuron 2014; 84:1112-15.
26.Agnati LF, Cortelli P, Pettersson R, et al. The concept of trophic units in the central nervous system. Prog Neurobiol 1995; 46:561-74.
27. Perea G, Sur M, Araque A. Neuron-glia networks: integral gear of brainfunction. Front Cell Neurosci. 2014; 8:378. doi: 10.3389/fncel.2014.00378.
28. Alvarez MI, Rivas L, Lacruz C, et al. Astroglial cell subtypes in the cerebella of normal adults, elderly adults, and patients with Alzheimer's disease: A histological and immunohistochemical comparison. Glia 2015; 62:287-312.
29. Virchow R. Die Cellularpathologie in ihrerBegründung auf physiologische und pathologische Gewebelehre. Berlin: Verlag 1858.
30. Retzius G. Die Neuroglia des Gehirns beim Menschen und bei Säugethieren: Die Neuroglia des Kleinhirns. Biologische Untersuchungen. Neue Folge VI: 1894; pp 16-20.
31. Bergmann C. Notiz ubre einige Structurverhältnisse der Cerebellum und Rückenmarks. Z Rationelle Med 1857; 8:360-63.
32. Golgi C. Sulla fina anatomia del cervelletto umano. Lecture, Ist. Lomb Sci Lett. (Milano) 8, January (1874). (Reprinted 1903, in: Opera Omnia, vol. I: Istologia normale, 1870-1883. Milan: Ulrico Hoepli. p 99-111).
33. Ramón y Cajal S. Histologie du systéme nerveux de lęhomme et des vertébrés (translated by L. Azoulay), vols I and II. Paris: Maloine (1909-1911). (Reprinted 1952 and 1955. Madrid: Consejo Superior de Investigaciones Científicas).
34. Ramón y Cajal S. Contribución al conocimiento de la neuroglia del cerebro humano. Trab Lab Invest Biol 1913; 11:255-315.
35. Terrazas R. Notas sobre la neuroglia del cerebelo y el crecimiento de los elementos nerviosos. Rev Trim Micrográf 1897; II 49-65.
36. Del Río Hortega P. El 'tercer elemento' de los centros nerviosos. Poder fagocitario y movilidad de la microglia. Bol Soc Esp Biol 19019; 8:68-82.
37. Del Río Hortega P. La glia de escasas radiaciones (oligodendroglia). Bol Real Soc Esp Hist Nat 1921; 21:63-92.
38. Del Río Hortega P. Histogénesis y evolución normal, éxodo y distribución regional de la microglia. Memorias Real Soci Esp Hist Nat 1921; 11:213-68.
39. Kalman M. GFAP expression withdraws—a trend of glial evolution? Brain Res Bull 2001; 57:509-11.
40. Schools GP, Zhou M, Kimelberg HK. Electrophysiologically "complex" glial cells freshly isolated from the hippocampus are immunopositive for the chondroitin sulfate proteoglycan NG2. J Neurosci Res. 2003; 73:765-77.
41. Levine JM, Card JP. Light and electron microscopic localization of a cell surface antigen (NG2) in the rat cerebellum: association with smooth protoplasmic astrocytes. J Neurosci. 1987; 7(9): 2711-20.
43. Oberheim NA, Takano T, Han X, et al. Uniquely hominid features of adult human astrocytes. J Neurosci 2009; 29:3276-87.
44. Toledano A, Álvarez MI, Toledano-Díaz A. Diversity and variability of the nicotine effects on different brain cortical regions. Therapeutic and toxicologic implications.Central Nervous System Agents in Medicinal Chemistry 2010; 10:180-206.
45. Iliff JJ, Nedergaard M. Is there a cerebral lymphatic system? Stroke 2013; 44(6 Suppl 1):S93-5.
46. Wyss-Coray T, Rogers J. Inflammation in Alzheimer disease-a brief review of the basic science and clinical literature. Cold Spring Harb Perspect Med 2(1):a006346.
47. Meraz-Ríos MA, Toral-Ríos D, Franco-Bocanegra D, et al. Inflammatoryprocess in Alzheimer's Disease. Front Integr Neurosci 2013; 7:59. doi: 10.3389/fnint.2013.00059.
48. Frackowiak J, Wisniewski HM, Wegiel J, Merz GS, Iqbal K, Wang KC. Ultrastructure of the microglia that phagocytose amyloid and the microglia that produce beta-amyloid fibrils. Acta Neuropathol 1992; 84:225-33.
49. Masliah E, Mallory M, Hansen L, et al. Immunoreactivity of CD45, a protein phosphotyrosine phosphatase, in Alzheimer's disease. Acta Neuropathol 1991; 83:12–20.
50. Ito D, Imai Y, Ohsawa K, et al. Microglia-specific localization of a novel calcium binding protein, Iba1. Brain Res Mol Brain Res 1998; 57:1–9 (1998).