REVISIÓN |
Cannabinoides: una prometedora herramienta para el desarrollo de nuevas terapias
Ana Isabel Fraguas-Sánchez1, Ana María Fernández-Carballido1,2, Ana Isabel Torres-Suárez1,2,*
1Departamento de Farmacia y Tecnología Farmacéutica. Facultad de Farmacia. Universidad Complutense de Madrid.2Instituto Universitario de Farmacia Industrial. Universidad Complutense de Madrid.
e-mail: galaaaa@ucm.es
Recibido el 15 de junio de 2014 An. Real Acad. Farm. Vol. 80, Nľ 3 (2014), pag.555-577
resumen
Los cannabinoides, mediadores lipídicos presentes en la planta Cannabis sativa, han sido utilizados en medicina desde la antigüedad; retirándose del arsenal terapéutico en la primera mitad del siglo XX debido a sus efectos adversos psicoactivos y a la aparición de alternativas más seguras. No obstante el descubrimiento del sistema cannabinoide endógeno y su participación reguladora en múltiples funciones fisiológicas básicas del organismo suscitaron de nuevo a finales del siglo pasado el interés de los investigadores como posibles herramientas terapéuticas en diversas patologías como trastornos neurodegenerativos y metabólicos, enfermedades autoinmunes, glaucoma e, incluso, cáncer. |
Palabras clave: dolor; cáncer; enfermedades neurodegenerativas.
abstract
Cannabinoids: a promissing tool for the development of novel therapies
Cannabinoids, lipid mediators presents in Cannabis sativa plant, have been used for medicinal purposes for centuries. In the first half of the twentieth century they were removed from medicine due to their psychoactive adverse effects and the emergence of safer drugs. Nevertheless at the end of this century the discovery of endogenous cannabinoid system and its participation in multiple basic physiological functions have attracted much attention to the researchers as possible tools in the treatment of several pathological conditions such as neurodegenerative and metabolic disorders, autoimmune diseases, glaucoma and cancer. |
Keywords: pain; cancer; neurodegenerative diseases.
1. INTRODUCcióN
El término Cannabinoides fue inicialmente usado para hacer referencia a un grupo de compuestos presentes en la resina secretada por los brotes y las partes florecidas de la planta Cannabis sativa, resina conocida por sus propiedades psicoactivas, al producir psicosis, ansiedad, depresión y alucinaciones. Los cannabinoides más relevantes son el Δ9‐tetrahidrocannabinol (THC) (el más abundante y responsable de los efectos psicoactivos de esta planta) y el Cannabidiol (CBD), el segundo en abundancia (1). La elevada liposolubilidad de estos compuestos llevó a pensar que ejercían su efecto mediante la modificación de los fosfolípidos de las membranas plasmáticas. Esta teoría se mantuvo durante décadas hasta que en 1990 se aisló y caracterizó el primer receptor específico de cannabinoides (1,2), que demostraba que el efecto de estos compuestos era mediado por receptores de membrana. Este descubrimiento llevó además a la búsqueda de ligandos endógenos que los activaran, los llamados endocannabinoides, de los que la Anandamida (AEA) y el 2-araquidonil glicerol (2-AG) son los más importantes (3,4). De esta manera, en la actualidad el término cannabinoide no sólo designa a esos componentes naturales aislados de la planta Cannabis sativa (denominados fitocannabinoides), sino también a esos ligandos endógenos que actúan sobre receptores específicos de cannabinoides (endocannabinoides) , y a los análogos sintéticos de ambos grupos.
Desde el punto de vista terapéutico, el cannabis ha sido empleado en medicina desde la antigüedad, siendo retirado del arsenal terapéutico a mediados del siglo XX debido a sus efectos psicoactivos. Hoy en día sin embargo vuelve a tomar interés el empleo de determinados cannabinoides en diversas patologías tales como cáncer y esclerosis múltiple, existiendo incluso algunas formulaciones comercializadas constituidas por estos compuestos.
2. CANNABIS SATIVA
Cannabis sativa (Figura 1) es una planta herbácea anual, dioica perteneciente a la familia de las Cannabaceae; originaria de la zona este y central de Asia (5). A los preparados psicótropos obtenidos de esta planta se les conoce como marihuana o hachís, dependiendo de las partes de la planta y los procesos utilizados para su preparación. El término marihuana hace referencia a las flores desecadas y tallos de la planta que habitualmente se fuman; mientras que hachís describe a la resina concentrada que se obtiene a partir de las flores y que se puede ingerir (1).
Es una planta que ha sido utilizada por el hombre desde la antigüedad con una amplia variedad de objetivos, que van desde aplicaciones textiles o alimentarias hasta su uso con fines recreativos, religiosos o terapéuticos, siendo estos últimos uno de los fines más relevantes (6,7). En la medicina tradicional China preparados de esta planta eran empleados para el tratamiento de la malaria, beri-beri y estreĖimiento, describiéndose también sus posibles efectos psicoactivos, denominados como “visiones diabólicas” (8). Los hindúes la empleaban así mismo en terapéutica para el tratamiento de neuralgias, convulsiones infantiles, calambres y para algunas cefaleas como las migraĖas. No fue hasta el siglo XIX cuando empezó a utilizarse en la medicina occidental (6). En Inglaterra y en Estados Unidos se utilizaban extractos de resina de cannabis disuelta en etanol (la denominada tintura de cannabis) para el tratamiento del tétanos, rabia, cólera, convulsiones infantiles, reumatismo o deliriums tremens (6,7). Sin embargo, en la primera mitad del siglo XX el empleo medicinal del cannabis desapareció, debido sobre todo a la variabilidad en la potencia de los extractos, a la impredecible respuesta individual que presentaba y a la aparición en terapéutica de alternativas más seguras y sin los efectos adversos psicoactivos que presenta el cannabis (9).

Figura 1.- Cannabis sativa
Desde principios
del siglo XX hubo numerosos intentos de aislar y elucidar estructuralmente los
compuestos activos de esta planta. En 1930 se aisló el primer cannabinoide, el
CBD, pero su estructura no fue elucidada hasta 1963. En cuanto al THC no fue
aislado y elucidado hasta 1964 (6,9). Actualmente se han aislado más de 100 cannabinoides
(5,10) destacando además de los citados anteriormente el Cannabicromeno (CBC),
Canabigerol (CBG), Cannabinol (CBN), Δ8-tetrahidrocannabinol
(Δ8‐THC), Ácido cannabicromenico (CBCA), Ácido
cannabigerólico (CBGA), Ácido cannabinólico (CBDA), y Ácido Δ9-
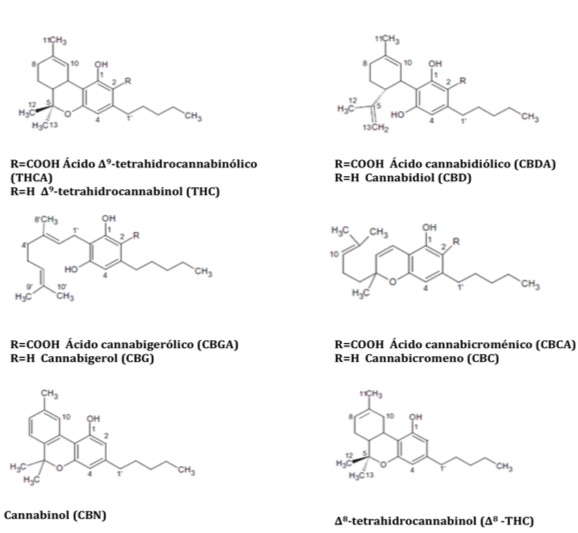
Figura 2.- Estructura de los diferentes cannabinoides naturales presentes en Cannabis sativa.
3. SISTEMA CANNABINOIDE ENDÓGENO
Debido a la elevada liposolubilidad que presentan los cannabinoides, se pensaba que ejercían su acción modificando la estructura fosfolipídica de las membranas plasmáticas celulares. Sin embargo el descubrimiento de receptores específicos para estos compuestos desmontó esta teoría y puso de manifiesto que ejercían su acción uniéndose a receptores de membrana (12). Esto llevó a la búsqueda de ligandos endógenos que actuaran sobre dichos receptores: son los llamados endocannabinoides, que junto con sus receptores específicos constituyen el Sistema Cannabinoide Endógeno (SCE).
3.1. Biosíntesis y degradación de endocannabinoides
Los endocannabinoides son moléculas derivadas de ácidos grasos poliinsaturados, sintetizadas a demanda, entre los cuales podemos citar a la etanolamida del ácido araquidónico, conocida como Anandamida (AEA), el 2-araquidonil glicerol (2-AG), 2-araquidonil glicerol éter (noladin éter), O- araquidonil etanolamida (Virodhamina) y el N-araquidonil dopamina (NADA); siendo los dos primeros los más importantes (3,4) (Figura 3).
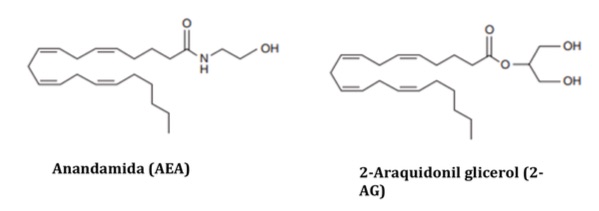
Anandamida (AEA) |
2-Araquidonil glicerol (2-AG) |
Figura 3.- Estructura de los principales endocannabinoides: AEA y 2-AG.
La AEA se sintetiza a partir de la fosfatidil-etanolamina (PEA), que gracias a la acción de la N-acetiltransferasa (NAT) da lugar a la N-araquidonoil-fosfatidiletanolamina (NAPE) por la transferencia de ácido araquidónico desde la fosfatidilcolina. A continuación NAPE es hidrolizada por la fosfolipasa D, dando lugar a la AEA (4,12-18). El 2-AG, por el contrario, se sintetiza a partir de fosfatidil inositol (PI) por acción de la fosfolipasa C (PLC) que da lugar al diacilglicerol (DAG), que será hidrolizado por la diacilglicerollipasa (DAGL) para sintetizar el 2-AG (4, 12-17) (Figura 4).
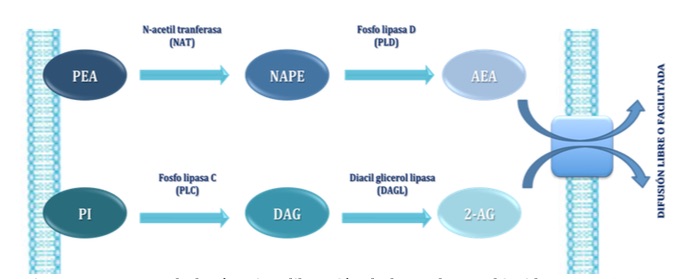
Figura 4.- Esquema de la síntesis y liberación de los endocannabinoides AEA y 2-AG. La fosfatidil-etanolamina (PEA) por la acción de la N-acetiltransferasa (NAT) da lugar a la N-araquidonoil-fosfatidiletanolamina (NAPE), que es hidrolizada por la fosfolipasa D, dando lugar a la AEA. El 2-AG se sintetiza a partir de fosfatidil inositol (PI), que por acción de la fosfolipasa C (PLC) da lugar al diacilglicerol (DAG), que será hidrolizadopor la diacilglicerollipasa (DAGL) dando lugar a 2-AG.
Además de estas rutas sintéticas ambos endocannabinoides poseen vías de síntesis alternativas. La AEA puede ser sintetizada a partir de ácido araquidónico y etanolamina, por la amido hidrolasa de ácidos grasos (FAAH) cuando ambos sustratos se encuentran en elevadas concentraciones. El 2-AG se sintetiza también a partir de PI, que por acción de la fosofolipasa A (PLA) da lugar a liso-fosfolípidos, y estos al 2-AG al ser hidrolizados por la Lyso-fosfolipasa C (Lyso-PLC) (17) (Figura5).
ÁCIDO ARAQUIDÓNICO |
Amido hidrolasa de ácido grasos (FAAH) |
AEA |
Fosfo lipasa A (PLA) |
LISOFOSFOLÍPIDOS |
Lisofosfolipasa C (Liso –PLC) |
2-AG |
ETANOL AMIDA |
PI |
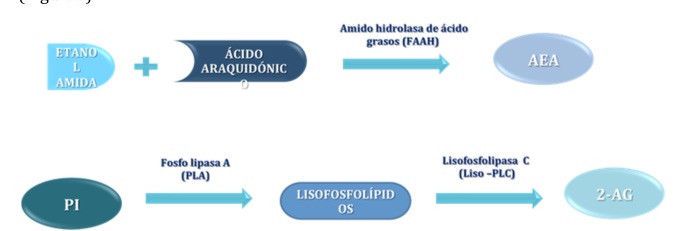
Figura 5.- Esquema de las rutas de síntesis alternativas de los endocannabinoides AEA y 2-AG. La AEA también puede ser sintetizada a partir de ácido araquidónico y etanolamina por la misma enzima responsable de su degradación, la amido hidrolasa de ácidos grasos (FAAH) cuando ambos sustratos se encuentran en elevadas concentraciones. El 2-AG se sintetiza también a partir de fosfatidilinositol (PI), que por acción de la fosofolipasa A (PLA) da lugar a liso-fosfolípidos, y estos al 2-AG al ser hidrolizados por la Lyso-fosfolipasa C (Lyso-PLC).
En cuanto a las rutas degradativas, cabe decir que la AEA presenta una vida media muy corta, pues es recaptada de la hendidura sináptica por un transportador de alta afinidad y degradada en el interior de la célula por la amido hidrolasa de ácidos grasos (FAAH) dando lugar a sus dos componentes, etanolamida y ácido araquidónico. El 2-AG una vez liberado puede ser recaptado por el transportador de anandamida y degradado posteriormente por la enzima monoacilglicerol lipasa (MAGL) (4, 15-17) (Figura 6).
3.2. Receptores específicos de cannabinoides
Hasta el momento hay dos tipos de receptores de Cannabinoides identificados: CB1 y CB2. Pertenecen a la familia de receptores acoplados a proteínas G (GPCRs) y presentan siete dominios transmembrana (19,20) (Figura 7).
El receptor CB1 fue caracterizado en 1990 (2,19, 20). Se trata de una proteína de 473 aminoácidos (20) insertada en la membrana plasmática a la que se une tanto el THC como los endocannabinoides. Se localiza fundamentalmente a nivel del sistema nervioso central (19-24), encontrándose la mayor densidad de los mismos en los ganglios basales (sustancia nigra, globo pálido, núcleo entopeduncular y caudado putamen lateral). La densidad es moderada en las capas número I y IV de la corteza cerebral, y aún menor en el hipotálamo, médula espinal y tallo cerebral (20) (Figura 7). Además de a nivel central estos receptores los encontramos también en regiones periféricas tales como próstata, amígdalas, ovarios, útero y a nivel presináptico en terminaciones nerviosas simpáticas (22,23). Hay que destacar que esta distribución explica muchos de los efectos producidos por los cannabinoides. Por ejemplo su presencia en el hipocampo y la corteza explican las alteraciones cognitivas que producen, o la elevada densidad que encontramos en los ganglios basales determina las alteraciones del movimiento y en el control postural. Hay que seĖalar, además, que la baja densidad de estos receptores a nivel del tallo cerebral (región que controla la función respiratoria) explica la ausencia de toxicidad a este nivel de los cannabinoides (20).
DIFUSIÓN PASIVA |
DIFUSIÓN FACILITADA |
AEA |
2-AG |
AEA/2-AG |
Amido hidrolasa de ácido grasos (FAAH) |
Monoacil glicerol lipasa (MAGL) |
ÁCIDO ARAQUIDÓNICO |
ÁCIDO ARAQUIDÓNICO |
ETANOL AMIDA |
GLICEROL |
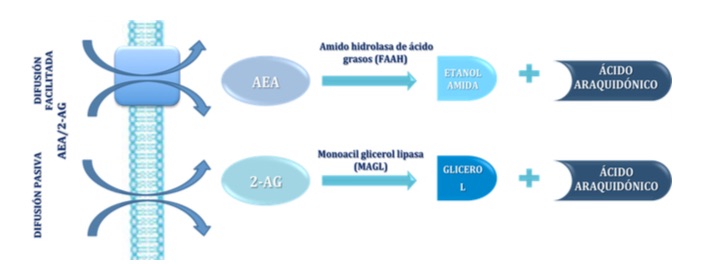
Figura 6.- Esquema de las rutas de degradación de los endocannabinoides AEA y 2-AG. La AEA es degradada por la la amido hidrolasa de ácidos grasos (FAAH) dando lugar etanolamida y ácido araquidónico. El 2-AG es degradado por la monoacilglicerol lipasa (MAGL) dando lugar a glicerol y ácido araquidónico.
Figura 7.- Estructura de los receptores CB1 y CB2.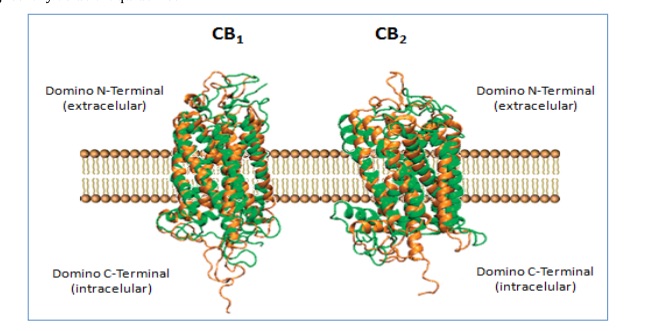
El receptor CB2, aislado en 1993 (2) de bazo de rata y de una línea leucémica humana (HL60) (20,25), es un polipéptido de 360 aminoácidos (25) que presenta una distribución mucho más limitada, encontrándose casi en exclusividad en el sistema inmune (19-25), tanto a nivel de tejidos (bazo, timo y nódulos linfáticos) como de células (linfocitos T y B, monocitos, macrófagos, y neutrófilos). Son por tanto estos receptores los responsables de la acción inmunosupresora de la marihuana.
La activación de estos receptores específicos de cannabinoides implica la inhibición de la adenilato ciclasa (AC) y por tanto una disminución de los niveles de AMPc (19-24). Como consecuencia de la activación de receptores CB1 (Figura 8) se produce la modificación de diversas proteínas celulares como factores de transcripción génica y canales iónicos. Sobre canales de potasio (K+) y de calcio (Ca2+) aumenta la conductancia y disminuye la entrada de estos iones respectivamente. Esto origina una disminución en la despolarización de la membrana bloqueando a nivel de las terminaciones presinápticas la liberación de neurotransmisores como acetilcolina, noradrenalina y glutamato (26). Se produce también la activación de las MAP quinasas (MAPK), alterándose por tanto diversos procesos de proliferación y diferenciación celular (21-23). La activación de los receptores CB2 sigue las mismas rutas que la de los CB1 pero sin verse afectados los canales iónicos y por tanto la liberación de neurotransmisores (21).
Las principales características y diferencias de los receptores CB1 y CB2 están recogidas en la Tabla 1.
3.3. Otros receptores de cannabinoides
Además de activar los receptores CB1 y CB2, los cannabinoides van actuar sobre otros receptores de membrana entre los que podemos destacar el receptor huérfano GPR55, el receptor de potencial transitorio V1 (TRPV1) y los receptores proliferadores de peroxixomas (PPAR) α y γ (2).
- Receptor huérfano GPR 55: El receptor GPR55, aislado y clonado por primera vez en 1999, es una proteína de 319 aminoácidos perteneciente a la familia de receptores acoplados a proteínas G (27). Es todavía conocido como uno de los receptores huérfanos, a pesar de que estudios recientes postulan al lisofosfatidilinositol (LPI) como su ligando endógeno (28).
El GPR55 se localiza tanto en el sistema nervioso central como en tejidos periféricos, principalmente en las glándulas adrenales, bazo, hígado, tracto gastrointestinal, y a nivel óseo y vascular; y está implicado en numerosas funciones fisiológicas, entre las que podemos destacar el control del dolor (29). Se encuentra además expresado por diversas células cancerígenas, participando en procesos de angiogénesis y proliferación e invasión tumoral (27).
A pesar de mostrar estructuralmente una baja homología con los receptores CB1 y CB2 (CB1, 13,5% and CB2, 14,4%), (30) diversos cannabioides como el THC y el CBD son capaces de unirse a este receptor. Mientras que el THC, y algunos de sus análogos sintéticos como el CP55940, activan estos receptores, el cannabidiol se comporta como antagonista de los mismos (31).
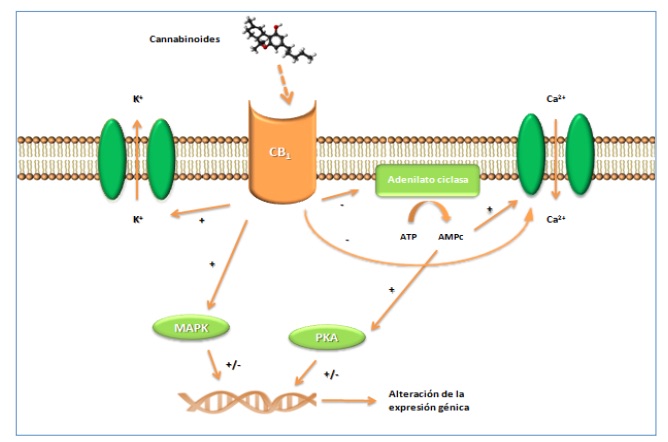
Figura 8.- Activación de receptores CB1. Rutas de seĖalización. La activación de receptores CB1 implica la inhibición de la adenilato ciclasa (AC) y por tanto una disminución de los niveles de AMPc, y la activación de canales iónicos de potasio y la inhibición de canales de calcio, aumentando la conductancia y disminuyendo la entrada de estos iones respectivamente. Se produce también la activación de las MAP quinasas (MAPK) y una disminución de la protein kinasa, alterándose por tanto diversos procesos de proliferación y diferenciación celular.
- Receptor de potencial transitorio V1: El receptor de potencial transitorio V1 o TRPV1 es una proteína de 6 dominios transmembrana, miembro de la superfamilia de canales iónicos de receptores de potencial transitorio, localizado a nivel del sistema nervioso e implicado en el control y la percepción del dolor (32).
Este receptor puede ser activado por diversos estímulos como son temperaturas superiores a 43 ľC, moléculas como la capsaicina y mediadores lipídicos entre los que se encuentran algunos cannabinoides (32), como el cannabidiol y el cannabigerol (29).
- Receptores activadores de la proliferación de peroxixomas: Los receptores activadores de la proliferación de peroxixomas (PPRA) son una familia de receptores nucleares que presenta tres isoformas: α, δ y γ. Juegan un papel esencial en múltiples funciones fisiológicas como la regulación del metabolismo lipídico, la homeostasis de la glucosa, la sensibilidad a la insulina y la inflamación (33,34). Los ligandos de estos receptores son moléculas lipídicas entre las que se encuentran algunos cannabinoides, entre los que podemos destacar endocannabinoides como la AEA, el 2-AG y la oleoananamida; y fitocannabinoides como el THC (34) y el CBD (29).
Tabla 1.- Principales características y diferencias de los receptores específicos de cannabinoides CB1 y CB2.
RECEPTORES ESPECÍFICOS DE CANNABINOIDES |
||
CB1 |
CB2 |
|
Distribución |
Sistema nervioso central Terminaciones nerviosas periféricas Testículos, Ovarios, Útero |
Sistema inmune |
Mecanismo intracelular |
Inhibición de la adenilato ciclasa Inhibición canales de calcio Estimulación canales de potasio Activación de MAP kinasas |
Inhibición de la adenilato ciclasa Activación de MAP kinasas |
Agonistas endógenos |
Anandamida 2-araquidonil-glicerol |
2-Araquidonil glicerol |
Agonistas exógenos |
Δ9-Tetrahidrocannabinol CP 55940 WIN55212-2 Nabilona |
|
Antagonistas |
Rimonabant |
SR144528 |
3.4. Acciones fisiológicas del sistema endocannabinoide
El sistema cannabinoide endógeno juega un papel modulador en diferentes procesos fisiológicos, principalmente a nivel del sistema nervioso, pero también actúa sobre el metabolismo energético, el sistema inmune, y el sistema endocrino.
A nivel nervioso una de las acciones más estudiadas y establecidas de los cannabinoides es la atenuación de la neurotransmisión (35). La activación de los receptores CB1 produce una inhibición de la liberación de neurotransmisores excitatorios e inhibitorios como GABA, Glutámico, Serotonina, Noradrenalina, Dopamina y Acetilcolina. Este sería precisamente el mecanismo por el cual el sistema endocannabinoide regularía la plasticidad neuronal, produciendo efectos fisiológicos a nivel de memoria, aprendizaje (36), funciones motoras, respuesta al dolor y control del apetito (37).
Por otro lado el efecto general que ejercen los cannabinoides sobre el sistema endocrino es de tipo inhibitorio. Actúan sobre el sistema hipotálamo-hipófiso-gonadal, produciendo una disminución de la secreción de hormona luteinizante (LH) y de hormona folículoestimulante (FSH) (38,39), en la que participan los receptores CB1 que se expresan en la hipófisis anterior (38). Como consecuencia se produce también una disminución de la secreción de las hormonas sexuales y de la prolactina. Se ejerce así mismo una regulación inhibitoria del eje hipotálamo-hipófiso-adrenal, de manera que en estado basal existe un tono endocannabinoide que inhibe tanto la secreción de hormona adenocorticotropa (ACTH), como de glucocorticoides (40). Además se produce una disminución de las hormonas tiroideas y de la hormona de crecimiento (38).
En cuanto al metabolismo energético, hay que destacar el papel orexigénico que presentan los cannabinoides. El papel que tiene el sistema endocannabinoide en la regulación del apetito y del metabolismo energético se debe en gran parte a su acción sobre la quinasa activada por adenosina 5’-monofosfato (AMPK). La AMPK actúa como sensor del estado energético celular y es activada por cualquier estímulo que reduzca los niveles de ATP aumentando los de AMP. Su activación pone en marcha reacciones catabólicas mientras que inhibe vías anabólicas. Los cannabinoides estimulan AMPK en el hipotálamo, induciendo un aumento del apetito, mientras que inhiben la AMPK del hígado y tejido adiposo produciendo efectos lipogénicos y diabetogénicos (41,42).
La activación de receptores CB2 también conduce a un efecto inmunomodulador, estimulándose la proliferación de linfocitos B, linfocitos T y la liberación de citocinas (43,44).
4. AGONISTAS Y ANTAGONISTAS DE LOS RECEPTORES DE CANNABINOIDES
En cuanto a los ligandos de los receptores específicos de cannabinoides, hay que destacar que tanto sobre los receptores CB1 como sobre CB2 van a actuar además de los endocannabinoides, los fitocannabinoides y los análogos sintéticos de ambos grupos.
4.1. Agonistas.
Existe una amplia variedad de ligandos que se comportan como agonistas de los receptores cannabinoides y por tanto como activadores de las respuestas mediadas por éstos. Desde el punto de vista farmacológico estos ligandos se clasifican en tres grupos: agonistas no selectivos, agonistas selectivos CB1 y agonistas selectivos CB2.
AGONISTAS Y ANTAGONISTAS DE LOS RECEPTORES CB1 Y CB2 |
||||
AGONISTAS |
ANTAGONISTAS |
|||
1. Agonistas no selectivos |
Cannabinoides clásicos |
THC Δ8-THC,CBN, CBD HU-210, HU-243, O-1057 |
Antagonista selectivos CB1 Rimonabant |
|
Cannabinoides no clásicos |
CP55, 940; Levonantradol; Desacetilevonantradol |
|||
Aminoalquilindoles |
WIN55, 212-2 |
|||
Antagonista selectivos CB2 SR144528 |
||||
Eicosanoides |
AEA , 2-AG |
|||
2. Agonistas selectivos CB1 |
ACEA ,ACPA, Metanandamida , Noladin éter |
|||
3. Agonistas selectivos CB2 |
JWH-133, HU-308, JWH-015 y AM1241 |
|||
Tabla 2.- Agonistas y antagonistas principales de los receptores CB1 y CB2.
- Agonistas no selectivos: Los agonistas no selectivos se dividen a su vez en cuatro grupos con estructura química bien diferenciada: cannabinoides clásicos, cannabinoides no clásicos, aminoalquilindoles y eicosanoides.
El grupo de cannabinoides clásicos se corresponde con compuestos con estructura de dibenzopirano, e incluye los cannabinoides naturales presentes en Cannabis sativa como el THC, Δ8-THC, CBN, y CBD; y sus análogos sintéticos. Entre estos últimos cabe destacar los análogos del THC, como el 11-hidroxi-Δ8-THC-dimetilheptilo (HU-2l0), el 11-hidroxi-hexahidrocannabinoldimetilheptilo (HU-243) y el 3-(5’ciano-l’,1’-dimetilpentil)-l-(4-N-morfolinobutiliroxi)- Δ8‐THC (0-1057) que presenta carácter hidrosoluble (45). Dentro de este grupo se encuentra también el propio THC sintético (Dronabinol).
Los cannabinoides no clásicos son análogos bicíclicos y tricíclicos del THC que carecen del anillo pirano, entre los que destacan el CP55, 940 (principal representante de este grupo); el CP55,244; CP50,556 (levonantradol) y el desacetilevonantradol.
El tercer grupo de compuestos cannabimiméticos no selectivos son los aminoalquilindoles, cuyo principal representante es el WIN55, 212-2.
Por último el grupo de los eicosanoides surgió con el descubrimiento de la existencia de ligandos cannabinoides endógenos (45), e incluye una serie de compuestos derivados estructuralmente del ácido araquidónico siendo los más importantes la AEA y el 2-AG.
- Agonistas CB1 selectivos: La araquidonil-2’-cloroetilamida (ACEA) y la araquidoni1ciclopropilamida (ACPA) son agonistas altamente selectivos de los receptores CB1 (45). Los derivados estructurales de la anandamida como la metanandamida y el endocannabinoide noladin éter, se incluyen también dentro de este grupo.
- Agonistas CB2 selectivos: Se trata de análogos sintéticos de los cannabinoides no selectivos clásicos y no clásicos. Así pues encontramos en este grupo JWH-133, HU-308, JWH-015 y AM1241 (45,46). Estos compuestos carecen de los efectos psicoactivos característicos de muchos cannabinoides, representando por tanto una buena oportunidad para ser utilizados en terapéutica (47).
4.2. Antagonistas
En los últimos aĖos se han desarrollado diversas moléculas capaces de antagonizar, de forma selectiva, los efectos cannabimiméticos mediados por los receptores CB1 o CB2, y que han supuesto una herramienta fundamental para la caracterización farmacológica de estas proteínas. Una de las moléculas más potente y más ampliamente utilizada como antagonista de los receptores de cannabinoides CB1 es el rimonabant, que presenta una marcada selectividad por los receptores CB1 y revierte por tanto las acciones de los agonistas cannabinoides que actúan a través de estos receptores. En cuanto a antagonistas CB2 selectivos encontramos un análogo del rimonabant, el SR144528.
5. POTENCIAL TERAPÉUTICO DE LOS CANNABINOIDES.
La implicación del sistema cannabinoide endógeno en múltiples funciones fisiológicas básicas del organismo convierte a los cannabinoides en prometedores candidatos para el tratamiento de numerosas patologías (Figura 9), destacando las enfermedades neurodegenerativas, trastornos metabólicos, diabetes y cáncer (48).
Hay que destacar que mientras que el potencial terapéutico que presentan estos compuestos en enfermedades como esclerosis múltiple, dolor, emesis, cáncer o su aplicación como estimulantes del apetito está ampliamente reconocido, existiendo incluso formulaciones a base de cannabinoides comercializadas con estas indicaciones; su aplicación terapéutica en otras enfermedades como diabetes, glaucoma, Alzheimer y otros trastornos neurodegenerativos presenta más controversia.
5.1. Estimulación del apetito y tratamiento de la obesidad
El cannabis es conocido por ser un potente estimulante del apetito (1,29,49,50), incrementando principalmente la ingesta de alimentos ricos en grasa. Este fenómeno está regulado por el SCE y se debe a la activación de receptores CB1 a nivel hipotalámico. Además de la estimulación del apetito, la activación de estos receptores en el tracto digestivo, sobre todo a nivel hepático, aumenta la lipogénesis, y por tanto la síntesis en novo de ácidos grasos y la ganancia de peso. De esta manera agonistas CB1 como el THC o sus análogos tienen aplicación en situaciones que requieren una ganancia de peso como el síndrome de desgaste asociado a SIDA o a cáncer, existiendo formulaciones a base de cannabinoides comercializadas para este fin.
Por el contrario, antagonistas CB1 como el rimonabant disminuyen el apetito, y tienen utilidad en el tratamiento de la obesidad (50). Este compuesto fue aprobado y comercializado con este fin, pero se retiró debido a los graves efectos secundarios de carácter psiquiátrico que ocasionaba.
5.2. Emesis.
Los cannabinoides presentan un importante efecto antiemético siendo capaces de prevenir las náuseas y vómitos asociados a muchos fármacos (1,2,11,29,43). El mecanismo por el que ejercen este efecto no está del todo esclarecido. La activación de receptores CB1 en el tracto solitario parece ser la responsabl, aunque los receptores TPRV1 también estarían implicados (2), lo que explicaría por qué cannabinoides que no actúan sobre los receptores CB1, como el CBD, presentan propiedades antieméticas (29). El THC y su análogo sintético Nabilona presentan acción antiemética (1), estando aprobado su uso en la prevención de las náuseas y vómitos inducidos por agentes quimioterápicos.
5.3. Enfermedades neurológicas
El poder antioxidante y neuroprotector que presentan numerosos cannabinoides los convierte en potenciales candidatos terapéuticos de enfermedades neurológicas y neurodegenerativas (51) tales como Alzheimer, Parkinson, Esclerosis múltiple o epilepsia.
- Esclerosis múltiple: la esclerosis múltiple es una enfermedad inflamatoria del sistema nervioso central, de origen autoinmune, que se manifiesta con rigidez muscular, espasticidad, temblor, fatiga y dolor (52). Los cannabinoides presentan una importante aplicación en el tratamiento de esta enfermedad al ser capaces de mejorar el dolor neuropático y la espasticidad que la caracteriza (52-54). El mecanismo por el que se ejercen estos efectos parece implicar a los receptores específicos de cannabinoides, sobre todo a los receptores CB1 (52), pues agonistas de estos receptores han demostrado reducir la rigidez de las extremidades y mejorar la función motora, mientras que antagonistas de los mismos evitan estos efectos. Entre los cannabinoides que presentan estas propiedades hay que destacar al THC, que de hecho está aprobado y comercializado en combinación con el CBD con este fin.
Estudios recientes han demostrado, además, que la aplicación de los cannabinoides en esta enfermedad va más allá que un mero control de la sintomatología, pues debido a sus propiedades neuroprotectoras son capaces de frenar la degeneración neuronal que se produce y por tanto la progresión de la enfermedad. (53,54).
- Epilepsia: debido a sus propiedades anticonvulsivantes muchos cannabinoides, como el CBD, pueden presentar utilidad en el tratamiento de la epilepsia (29). El mecanismo por el cual estos cannabinoides ejercen acción anticonvulsivante es la reducción de las concentraciones plasmáticas de calcio (29,55) y el antagonismo CB1 (29).
- Alzheimer: el Alzheimer es una enfermedad neurodegenerativa caracterizada por depósitos de β-amiloide y deficiencia de acetilcolina, en la que se produce pérdida neuronal y deficiencia cognitiva (56). Aunque el potencial de los cannabinoides en esta patología no está del todo esclarecido, algunos cannabinoides como el THC parecen presentar utilidad en esta enfermedad al aumentar la disponibilidad de acetilcolina y reducir la acumulación de β-amiloide (56-58).
- Parkinson: el Parkinson es una patología neurodegenerativa en la que se produce una pérdida de neuronas dopaminérgicas en la sustancia nigra. El potencial terapéutico de los cannabinoides en esta enfermedad presenta más controversia. Mientras hay estudios que indican que son capaces de mejorar los síntomas parkinsonianos al incrementar la trasmisión dopaminérgica, otros indican que carecen de efecto. Lo que sí está más esclarecido es su capacidad para revertir la discinesia producida por Levodopa (1,50).
5.4. Cáncer
Los cannabinoides se están empleando satisfactoriamente en el tratamiento de los efectos adversos asociados al cáncer y los tratamientos antitumorales tales como náuseas, vómitos, falta de apetito, pérdida de peso y dolor. El dronabinol (THC sintético) y la nabilona están comercializados para combatir y prevenir las náuseas y vómitos asociados a quimioterapia y radioterapia (59,60). Pero, con independencia de este uso paliativo en la terapia anticancerosa, algunos cannabinoides como el THC, CBD, CBG,CBC, CBDA y Δ8-THC, han demostrado tener un efecto antitumoral per-se (29), al inhibir el crecimiento descontrolado de las células tumorales (por inducción de apoptosis e inhibición de la proliferación celular) e impedir la angiogénesis y metástasis tumoral disminuyendo e inhibiendo la adhesión e invasión de las células tumorales. Estos efectos se han observado en muchos tipos de cáncer como pulmón, mama, próstata, colón, hígado, piel, glioblastomas, leucemias y linfomas (29,59,61). En cuanto a los mecanismos responsables de la acción antitumoral no están del todo esclarecidos, aunque parecen implicados tanto receptores específicos para cannabinoides (CB1 y CB2) como receptores independientes como el receptor TPRV1 (29,22).
Por otro lado, en algunos estudios realizados con THC se ha observado un efecto bifásico sobre las células tumorales, de manera que a baja concentración incrementa la proliferación tumoral y a concentraciones más elevadas la inhibe. Este efecto positivo sobre la proliferación celular parece deberse a la activación de receptores CB2 que disminuiría la respuesta inmunitaria frente al tumor favoreciendo su crecimiento (59).
Por lo tanto, aunque por ahora los resultados son prometedores, son todavía muchos los estudios necesarios para definir con claridad el uso de los cannabinoides en el tratamiento del cáncer.
5.5. Analgesia
Los cannabinoides son capaces de disminuir la reactividad al dolor y presentan una importante actividad analgésica frente al dolor crónico, neuropático y antiinflamatorio (22). Los receptores CB1, que son altamente expresados en nociceptores aferentes primarios (43,62), y los CB2, que modulan la liberación de citocinas pro-inflamtaorias como la IL-6, IL-1 y el TNFα, son los responsables de la actividad analgésica de los cannabinoides.
5.6. Diabetes y complicaciones diabéticas
Situaciones de inflamación y estrés oxidativo juegan un importante papel en el desarrollo de la diabetes; y por tanto también aquellos sistemas que se encargan de su control, entre los que está el SCE. Por un lado la activación de receptores CB1 provoca un incremento en la respuesta inflamatoria y la generación de especies altamente oxidantes como son los radicales ROS, contribuyendo al desarrollo de diabetes y complicaciones diabéticas. La estimulación de receptores CB2 por el contrario las atenúa. De esta manera antagonistas CB1 (63) y agonistas CB2 presentarían utilidad terapéutica en esta enfermedad (64). El CBD, por ejemplo, al presentar propiedades antiinflamatorias y antioxidantes ha demostrado ejercer un efecto beneficioso frente a diversas situaciones patológicas derivadas de la diabetes como puede ser la retinopatía diabética y las complicaciones cardiacas (49,63,64).
5.7. Glaucoma
La presencia en el ojo de receptores por los que tienen afinidad los cannabinoides, como los CB1, CB2 y los receptores vaniloides, pone de manifiesto la posible utilidad terapéutica de estos compuestos en el tratamiento de patologías oculares entre las que se encuentra el glaucoma, que se caracteriza por un incremento de la presión intraocular (PIO) y que puede desembocar en ceguera si no se trata. Diversos cannabinoides como el THC y el CBN han demostrado ser capaces de disminuir la PIO. El CBD sin embargo ha resultado inactivo. El mecanismo por el que ejercen este efecto hipotensor no está muy esclarecido, pero parece ser que envuelve a los receptores CB1 (50, 65); pues antagonistas CB1 pero no antagonistas CB2 lo revierten. En esta patología se ha observado también un aumento de apoptosis de células ganglionares debido al estrés oxidativo generado. Los cannabinoides han demostrado ejercer también un efecto neuroprotector a este nivel (65,66).
A pesar del potencial terapéutico que presentan los cannabinoides en esta enfermedad, la aparición de efectos adversos como hipotensión sistémica o efectos psicoactivos dificultan su empleo. El uso de cannabinoides no psicoactivos o formulaciones tópicas supondrían una buena estrategia (27).
5.8. Asma.
Algunos cannabinoides como el THC y el Δ8-THC han demostrado tener un efecto broncodilatador y por tanto un potencial terapéutico en enfermedades respiratorias como el asma (50,67).
5.9. Artritis reumatoide
La artritis reumatoide es una enfermedad crónica de origen autoinmune caracterizada por inflamación y deformación de las articulaciones (52) frente a la que algunos cannabinoides como el CBD, debido a sus propiedades antiinflamatorias e inmunosupresoras, han demostrado cierta eficacia. (29,52).
5.10. Depresión y ansiedad
El cannabis ha demostrado tener efectos beneficiosos en determinados trastornos psíquicos como trastornos bipolares, manía, ansiedad o depresión (50). El CBD presenta propiedades antidepresivas (50) y ansiolíticas (29,68,69). Aunque aún no se sabe bien los mecanismos moleculares responsables de estas acciones, parece ser que son los receptores 5-HT1A los implicados en el efecto ansiolítico (29).
6. EFECTOS ADVERSOS Y ADICCIÓN AL CANNABIS
Uno de los principales problemas que plantea el uso del cannabis y que limita su utilidad terapéutica es la presencia de efectos psicoactivos. El principal responsable de estos efectos es el THC, que mediante la activación de receptores CB1 produce inicialmente una sensación de relajación, alegría y locuacidad; y psicosis, comportamientos depresivos y problemas de memoria a largo plazo (1). Debido a su capacidad de activar el sistema de recompensa, el cannabis tiene un potencial adictivo y su consumo crónico genera tolerancia y dependencia (1, 70,71). El síndrome de abstinencia que presenta no es tan severo como en otras drogas de abuso, como la cocaína, y se caracteriza por irritabilidad, alteraciones en la frecuencia cardíaca, hipersudoración, insomio y diarrea (1,71).
Debido a que el mecanismo responsable de todos estos efectos psicoactivos característicos del cannabis es la activación de receptores CB1 centrales, el empleo de cannabinoides no psicoactivos como el CBD y de agonistas selectivos CB2, o el desarrollo de formulaciones de acción local que no atraviesen la barrera hematoencefálica, suponen una buena estrategia para solventar estos efectos negativos y aprovechar el potencial terapéutico de los cannabinoides.
7. FORMAS DE ADMINISTRACIÓN
El uso terapéutico de la marihuana como tal ha sido objeto de una gran polémica. Hay quien se postula a favor, fundamentalmente en tratamientos paliativos en enfermos de cáncer y sida, argumentando sus efectos beneficiosos, y quien en contra debido sobre todo a sus efectos psicoactivos. El principal inconveniente que presenta el empleo de la marihuana como tal con respecto al uso de los cannabinoides aislados es la variabilidad en la proporción de los diferentes cannabinoides, pues ésta depende de numerosos factores como son las condiciones de cultivo, de preparación y de almacenamiento; haciendo muy complicado su estandarización. Sin embargo podría presentar ciertas ventajas, pues el empleo de extractos de la planta podría ser más efectivo que el uso de cannabinoides aislados debido al efecto sinérgico que tendrían los diferentes cannabinoides entre sí (72,73). En cuanto al propio THC, numerosos componentes presentes en el cannabis son capaces de paliar, en parte, sus efectos psicoactivos.
Respecto a las formas de consumo de marihuana, las más habituales son el cigarrillo, las pipas de agua y la ingesta en alimentos dulces como pasteles. La marihuana fumada tiene la ventaja de la alta biodisponibilidad y el rápido inicio de acción con respecto a la oral, que se caracteriza por una biodisponibilidad mucho menor. No obstante fumar marihuna tiene los inconvenientes el riesgo de desarrollar enfermedades pulmonares y cáncer, al entrar en contacto con productos derivados de la combustión (74).
En la mayor parte de los países, la posesión, el consumo y la venta de marihuana están prohibidos y sancionados desde el punto de vista legislativo, a excepción de Holanda donde se permite la venta y consumo de estos preparados en establecimientos debidamente autorizados (los denominados coffee shops). No obstante en algunos estados de Estados Unidos, como California, y en Canadá (74) el uso de la marihuana con fines medicinales está autorizado.
En cuanto a los medicamentos a base de cannabinoides, se encuentran aprobadosy comercializados en diversos países, entre ellos Estados Unidos, Alemania, Argentina, Austria, Canadá, EspaĖa, Finlandia, Israel, Portugal y Nueva Zelanda. Estas formulaciones son en la actualidad:
- Marinol ®: son cápsulas de dronabinol (THC sintético) y están indicadas como estimulante del apetito para evitar la pérdida masiva de peso asociada al síndrome de desgaste en pacientes con SIDA, y para combatir los vómitos y náuseas debido al tratamiento quimioterápico en pacientes con cáncer (60).
- Sativex ®: spray en forma de aerosol de administración oral que contiene THC y CBD en proporciones 1:1 y que se emplea para la espasticidad asociada a la esclerosis múltiple en diversos países europeos, Nueva Zelanda y Canadá. En este último además está indicado para combatir el dolor neuropático asociado a la esclerosis múltiple y el dolor oncológico (60).
- Cesamet ®: cápsulas duras de nabilona (análogo sintético de THC) que se emplea para prevenir los vómitos y nauseas derivados de la quimioterapia en pacientes con cáncer (60).
- El rimonabant fue también aprobado y comercializado para el tratamiento de la obesidad (50). Sin embargo debido a los efectos adversos de carácter psiquiátrico que ocasionaba tales como depresión e ideas suicidas fue retirado.
8. CONCLUSIONES
La participación del SCE en numerosas funciones fisiológicas, y las propiedades antiinflamatorias, neuroprotectoras y antioxidantes que presentan los cannabinoides, los convierte en potenciales alternativas terapéuticas para el tratamiento de diversas enfermedades como trastornos metabólicos, neurológicos, autoinmunes o incluso la terapia antitumoral. No obstante los efectos adversos psicoactivos que caracterizan al cannabis limitan su uso terapéutico. El empleo de cannabinoides no psicoactivos como el CBD o de agonistas selectivos CB2, el desarrollo de formulaciones de acción local que no atraviesen la barrera hematoencefálica, o la formulación de estas moléculas en sistemas que faciliten su vehiculización y modulen su liberación en el organismo pueden ser una buena herramienta para evitar estos efectos y aprovechar las acciones de los cannabinoides en terapéutica.
9. BIBLIOGRAFÍA
1. Szulakowska, A.; Milnerowicz, H. Cannabis sativa in the Light of Scientific Research. Adv Clin Exp Med 16 (6), 807-815 (2007).
2. Izzo, A. A.; Sharkey, K. A. Cannabinoids and the gut: New developments and emerging concepts. Pharmacol Ther 126 (1), 21-38 (2010).
3. Guindon, J.; Hohmann, A. G. The endocannabinoid system and cáncer: therapeutic implication. Br J Pharmacol 163 (7), 1447-1463 (2010).
4. Hermanson, D. J; Marnett L. J. Cannabinoids, Endocannabinoids and Cancer. Cancer Metastasis Rev 30 (3-4), 599-612 (2001).
5. Happyana, N.; Agnolet, S.; Muntendam, R.; Van Dam A.; Schneider, B.; Kayser, O. Annalysis of cannabinoids in laser-microdissected trichomes of medicinal Cannabis sativa using LCMS and cryogenic NMR. Phitochemistry 87, 51-59 (2013).
6. Kalant, H. Medicinal use of cannabis: history and current status. Pain Res Manag 6 (2), 80-91 (2001).
7. Mikuriya, T. H. (1969). Marijuana in medicine: past, present and future. Calif Med 110 (1), 34-40.
8. Touw, M. The religious and medicinal uses of cannabis in China, India and Tibet. J Psychoactive Drugs, 13 (1), 23-31 (1981).
9. Mechoulam, R.; Parker, L.A. The Endoccannabinoid System and the Brain. Annu Rev Psychol. 64, 21-47 (2013).
10. Micale, V.; Di Marzo, V.; Sulcova, A.; Wotjak, C. T.; Drago, F. Endocannabinoid system and mood disorders: priming a target for new therapies. Pharmacol Ther 138, (1), 18-37 (2013).
11. Ben Amar, M. Cannabinoids in medicine: A review of their therapeutic potential. J Ethnopharmacol , 105 (1-2), 1-25 (2006).
12. Hosking, R. D.; Zajicek, J. P. Therapeutic potential of cannabis in pain medicine. Br J Anaesth 101 (1), 59-68 (2008).
13. Pandey, R.; Mousawy, K.; Nagarkatti, M.; Nagarkatti, P. Endocannabinoids and immune regulation. Pharmacol Res, 60 (2), 85-92 (2009).
14. Thakur, G. A.; Duclos, R. I. Jr; Makriyannis, A. Natural cannabinoids: templates
15. Matias, I. ; Di Marzo, V. Endocannabinoid synthesis and degradation, and their regulation in the framework of energy balance. J Endocrinol Invest, 29, 15-26. (2006).
16. Piomelli, D.; Giuffrida A. ; Calignano, A.; Rodríguez de Fonseca, F. The endocannabinoid system as a target for therapeutic drugs. Trends Pharmacol Sci, 21 (6), 218-224 (2000).
17. Felder, C.C.; Dickason-Chesterfield, A.K.; Moore, S. A. Cannabinoids biology: the search for new therapeutic targets. Mol Interv, 6 (3), 149-161.
18. McFarland, M.J.; Barker, E.L. Anandamide transport. Pharmacol Ther, 104 (2), 117-135 (2004).
19. Guzmán, M.; Sánchez, C.; Galve-Roperh, I.Control of the cell survival/death by cannabinoids. J Mol Med (Berl), 78 (11), 613-625 (2001).
20. Hirst, R. A.; Lambert, D. G.; Notcutt, W. G. Pharmacology and potential therapeutic uses of cannabis. Br J Anaesth, 81 (1), 77-84 (1998).
21. McAllister, S. D.; Glass, M. CB1 and CB2 receptor-mediated signalling: a focus on endocannabinoids. Prostaglandins Leukot Essent Fatty Acids, 66 (2-3), 161-171 (2002).
22. Fine, P. G.; Rosenfeld, M. J. The endocannabinoid system, cannabinoids, and pain. Rambam Maimonides Med J, 4 (4), 1-15 (2013).
23. Velasco, G; Galve-Roperh, I.; Sánchez, C.; Blázquez, C.; Guzmán, M. Hypothesis: cannabinoid therapy for the treatment of gliomas ?. Neuropharmacology, 47 (3), 315-323 (2004).
24. Velasco, G.; Galve-Roperh, I.; Sánchez C, Blázquez, C.; Haro, A.; Guzmán, M. Cannabinoids and ceramide: two lipids acting hand-by-hand. Life Sci, 77 (14), 1723-1731 (2005).
25. Munro, S.; Thomas, K. L.; Abu-Shaar, M. Molecular characterization of a peripheral receptor for cannabinoids. Nature, 365 (6441), 61-65 (1993).
26. Herkenham, M.; Lynn, A. B.; Johnson, M. R.; Melvin, L.S.; De Costa, B. R.; Rice, K.C. Characterization and localization of cannabinoid receptors in rat brain: a quantitative in vitro autoradiographic study. J Neurosci, 11 (2), 563-583 (1991).
27. Henstridge, C.M.; Balenga, N. A.; Kargl, J.; Andradas, C.; Brown, A. J.; Irving, A.; Sanchez, C.; Waldhoer, M. Minireview: Recent Developments in the Physiology and Pathology of the Lysophosphatidylinositol-Sensitive Receptor GPR55. Mol Endocrinol, 25 (11), 1835:1848 (2011)
28. Sylantyev, S.; Jensen; T. P.; Ross, R. A.; Rusakov, D. A. Cannabinoid and lysophosphatidylinositol sensitive receptor GPR55 boosts neurotransmitter release at central synapses. Proc Natl Acad Sci USA, 110 (13), 5193-5198 (2013).
29. Izzo, A. A.; Borrelli, F.; Capasso, R.; Di Marzo, V.; Mechoulam, R.Non-psychotropic plant cannabinoids: new therapeutic opportunities from an ancient herb. Trends Pharmacol Sci, 30 (10), 515-527 (2009).
30. Henstridge, C. M. Off target cannabinoid effects mediated by GPR55. Pharmacology, 89 (3-4), 179-187 (2012).
31. Ryberg, E.; Larsson, N.; Sjögren, S.; Hjorth, S.; Hermansson, N. O.; Leonova, J.; Elebring, T.; Nilsson, K.; Drmota, T.; Greasley, P. J. The orphan receptor GPR55 is a novel cannabinoid receptor. Br J Pharmacol, 152 (7), 1092-1101 (2007).
32. Tominaga, M.; Tominaga, T. Structure and function of TRPV. Pflugers Arch, 451 (1), 143-150 (2005).
33. Kola, B.; Boscaro, M.; Rutter, G. A.; Grossman, A. B.; Korbonitis, M. Expanding role of AMPK in endocrinology. Trends Endocrinol Metab, 17 (5), 205-215 (2006).
34. Van Thuijl, H.; Kola, B.; Korbonits, M. Appetite and metabolic effects of ghrelin and cannabinoids: involvement of AMPactivated protein kinase. Vitam Horm, 77, 121-148 (2008).
35. Porter, A. C.; Felder, C. C. The endocannabinoid nervous system: Unique opportunities for therapeutic intervention. Pharmacol Ther, 90 (1), 45-60 (2001).
36. Solinas, M.; Goldberg, S. R.; Piomelli, D. The endocannabinoid system in brain reward processes. Br J Pharmacol, 154 (2), 369-383 (2008).
37. Matias, I.; Bisogno, T.; Di Marzo, V. Endogenous cannabinoids in the brain and peripheral tissues: regulation of their levels and control of food intake. Int J Obes (Lond), 30 (Suppl 1) S7-S12 (2006).
38. Brown, T. T.; Dobs, A. S. Endocrine effects of marijuana. J Clin Pharmaco, 92 (11 suppl), 90S-96S (2002).
39. Battista, N.; Rapino; C.; Di Tommaso, M.; Bari, M.; Pasquariello, N.Ł Maccarrone, M. Regulation of male fertility by the endocannabinoid system. Mol Cell Endocrinol, 286 (1-2 suppl 1), 17S-23S (2008).
40. Cota, D. The role of the endocannabinoid system in the regulation of hypothalamic-pituitary-adrenal axis activity. J Neuroendocrinol, 20 (suppl 1):35-38 (2008).
41. Sun, Y.; Alexander, S. P.; Garle, M. J.; Gibson, C. L.; Hewitt, K.; Murphy, S. P.; Kendall, D. A.; Bennett, A. J. Cannabinoid activation of PPAR alpha; a novel neuroprotective mechanism. Br J Pharmacol, 152 (5), 734-743 (2007).
42. O'Sullivan, S. E. Cannabinoids go nuclear: evidence for activation of peroxisome proliferator-activated receptors. Br J Pharmacol, 152 (5), 576-582 (2007).
43. Duran, M.; Laporte, J. R.; Capellą, D. Novedades sobre las potencialidades terapéuticas del Cannabis y el sistema cannabinoide. Med Clin (Barc), 122 (10), 390-398 (2004).
44. Lunn, C. A.; Fine, J. S.; Rojas-Triana, A.; Jackson, J. V.; Fan, X.; Kung, T.T.; Gonsiorek, W.; Schwarz, M. A., Lavey, B.; Kozlowski, J. A.; Narula, S. K.; Lundell, D. J.; Hipkin, R. W.; Bober, L. A. A novel cannabinoid peripheral cannabinoid receptorselective inverse agonist blocks leukocyte recruitment in vivo. J Pharmacol Exp Ther 316 (2), 780-788 (2006).
45. Howlett, A.C.; Barth, F.; Bonner, T.I.; Cabral, G.; Casellas, P.; Devane, W. A.; Felder, C. C.; Herkenham, M.; Mackie, B. R.; Mechoulam, R.; Pertwee, G. nternational Union of Pharmacology XXVII. Classification of cannabinoid receptors. Pharmacol Rev; 54:161-202 (2002).
46. Pertwee, R. G. Ligands that target cannabinoid receptors in the brain: from THC to anandamide and beyond. Addict Biol; 13 (2), 147-159 (2008).
47. Sagredo, O.; García-Arencibia, M.; De Lago, E.; Finetti, S.; Decio, A.; Fernández-Ruiz, J. Cannabinoids and neuroprotection in basal ganglia disorders. Mol Neurobiol, 36 (1), 82-91 (2007).
48. Pacher, P.; Kunos, G. Modulating the endocannabinoid system in human health and disease--successes and failures. FEBS J, 280 (9):1918-1943 (2013).
49 Booz, G. W. Cannabidiol as an emergent therapeutic strategy for lessening the impact of inflammation on oxidative stress. Free Radic Biol Med, 51 (5), 1054-1061 (2011).
50. Kogan, N. M.; Mechoulam, R. Cannabinoids in health and disease. Dialogues Clin Neurosci. 9 (4), 413-430 (2007).
51. Fernández-Ruiz, J.; Romero, J.; Velasco, G.; Tolón, R. M.; Ramos, J. A.; Guzmán, M. Cannabinoid CB2 receptor: a new target for controlling neural cell survival?. Trends Pharmacol Sci; 28 (1), 39-45 (2007).
52. Croxford, J. L.; Yamamura, T. Cannabinoids and the immune system: potential for the treatment of inflammatory diseases?. J Neuroimmunol, 166 (1-2), 3-18 (2005).
53. Baker, D.; Jackson, S. J.; Pryce, G. Cannabinoid control of neuroinflammation related to multiple sclerosis. Br J Pharmacol, 152 (5), 649-654 (2007).
54. Baker, D.; Pryce, G. The endocannabinoid system and multiple sclerosis. Curr Pharm Des, 14 (23), 2326-2336 (2008).
54. Fernández-Ruiz, J.; Romero, J.; Velasco, G.; Tolón, R. M.; Ramos, J. A.; Guzmán, M. Cannabinoid CB2 receptor: a new target for controlling neural cell survival?. Trends Pharmacol Sci; 28 (1), 39-45 (2007).
55. Ryan, D.; Drysdale, A. J.; Lafourcade, C.; Pertwee, R. G.; Platt, B. Cannabidiol targets mitochondria to regulate intracellular Ca2+ levels. J Neurosci, 29 (7) 2053-2063 (2009).
56. Croxford, J. L.; Yamamura, T. Cannabinoids and the immune system: potential for the treatment of inflammatory diseases?. J Neuroimmunol, 166 (1-2), 3-18 (2005).
56. Saito, V. M.; Rezende, R. M.; Teixeira, A. L. Cannabinoid modulation of neuroinflammatory disorders. Curr Neuropharmacol, 10 (2), 159-66 (2012).
57. Aso, E.; Ferrer, I. Cannabinoids for treatment of Alzheimer's disease: moving toward the clinic. Front Pharmacol, 5, 1-11 (2014).
58. Ruiz-ValdepeĖas, L.; Benito, C.; Tolón, R. M.; Martínez Orgado, J. A.; Romero, J. The endocannabinoid system and amyloid-related diseases. Exp Neurol, 224 (1), 66-73 (2010).
59. Alexander, A.; Smith, P. F.; Rosengren, R. J. Cannabinoids in the treatment of cancer. Cancer Lett, 285 (1), 6-12 (2009).
60. Engels, F. K.; De Jong, F. A.; Mathijssen, R. H.; Erkens J. A.; Herings, R. M.; Verweij, J. Medicinal cannabis in oncology. Eur J Cancer, 43 (18), 2638-2644 (2007).
61. Brown, I.; Cascio, M. G.; Rotondo, D.; Pertwee, R. G.; Heys, S. D.; Wahle, K. W. Cannabinoids and omega-3/6 endocannabinoids as cell death and anticancer modulators. Prog Lipid Res, 52 (1), 80-109 (2013).
62. Baker, D.; Pryce, G.; Giovannoni, G. Thompson, A. J. The therapeutic potential of cannabis. Lancet Neurol, 2 (5):291-298 (2003).
63. Di Marzo, V.; Piscitelli, F.; Mechoulam, R. Cannabinoids and endocannabinoids in metabolic disorders with focus on diabetes. Handb Exp Pharmacol, (203), 75-104 (2011).
64. Horváth, B.; Mukhopadhyay, P.; Haskó, G.; Pacher, P.The endocannabinoid system and plant-derived cannabinoids in diabetes and diabetic complications. Am J Pathol., 180 (2), 432-442 (2012).
65. Pinar-Sueiro, S.; Rodríguez-Puertas, R.; Vecino, E. Aplicaciones de los cannabinoides en glaucoma. Arch Soc Esp Oftalmol, 86 (1), 16-23 (2011).
66. Tomida, I.; Pertwee, R. G.; Azuara-Blanco, A. Cannabinoids and glaucoma. Br J Ophthalmol, 88 (5), 708-713 (2004).
67. Abboud, R. T.; Sanders, H. D. Effect of oral administration of delta-tetrahydrocannabinol on airway mechanics in normal and asthmatic subjects. Chest, 70 (4), 480-485 (1976).
68. Guimarčes, F. S.; Chiaretti, T. M.; Graeff, F. G.; Zuardi, A. W. Antianxiety effect of cannabidiol in the elevated plus-maze. Psychopharmacology, 100 (4), 558-559 (1990).
69. Guimarčes, F. S.; De Aguiar, J. C.; Mechoulam, R.; Breuer, A. Anxiolytic effect of cannabidiol derivatives in the elevated plus-maze. Gen Pharmacol, 25 (1) 161-164 (1994).
70. Hall, W. The adverse health effects of cannabis use: What are they, and what are their implications for policy?. Int J Drug Policy., 20 (6), 458-466 (2009).
71. Danovitch, I.; Gorelick, D. A. State of the art treatments for cannabis dependence. Psychiatr Clin North Am, 35 (2), 309-326 (2012).