REVISIÓN |
Los cocristales farmacéuticos: conceptos generales
Marlene Marcelina Saucedo-Balderas1, Oscar ZúĖiga-Lemus1, David Ortegón-Reyna2, Juan Saulo González-González1*
1Instituto de Farmacobiología, Universidad de la CaĖada,Carretera Teotitlán - San Antonio Nanahuatipán Km 1.7 s/n. Paraje Titlacuatitla. Teotitlán de Flores Magón, Oax. México, C.P. 68540. 2Departamento de Química, CINVESTAV-IPN, Av. Instituto PolitécnicoNacional 2508, Col. San Pedro Zacatenco, Apartado postal: 14-740,07000, C.P. 07360 México, D.F., México
e-mail: juan_saulo@unca.edu.mx
An. Real Acad. Farm. Vol. 80, Nľ 2 (2014), pag. 265-273.
resumen
Los cocristales farmacéuticos surgen como una posibilidad para mejorar las propiedades biofarmacéuticas y farmacotécnicas de un IFA (Ingrediente Farmacéutico Activo). Los cocristales farmacéuticos son sólidos cristalinos constituidos por un IFA y un formador, los cuales se encuentran en la misma celda cristalina. La búsqueda de nuevos cocristales farmacéuticos es competencia de la química supramolecular, ya que el IFA y el formador se mantienen juntos mediante interacciones no covalentes. Existen métodos en solución y en sólidos para la formación de cocristales. Además, este campo ofrece una posibilidad de desarrollo intelectual debido a la posibilidad de patentar los productos, considerando los parámetros regulatorios. Este trabajo presenta los principales conceptos que se consideran para el estudio de estos sólidos farmacéuticos. |
Palabras clave: Química supramolecular; cocristales farmacéuticos; cocristalización.
abstract
Pharmaceutical Cocrystals: General concepts.
Pharmaceutical co-crystals emerge as a possibility to improve the biopharmaceutical properties and pharmacotechnical of an Active Pharmaceutical Ingredient (API). Theco-crystalsare crystalline solids composed of an API and a former, which are located in the same crystal cell. The search for new pharmaceutical co-crystals is the responsibility of supramolecular chemistry, since the formerand the API are held together by non-covalent interactions. Solution and solid state methods are employed for the formation of cocrystals. In addition, this field offers a possibility of intellectual development due to the patentability of products, without neglecting the regulatory aspects. This work presents the main concepts considered for the study of these pharmaceutical solids. |
Keywords: Supramolecular chemistry; active pharmaceutical ingredient; cocrystallization.
1. INTRODUCcióN
La química supramolecular, o química entre moléculas, se encarga del estudio de las interacciones no covalentes presentes entre moléculas diferentes o del mismo tipo, ya sea en estado sólido (empaquetamiento cristalino) o en solución. Estas interacciones se llevan a cabo entre los sitios de reconocimiento de las moléculas (grupos funcionales) y son las responsables de los diferentes arreglos supramoleculares adoptados (1).
El reconocimiento molecular es la base de la química supramolecular, ya que la construcción de cualquier sistema supramolecular involucra combinaciones moleculares selectivas. Las moléculas que hacen el reconocimiento se llaman receptores (host) y aquellas que son reconocidas son conocidas como sustratos (guest), por lo tanto, a la química supramolecular a veces se le conoce como química de receptor-sustrato (host-guest chemistry) (1).
La ingeniería de cristales se encarga de la aplicación de los conceptos de la química supramolecular al estado sólido, enfatizando la idea de que los sólidos cristalinos son manifestaciones de autoensambles de moléculas. Estas estructuras cristalinas pueden ser consideradas como una serie de eventos moleculares de que involucran un reconocimiento molecular mediante interacciones débiles y direccionales. De esta forma, es competencia de la síntesis supramolecular el diseĖo y la preparación de este tipo de materiales cristalinos, entre ellos los cocristales (2).
Un cocristal puede ser definido como un complejo cristalino formado por dos o más especies neutras que se encuentran en la misma celda cristalina y que se mantienen unidas mediante interacciones no covalentes, principalmente por enlaces de hidrógeno (3).
2. cocristales farmacéuticos
La capacidad de liberación de un fármaco dentro del paciente en forma eficiente, segura y barata depende en gran medida de las características fisicoquímicas del ingrediente farmacéutico activo (IFA) (4). La mayoría de los IFAęs son sólidos, por lo que se requiere que se encuentren en estado cristalino debido a su facilidad de obtención y a que el proceso de cristalización ayuda a eliminar las impurezas presentes. Tradicionalmente los IFAęs en estado cristalino se presentan en forma de sales, solvatos y polimorfos (Figura 1).
Los polimorfos son estructuras cristalinas del mismo compuesto que pueden organizarse al menos de dos formas diferentes; cada polimorfo puede presentar propiedades fisicoquímicas diferentes. Los solvatos e hidratos se forman al quedar atrapadas moléculas del disolvente o de agua dentro de la red cristalina; esto puede representar un problema si durante el periodo de almacenamiento las moléculas de disolvente se liberan de la red cristalina puede afectar la estabilidad de la forma farmacéutica. La formación de sales de los IFAęs constituye el principal método para mejorar la solubilidad de los mismos; esto se logra haciendo reaccionar el IFA con un ácido o una base, lo que da como resulta el IFA en forma ionizada (5). En ocasiones estas sales no tienen las propiedades sólidas adecuadas o no pueden formarse debido a la ausencia de grupos ionizables en la estructura química del IFA (6).
Los problemas con el uso de los materiales en estado cristalino son su poca solubilidad y la existencia de más de una forma cristalina de un IFA (polimorfismo). Es aquí donde la ingeniería de cristales ofrece una forma alternativa de presentación de los IFAęs en estado cristalino: los cocristales farmacéuticos.
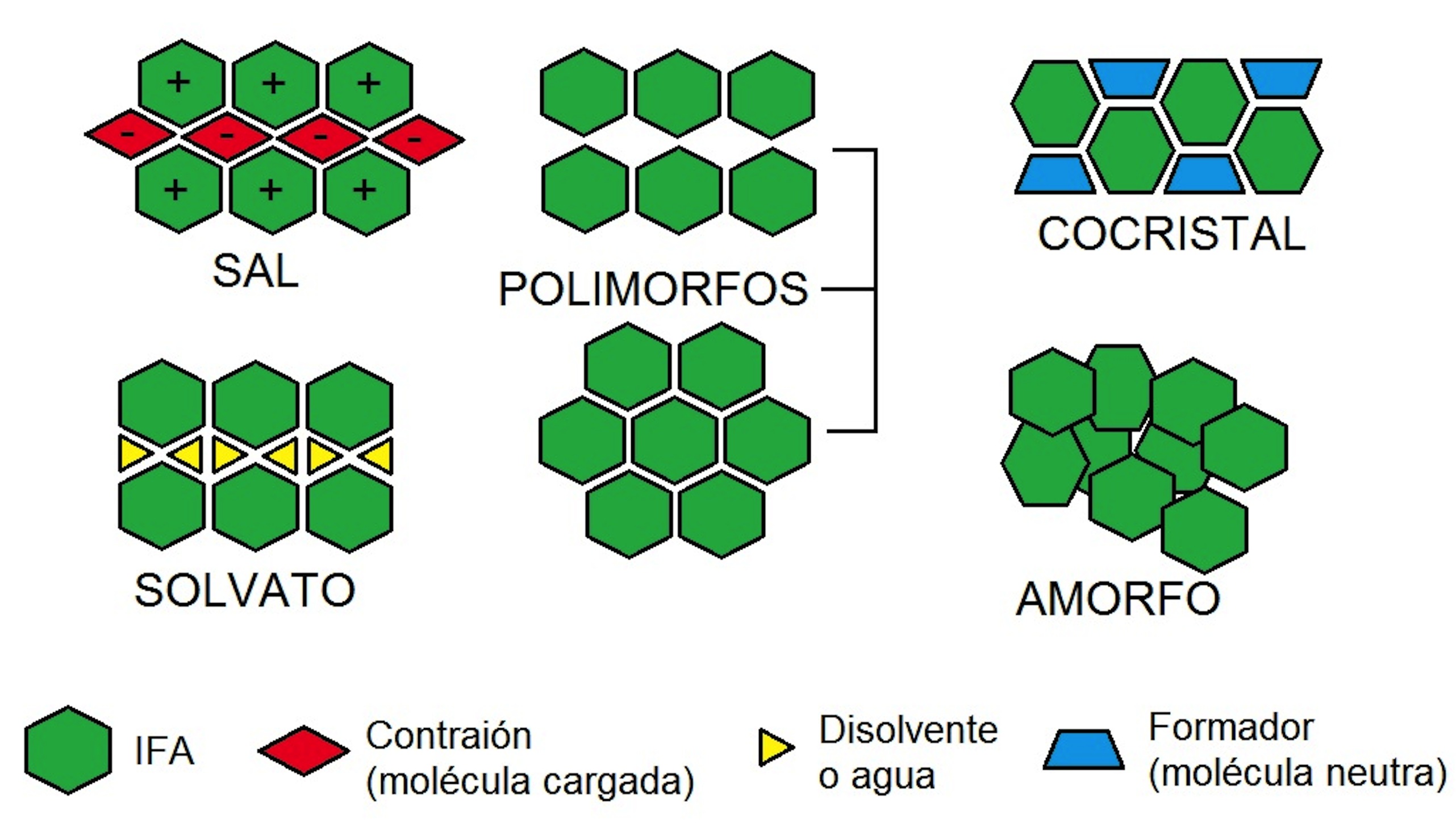
Figura 1.- Sistemas cristalinos de IFAęs.
Los cocristales farmacéuticos (Figura 1) son materiales cristalinos constituidos por un IFA y uno o más agentes formadores de cocristales, los cuales son sólidos a temperatura ambiente (7).
Para el diseĖo de cocristales farmacéuticos debe tomarse en cuenta los grupos funcionales del IFA que permitan el reconocimiento molecular por parte del agente cocristalizante. Para esto se utilizan diferentes sintones supramoleculares, que son moléculas que contienen grupos funcionales que se complementan con los grupos funcionales del IFA, facilitando el reconocimiento molecular (2). Los agentes formadores de cocristales farmacéuticos más comunes son: ácidos, amidas, carbohidratos, alcoholes y aminoácidos (8). La Figura 2 muestra algunos de los principales sintones supramoleculares empleados en la formación de cocristales farmacéuticos.
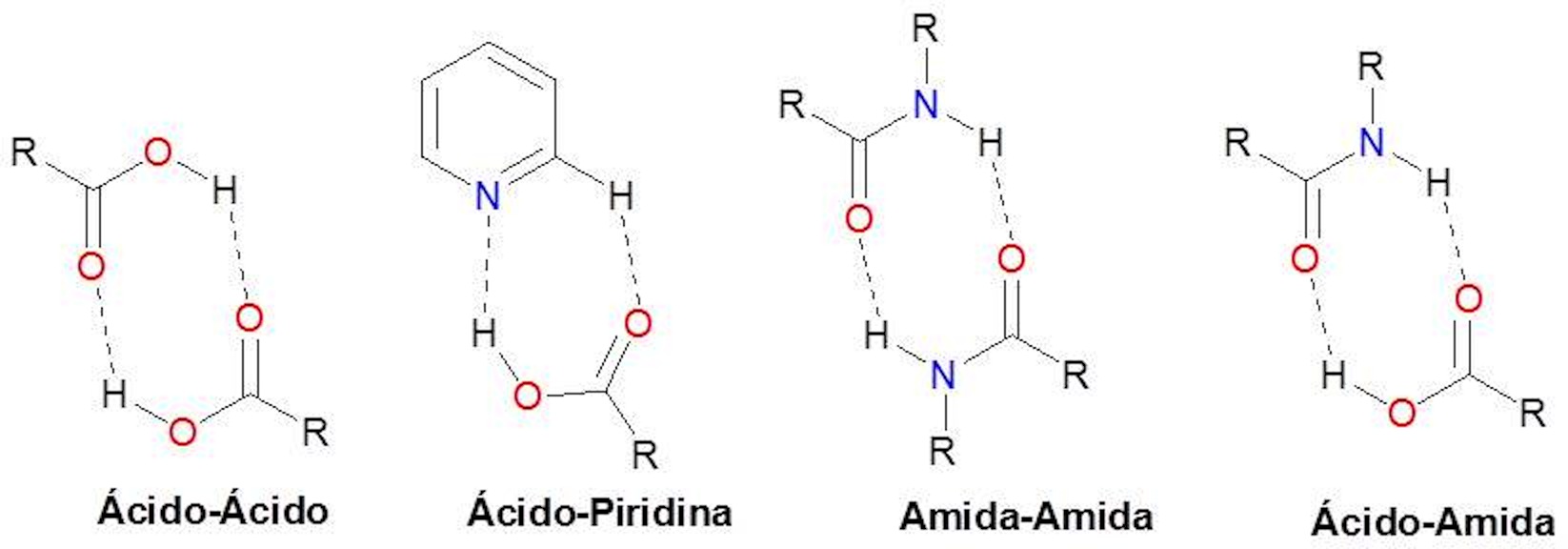
Figura 2.- Sintones supramoleculares empleados en la formación de cocristales farmacéuticos.
Los cocristales representan una forma de modificar las propiedades biofarmaceuticas y farmacotécnicas de un IFA, lo que permite obtener nuevos sólidos farmacéuticos con propiedades distintas de solubilidad, velocidad de disolución, estabilidad fisicoquímica, higroscopicidad (7).
3. PREPARACIÓN DE COCRISTALES FARMACÉUTICOS
Los cocristales farmacéuticos se preparan principalmente por métodos en solución y por métodos en estado sólido.
Los métodos en solución consisten en mezclar cantidades equimolares del IFA y del formador en un disolvente adecuado,con la finalidad de que al evaporarse el disolvente se obtengan los cocristales.
Los métodos sólidos son una aplicación de la síntesis mecanoquímica (8) y consisten en moler en un mortero o en un molino, cantidades equimolares del IFA y del formador. Una modificación de esta técnica consiste en agregar gotas de algún disolvente al momento de hacer la molienda (9-12).
Otros métodos reportados para la formación de cocristales farmacéuticos son: la adición de antisolventes (13), cocristalización asistida por ultrasonido(14), cocristalización con fluidos supercríticos (15) y cocristalización por slurryng o suspensión (16).
4. CARACTERIZACIÓN DE COCRISTALES FARMACÉUTICOS
La caracterización estructural de los cocristales se realiza utilizando técnicas como espectrofotometría de infrarrojo (IR), difracción de rayos X de monocristal, difracción de rayos X de polvos y resonancia magnética nuclear. Mientras que la caracterización física se determina el punto de fusión y se utilizan técnicas de calorimetría diferencial de barrido DSC y análisis termogravimétrico (TGA) (17).
La espectrofotometría de IR y Raman permiten identificar desplazamientos en las frecuencias vibracionales de los grupos funcionales involucrados en las interacciones no covalentes encargadas de la formación del cocristal (18-19).
La difracción de rayos X de monocristal (XRD) es la técnica más utilizada para conocer la estructura molecular de un cocristal farmacéutico (20-22), sin embargo, como no todos los cocristales forman monocristales, se recurre a la difracción de rayos X de polvos (PXRD), en la cual, se obtienen los difractogramas del IFA y del formador y se comparan con el difractograma del cocristal en busca de nuevas fases cristalinas (23-25).
La calorimetría diferencial de barrido permite obtener información acerca de los procesos de fusión, obteniendo las temperaturas de transiciones de fase y entalpías de fusión que presentan los cocristales en comparación con el formador y el IFA (26-27).
5. propiedades físicas de los cocristales farmacéuticos
Al igual que con cualquier otro polvo farmacéutico, es necesario estudiar las propiedades fisicoquímicas de un cocristal con la finalidad de determinar su posible uso como en una aplicación comercial garantizando la estabilidad seguridad en una forma farmacéutica. Estas propiedades incluyen el punto de fusión, solubilidad, disolución y estabilidad (3).
5.1 Punto de fusión
El punto de fusión es una propiedad física y fundamental de los sólidos que se utiliza para como indicador de pureza y caracterización. Es la temperatura a la cual se encuentran en equilibrio la fase sólida y la fase líquida. Ésta puede ser determinada utilizando un fusiómetro o, preferentemente, la calorimetría diferencial de barrido (DSC), ya que esta última aporta información acerca de la entalpía de fusión del sólido.
Se ha observado que los puntos de fusión de un cocristal cambian con respecto a los puntos de fusión individuales del IFA y del formador, pudiendo quedar dentro del rango formado por las temperaturas de fusión del IFA o del formador; o por encima o por debajo de dicho rango. Esto debido a los arreglos moleculares presentes en la celda cristalina del cocristal que difieren de los arreglos cristalinos en las formas libres del IFA y del formador (17, 26-27).
5.2 Estabilidad
Es una de las pruebas más importantes para evaluar un cocristal farmacéutico. Las pruebas de estabilidad incluyen. Se realizan diferentes pruebas de estabilidad dependiendo de la estructura y de las características de las moléculas.
Se realizan pruebas de estabilidad acelerada de temperatura y humedad con la finalidad de identificar las mejores condiciones de almacenamiento del producto(28). La cocristalización de la cafeína con ácidos dicarboxílicos ha permitido solucionar el problema de hidratación que presenta la cafeína (29).
La estabilidad de disolución es la capacidad que tienen los componentes del cocristal de permanecer en solución y no cristalizar. Esta prueba da indicios acerca de la posible disociación o precipitación de los componentes del cocristal. En estos estudios se simulan las condiciones de los fluidos gástricos o intestinales con la finalidad de asegurar la solubilidad y la velocidad de disolución (30).
5.3 Solubilidad
La búsqueda en la mejora de la solubilidad de los IFAęs (31) es lo que ha conducido al desarrollo de los cocristales farmacéuticos. En este caso se evalúa, en diferentes medios, el perfil de disolución del IFA en forma libre con el perfil de disolución del IFA en el cocristal. Se han reportado revisiones en donde se muestran ejemplos acerca de la mejoría en la solubilidad de un IFA en forma de cocristal con respecto al fármaco libre (32-33).
5.4 Biodisponibilidad
La biodisponibilidad es la cantidad y velocidad con la que un IFA llega a la circulación sistémica. Uno de los objetivos principales del desarrollo de los cocristales farmacéuticos es que mediante la formación de un cocristal, un IFA pueda aumentar su biodisponibilidad. Se llevan a cabo estudios en los que se compara la biodisponibilidad del IFA en forma libre con la del IFA en forma de cocristal. Algunos fármacos cuya biodisponibilidad aumenta en forma de cocristal son la quercetina (34), la carbamazepina (35) y la iloperidona (36).
6. COCRISTALES Y PROPIEDAD INTELECTUAL
La formación de cocristales farmacéuticos ofrece un campo de investigación floreciente con aplicación directa a la industria farmacéutica. Los cocristales farmacéuticos son patentables si cumplen con los criterios de novedad, utilidad y no obviedad. Como parte de una amplia cartera de patentes en forma sólida, los cocristales farmacéuticos pueden ofrecer una ventaja comercial distinta respecto de la exclusividad en el mercado (37).
7. MARCO REGULATORIO
La FDA clasifica a los cocristales farmacéuticos como “complejos moleculares disociables IFA-excipiente”, en el que el agente cocristalizante se considera como un excipiente. Por lo tanto, un IFA que ha sido procesado con un excipiente cocristalizante debe ser tratado como un producto intermediario farmacéutico.
Para la solicitud de nuevos fármacos que contengan o digan contener cocristales farmacéuticos, se debe tener evidencia que cumpla dos criterios:
-Que el IFA y el excipiente se encuentran en forma neutra y que interaccionan de manera no iónica.
-Que la disociación completa entre el excipiente y el IFA ocurre antes de que este último llegue a su sitio de acción farmacológica.
Un cocristal IFA-excipiente que cumple con estas condiciones se considera como un cocristal farmacéutico y obtiene la clasificación regulatoria de producto intermedio, el cual no se considera como un nuevo IFA, sino como un intermediario farmacéutico cocristalino (38).
8. COCRISTALES FARMACÉUTICOS DE INTERÉS
En varias revisiones se muestra que los sistemas cocristalinos farmacéuticos más estudiados involucran los siguientes IFAęs: acetaminofén, acetazolamida, alprazolam, carbamazepina, cafeína, citosina, ibuprofeno, efavirenz, etenzamida, fluconazol, indometacina, isoniazida, lamotrigina, lidocaína, mefloquina, meloxicam, minoxidil, pterostilbeno, nifedipina, piracetam, quinidina, espironolactona, ácido salicílico, teofilina (39-40).
9. CONCLUSIÓN
La búsqueda de nuevos cocristales farmacéuticos es un área con un gran potencial de desarrollo, debido a las mejoras en las propiedades de los IFAęs. Para lograr esto se debe poner especial atención en las posibles interacciones no covalentes que puede formar el IFA y elegir el sintón supramolecular adecuado para la formación del cocristal, así como también la técnica que se empleará para prepararlos. Todo esto permite obtener productos farmacéuticos novedosos que son patentables, sin dejar de lado el aspecto regulatorio.
10. AGRADECIMIENTOS
Al Consejo Nacional de Ciencia y Tecnología de México (CONACyT) por el financiamiento (proyecto 179674) otorgado.
11. rEFERENCIaS
1. Steed, J. W.; Atwood, J. L.; Supramolecular Chemistry;Second Ed; John Wiley & Sons, Ltd.; UK, 2009; p 27.
2. Almarsson, Ö.; Zaworotko, M. J. Crystal engineering of the composition of pharmaceutical phases. Do pharmaceutical co-crystals represent a new path to improved medicines? Chem. Comm.7, 1889-1896 (2004).
3. Schultheiss, N.; Newman, A. Pharmaceutical Cocrystals and Their Physicochemical Properties. Cryst. Growth Des.9, 2950-2967 (2009).
4. Mirza, S.; Miroshnyk, I.; Heinämäki, J.; Yliruu, J. Co-crystals: An emerging approach for enhancing properties of pharmaceutical solids. Dosis24, 90-96 (2008).
5. Jones, W.; Motherwell, W. D. S.; Trask, A. V. Pharmaceutical Cocrystals: An Emerging Approach to Physical Property Enhancement. MRS Bull.31, 875-879 (2006).
6. Sekhon, B. S. Pharmaceutical co-crystals - a review. ARS Pharm.50, 99-117 (2009).
7. Herrera Ruiz, D. ņQué sabe Ud. acerca de… los co-cristales farmacéuticos? Rev. Mex. Cienc. Farm.41, 55-56 (2010).
8. Delori, A.; Friscic, T.; Jones, W. The role of mechanochemistry and supramolecular design in the development of pharmaceutical materials.CrystEngComm14, 2350-2362 (2012).
9. Prasad, R. V.; Rakesh, M. G.; Jyotsna, R. M.; Mangesh, S. T.; Anita, P. S.;Mayur, P. K. Pharmaceutical Cocrystallization: A Review. IJPCS.3, 725-736 (2012).
10. Friscic, T.; Jones, W. Recent Advances in Understanding the Mechanism of Cocrystal Formation via Grinding. Cryst. Growth Des.9, 1621-1637 (2009).
11. Weyna, D. R.; Shattock, T.; Vishweshwar, P.; Zaworotko, M. J. Synthesis and Structural Characterization of Cocrystals and Pharmaceutical Cocrystals: Mechanochemistryvs Slow Evaporation from Solution. Cryst. Growth Des.9, 1106-1123 (2009).
12. Lin, H.-L.; Wu, T.-K.; Lin, S.-Y. Screening and characterization of cocrystal formation of metaxalonewith short-chain dicarboxylic acids induced by solvent-assistedgrinding approach. Thermochim. Acta575, 313-321 (2014).
13. Ober, C. A.; Montgomery, S. E.; Gupta, R. B. Formation of itraconazole/L-malic acid cocrystals by gas antisolventcocrystallization. Powder Technol.236, 122-131 (2013).
14. Aher, S.; Dhumal, R.; Mahadik, K.; Paradkar, A.; York, P. Ultrasound assisted cocrystallization from solution (USSC) containing a non-congruently soluble cocrystal component pair: Caffeine/maleic acid. Eur. J. of Pharm. Sci.41, 597-602 (2010).
15. Padrela, L.; Rodrigues, M. A.; Tiago, J.; Velaga, S. P.; Matos, H. A.; Azevedo, E. G. Tuning physicochemical properties of theophylline bycocrystallization using the supercritical fluid enhancedatomization technique. J.of Supercritical Fluids86, 129-136 (2014).
16. Kojima, T.; Tsutsumi, S.; Yamamoto, K.; Ikeda, Y.; Moriwaki, T. High-throughput cocrystal slurry screening by use of in situ Raman microscopy and multi-well plate. Int. J. of Pharm.399, 52-59 (2010).
17. Nanjwade, V. K.; Manvi, F. V.; Shamrez, A. M.; Nanjwade, B. K.;Maste, M. M. (2011). New Trends in the Co-crystallization of Active Pharmaceutical Ingredients.J. of Appl. Pharm. Sci.1, 1-5.
18. Ali, H. R. H.; Alhalaweh, A.; Mendes, N. F. C.; Ribeiro-Claro, P.;Velaga, S. P. Solid-state vibrational spectroscopic investigation of cocrystals and salt of indomethacin. CrystEngComm.14, 6665-6674 (2012).
19. Castro, R. A. E.; Ribeiro, J. D. B.; Maria, T. M. R.; Silva, M. R.; Yuste-Vivas, C.; Canotilho, J.; Eusebio, M. E. S. Naproxen Cocrystals with Pyridinecarboxamide Isomers. Cryst. Growth Des.11, 5396-5404 (2011).
20. Bathori, N. B.; Lemmerer, A.; Venter, G. A.; Bourne, S. A.; Caira, M. R. Pharmaceutical Co-crystals with Isonicotinamide;Vitamin B3, Clofibric Acid, and Diclofenac-and Two Isonicotinamide Hydrates. Cryst. Growth Des.11, 75-87 (2011).
21. Leyssens, T.; Springuel, G.; Montis, R., Candoni, N.; Veesler, S. Importance of Solvent Selection for Stoichiometrically Diverse Cocrystal Systems: Caffeine/Maleic Acid 1:1 and 2:1 Cocrystals. Cryst. Growth Des. 12, 1520-1530 (2012).
22. Aitipamula, S.; Chowa, P. S.; Tan, R. B. H. (2009). Theophylline–gentisic acid (1/1).ActaCrystallogr., Sect. E: Struct. Rep. OnlineE65, o2126-o2127.
23. Karki, S.; Fabian, L.; Friscic, T.; Jones, W. Powder X-ray Diffraction as an Emerging Method to Structurally Characterize Organic Solids. Org. Lett.9, 3133-3136 (2007).
24. Chieng, N.; Hubert, M.; Saville, D.; Rades, T.; Aaltonen, J. Formation Kinetics and Stability of Carbamazepine-NicotinamideCocrystals Prepared by Mechanical Activation. Cryst. Growth Des.9, 2377-2386 (2009).
25. Bucar, D.K.; Henry, R. F.; Lou, X.; Richard W. D; MacGillivray, L. R.; Zhang, G. G. Z. Cocrystals of Caffeine and Hydroxybenzoic Acids Composed of Multiple SupramolecularHeterosynthons: Screening via Solution-Mediated Phase Transformation and Structural Characterization. Cryst. Growth Des.9, 1932-1943 (2009).
26. Lu, E.; Rodríguez-Hornedo, N.; Suryanarayanan, R. A rapid thermal method for cocrystal screening.CrystEngComm.10, 665-668 (2008).
27. Sun, C. C.; Hou, H. Improving Mechanical Properties of Caffeine and Methyl Gallate Crystals by Cocrystallization. Crystal Growth Des.8, 1575-1579 (2008).
28. International Conference on Harmonization (ICH). ICH Harmonized Tripartite Guideline: Stability Testing of New Drugs Substances and Products Q1A(R2) (2003). http://www.ich.org/products/guidelines/quality/quality-single/article/stability-testing-of-new-drug-substances-and-products.html
29. Trask, A. V.; Motherwell, W. D. S.; Jones, W. Pharmaceutical Cocrystallization: Engineering a Remedy for Caffeine Hydration. Cryst. Growth Des.5, 1013-1021 (2005).
30. Tomaszewska, I.;Karki, S.; Shur, J.; Price, R.; Fotaki, N. Pharmaceutical characterisation and evaluation of cocrystals: Importance of in vitro dissolution conditions and type of coformer. Int. J. Pharm.453, 380-388 (2013).
31. Mohanachandran, P. S.; Sindhumol, P. G.; Kiran, T. S. Enhancement of solubility and dissolution rate: An overview. Pharm. Globale, 4, 1-10 (2010).
32. Thakuria, R.; Delori, A.; Jones, W.; Lipert, M. P.; Roy, L.; Rodríguez-Hornedo, N. Pharmaceutical cocrystals and poorly soluble drugs. Int. J. Pharm.453, 101-125 (2013).
33. Elder, D. P.; Holm, R.; Diego, H. L. Use of pharmaceutical salts and cocrystals to address the issue of poor solubility. Int. J. Pharm., 453, 88-100 (2013).
34. Smith, A. J.; Kavuru, P.; Wojtas, L.; Zaworotko, M. J.; Shytle, R. D. Cocrystals of Quercetin with Improved Solubility and Oral Bioavailability. Mol. Pharm.8, 1867-1876 (2011).
35. Hickey, M. B.; Peterson, M. L.; Scoppettuolo, L. A.;Morrisette, S. L.; Vetter, A.; Guzmán, H., Remenar, J. F.; Zhang, Z.; Tawa, M. D.; Haley, S.; Zaworotko, M. J.; Almarsson, O. Performance comparison of a co-crystal of carbamazepine with marketed product. Eur. J. of Pharm. Biopharm.,67, 112-119 (2007).
36. Zhang, T.-T.; Wang, H.-T.; Jia, J.-T.; Cui, X.-Q.; Li, Q.;Zhu, G.-S. Syntheses and pharmacokinetics properties of an iloperidone pharmaceutical cocrystal. Inorg. Chem. Commun. 39, 144-146 (2014).
37. Trask, A. V. An Overview of Pharmaceutical Cocrystals as Intellectual Property.Mol. Pharm.4, 301-309 (2007).
38. Center for Drug Evaluation and Research. Regulatory Classification of Pharmaceutical Co-Crystals. United States Food and Drug Administration (2013). http://www.fda.gov/downloads/Drugs/Guidances/UCM281764.pdf
39. Brittain, H. G. Cocrystal Systems of Pharmaceutical Interest: 2011. Cryst. Growth Des.12, 5823-5832 (2011).
40. Brittain, H. G. Cocrystal Systems of Pharmaceutical Interest: 2010. Cryst. Growth Des.12, 1046-1054 (2012).