ARTÍCULO |
Estandarización de un modelo murino de malaria cerebral en fases clínicas para la evaluación de terapias antimaláricas y de rescate
Gabriela Martínez 1, María Linares 1,2ŗ, Patricia Marín-García 1,2ī, Susana Pérez-Benavente 1, Antonio Puyet 1,2, José M. Bautista 1,2 * y Amalia Díez 1,2
1Departamento de Bioquímica y Biología Molecular IV; Universidad Complutense de Madrid; Ciudad Universitaria; 28040 Madrid, EspaĖa. 2Instituto de Investigación Hospital 12 de Octubre, Madrid, EspaĖa. ŗDirección actual: Diseases of the Developing World, GlaxoSmithKline, 28760 Tres Cantos, Madrid, EspaĖa. īDirección actual: Departamento de Medicina Preventiva y Salud Publica & Inmunología y Microbiología médicas. Universidad Rey Juan Carlos, 28922 Alcorcón Madrid, EspaĖa.
e-mail: jmbau@vet.ucm.es
Premio Real Academia Nacional de Farmacia del Concurso Científico de la Real Academia Nacional de Farmacia 2012. An. Real Acad. Farm. Vol 79, Nľ 2 (2013), pag. 274-292
RESUMEN
Entre las enfermedades infecciosas más devastadoras del SNC se incluye la MC, debido a la alta mortalidad y las graves secuelas que ocasiona. Actualmente, no existe tratamiento farmacológico específico, ni de rescate de lesiones neurocognitivas residuales, y su desarrollo está limitado por la inexistencia de modelos experimentales bien definidos. En este trabajo se caracterizó fenotípicamente la infección en un modelo murino de MC evaluando parámetros clínicos que permitieron establecer cuatro estadios de la enfermedad. Este protocolo proporciona el marco experimental adecuado para estudiar terapias coadyuvantes neuroprotectoras que puedan prevenir y/o eliminar las secuelas neurológicas presentes en los individuos que sobreviven. |
Palabras clave: Malaria Cerebral; Artesunato; Plasmodium berghei ANKA.
ABSTRACT
Standardization of a cerebral malaria murine model in clinical stages for antimalarial and rescue therapies evaluation
Cerebral malaria (CM) is included among the more devastating SNC infectious diseases due to its high mortality and severe sequelae in children. Currently, no specific pharmacological treatment for CM or rescue therapy for neurocognitive residual injury are available, and research on this topic has been hampered due to the lack of well-defined experimental models. In the present study we have characterized the CM murine infection phenotypically, evaluating clinical parameters, which allowed establishing a model encompassing four distinct disease stages. This protocol provides the experimental framework to study adjunctive neuroprotective therapies that may prevent and/or eliminate the neurological sequelae in individuals surviving CM. |
Keywords: Cerebral Malaria; Artesunate; Plasmodium berghei ANKA.
1. introducCIÓn
La malaria es la infección parasitaria más importante en el mundo por su elevada tasa de morbilidad, mortalidad e impacto socioeconómico que ocasiona en la población humana (1). Cada aĖo se diagnostican alrededor de 200 a 300 millones de nuevos casos de malaria, de los cuales se calcula que aproximadamente 600.000 mueren a consecuencia de la infección y más del 90% de ellos ocurren en África (2).
Los síntomas clínicos de la enfermedad difieren desde la manifestación única de cuadros febriles leves (malaria no complicada) hasta la aparición de una malaria severa, que puede llegar a ser letal (3). La mayoría de los casos de malaria severa, y de las muertes asociadas a ella, se producen debido al paludismo ocasionado por P. falciparum, especie responsable de la forma más grave de malaria humana. La malaria grave es un trastorno multisistémico que afecta a varios tejidos y órganos, aunque sus manifestaciones clínicas más marcadas implican generalmente a un solo órgano, como es el caso del cerebro en la malaria cerebral (4). La malaria cerebral (MC) es una de las complicaciones más frecuentes y serias de todas las que ocurren, cursa con alteraciones neurológicas diversas, asociándose con la aparición de delirio y progresión al coma que desemboca en la muerte del paciente en un período relativamente corto de tiempo si no se administra atención médica adecuada (3, 5, 6). Incluso con el tratamiento correcto, la tasa de letalidad entre los niĖos con malaria cerebral se aproxima a 20% (7). Esta forma severa con rasgos de encefalopatía difusa aguda hace de la malaria por P. falciparum la infección parasitaria con mayor importancia del SNC afectando principalmente a niĖos de dos a cinco aĖos, mujeres embarazadas y turistas que visitan zonas de alto riesgo, aunque las manifestaciones clínicas en niĖos y adultos son distintas (8, 9).
Aunque la malaria cerebral puede llegar a ser fatal en un 15-30% de los casos que la padecen, es potencialmente reversible y generalmente los pacientes que sobreviven a la enfermedad sufren una recuperación completa de las deficiencias físicas y neurológicas observadas, restableciendo la consciencia tras 2‑3 días de tratamiento antimalárico (9, 10). Sin embargo, se ha visto que a pesar de la eficacia en la terapia antimalárica, algunos individuos que sobreviven a la MC mantienen graves secuelas neurológicas a largo plazo (11-13). Dichas secuelas pueden llegar a ser fatales pocos meses después de haber superado la enfermedad (14, 15).
La variabilidad individual en los síntomas que cursan los pacientes con malaria cerebral refleja que, a pesar de utilizar criterios médicos estandarizados para su diagnóstico, es un síndrome clínico heterogéneo (16). La irritabilidad, inquietud o comportamiento psicótico pueden ser los primeros signos de compromiso cerebral (17). Posteriormente pueden observarse convulsiones, incremento del tono muscular, hiperreflexia, clonus, rigidez, postura extensora, reflejos de extensión plantar, movimientos oculares y cambios en la pupila, mirada divergente, pérdida de la conciencia y coma (7, 8, 18, 19). Por último, la aparición de acidosis metabólica causada por una insuficiencia renal aguda, por acidosis láctica o por ambas; así como hipoglucemia, anemia, ictericia, acidosis respiratoria y edema pulmonar (8, 9, 13, 18, 20) son también rasgos colaterales que se asocian a esta afección grave de malaria.
De todas las poblaciones con riesgo a sufrir MC los daĖos cognitivos a largo plazo son más habituales en niĖos del África subsahariana (11, 21), y entre ellos se incluyen déficits en las áreas de la memoria, atención y desórdenes del lenguaje, problemas de comportamiento, daĖos en la visión, audición y tacto, pero también epilepsia y disfunciones motoras, como ataxia y parálisis (11, 13, 15, 18, 21), siendo más graves en aquellos casos que han sufrido un coma profundo (11). Los daĖos neurológicos pueden manifestarse durante la fase de recuperación, o bien pueden desarrollarse más tarde (15). Muchas veces las secuelas menos graves se hacen más aparentes según el niĖo avanza en edad y, de hecho, el daĖo cognitivo parece agravarse en el tiempo (14, 15).
El tratamiento actual para la malaria severa y cerebral consiste en la administración inmediata, y a dosis elevadas, de antimaláricos por vía parenteral con el objetivo de disminuir rápidamente la parasitemia, evitando así la muerte del paciente. Los fármacos aprobados y actualmente disponibles para dicho tratamiento son los alcaloides de quinina (quinina y quinidina) y los derivados de la artemisina (artesunato, artemeter, artemotil) (22). No obstante, dentro de las recomendaciones terapéuticas establecidas por la WHO se dejan en un segundo plano la prevención de las secuelas o el recrudecimiento de la enfermedad, posiblemente debido al desconocimiento que aun existe sobre las causas del daĖo cognitivo a largo plazo y la falta de información o de estudios clínicos en relación a terapias que minimicen dicho daĖo (23, 24).
El estudio del progreso de la infección en humanos está fundamentalmente limitado a muestras post mórtem las cuales son de difícil adquisición. Esta limitación hace de los modelos animales una herramienta necesaria en los estudios experimentales de la progresión de MC, los cuales aunque no reproducen en su totalidad las características patológicas expresadas en el hombre (9), permiten el análisis más detallado de los cambios ocurridos durante la infección cerebral (19, 25). El modelo experimental más aceptado en numerosos laboratorios para el estudio de la MC es el que utiliza la infección de ratones de la estirpe C57BL/6 con P. berghei ANKA (9, 26). Dicho modelo ha sido muy explotado para identificar los mecanismos implicados en la patogénesis de esta infección cerebral, sin embargo ha sido poco utilizado para evaluar la eficacia de posibles tratamientos farmacológicos específicos para malaria cerebral y en terapias de rescate que prevengan los daĖos cognitivos ocasionados (27-29). Esto es debido a las diferencias intrínsecas del propio modelo para manifestar los rasgos clínicos que se desarrollan comúnmente en la malaria cerebral humana, por lo que resulta difícil establecer estadios claros de evolución durante el avance de la patología, obstaculizando así la elaboración de protocolos de tratamiento efectivos y la evaluación clínica y bioquímica del individuo durante y después de la infección (9, 30).
2. MATERIAL Y MÉTODOS
Todos los experimentos fueron realizados en la Universidad Complutense de Madrid de acuerdo a las directrices del Consejo Internacional para Animales de Experimentación.
2. 1. Modelo animal e infección experimental
En todos los ensayos realizados en el presente trabajo se ha utilizado como modelo experimental de malaria cerebral la infección de ratones macho de la cepa C57BL/6 (Harlan Ibérica, Barcelona, EspaĖa) de 4-5 semanas de edad con el parásito Plasmodium berghei (ANKA), el cual es capaz de inducir el desarrollo de malaria cerebral en los animales infectados en un tiempo de 7 a 14 días. En los grupos experimentales la infección se inicia mediante la inyección intraperitonial de los ratones con 5x106 glóbulos rojos infectados con P. berghei (ANKA) procedentes de un ratón donante de la cepa BALB/c, ya que esta cepa desarrolla parasitemias sanguíneas más elevadas y permite reducir el número de animales donantes. A los ratones del grupo control no se les infecta y se les inyecta una dilución equivalente de eritrocitos sanos de la misma cepa de ratón BALB/c. Dado que diversos estudios sugieren que los parásitos son incapaces de producir suficiente ácido paraaminobenzoico (PABA) para sobrevivir tras la infección (31) se aĖadió, en el agua de bebida, PABA a una concentración del 0,05%.
2.2. Valoración clínica del desarrollo de malaria cerebral en el modelo murino
El progreso de la infección fue analizado diariamente en todos los ensayos in vivo mediante la determinación de los niveles de parasitemia en sangre periférica utilizando frotis sanguíneos, teĖidos con la solución de Wright’s (Merck) seguido del contaje al microscopio de los eritrocitos infectados. Las alteraciones neurológicas asociadas a MC fueron establecidas también diariamente mediante parámetros definidos por el protocolo SHIRPA de evaluación del comportamiento (32). Así, mediante la observación detallada de los animales, se valoró la presencia de erizamiento del pelo, temblor, baja respuesta a estímulos, parálisis, lateralización, desviación de la cabeza, vueltas sobre sí mismo, ataxia, elevación de las patas traseras y convulsiones. La capacidad de movimiento de los ratones fue analizada aplicándoles un test de frecuencia motora descrito previamente (32, 33). Además de los síntomas neurológicos, se determinó, en días alternos, la concentración de hemoglobina en sangre durante el progreso de la infección, usando el reactivo de Drabkin (34) (SIGMA-Aldrich).
2.3. Ensayo de permeabilidad de la barrera hematoencefálica (BHE)
El análisis de la integridad de la BHE se realizó inyectando intraperitonealmente a los ratones 200ĶL de solución de Evans Blue (35) al 2% en solución salina. Una hora más tarde se sacrifican los animales mediante dislocación cervical y se les extrae el cerebro para observar, de acuerdo al grado de tinción azul del tejido cerebral, el posible daĖo en la permeabilidad de la barrera.
2.4. Tratamiento antimalárico con Artesunato en el modelo murino de malaria cerebral
La terapia con Artesunato en el modelo experimental de MC utilizado se llevó a cabo administrando 5 únicas dosis del fármaco bajo una pauta de orden diaria (OD). El tratamiento se inició en los ratones infectados cuando manifestaban signos y síntomas claros de una malaria cerebral estándar (EMC) y en los ratones que no desarrollaban MC, cuando estos presentaran síntomas graves de decaimiento general, con ciertas similitudes al momento elegido en los animales con EMC, pero en ausencia de síntomas de deterioro neurológico. A todos los animales seleccionados se les administró una dosis de 32mg artesunato/kg de peso disuelto en bicarbonato de sodio al 5% (grupo Artesunato). Los grupos control del tratamiento para cada fenotipo de la enfermedad recibieron solución de bicarbonato de sodio al 5% siguiendo la misma pauta de administración (vehículo) (Figura 1).
Figura 1.- Esquema del tratamiento antimalárico con Artesunato.
La eficacia de la terapia farmacológica administrada se determinó mediante la valoración del curso y/o reversión de la enfermedad tras el tratamiento en los distintos grupos de animales, utilizando los test y métodos mencionados en la estandarización del modelo.
3. RESULTADOS
3.1. Caracterización clínica del modelo murino de malaria cerebral
Las investigaciones sobre el curso de la infección malárica cerebral no es posible llevarlas a cabo en humanos por lo que, a pesar de sus imperfecciones, se hace necesario el uso de modelos animales. Aunque el modelo murino de ratones C57BL/6 infectados con Plasmodium berghei ANKA tiene limitaciones, es el que actualmente presenta mayores similitudes con la patología humana (9, 26).
El estudio detallado del progreso de la infección mediante cuantificación de la parasitemia y pruebas neurológicas llevado a cabo en este trabajo puso de manifiesto la heterogeneidad del modelo al momento de expresar o no síntomas neurocognitivos y motores asociados a MC. Debido a esta heterogeneidad fenotípica observada durante el curso de la enfermedad, clasificamos a los animales en dos grandes grupos, según las diferencias en los valores de parasitemia, expresión de síntomas neurológicos y curso de la enfermedad. En el grupo de malaria cerebral estándar (EMC), quedaron incluidos los animales infectados que expresaban un fenotipo clínico propio de malaria cerebral, caracterizado por el deterioro neurológico progresivo en ausencia de elevadas parasitemias. Aquellos ratones que desarrollaron parasitemias más altas a las obtenidas por EMC, con ausencia de daĖo neurológico y otros parámetros asociados a la patología cerebral, se incluyeron en el grupo de ratones sin malaria cerebral (SMC).
Los ratones del grupo que desarrollaron EMC mostraron cambios clínicos progresivos, que comenzaron con la expresión de síntomas tempranos de infección malárica seguida de signos claros de daĖo neurológico que iban aumentando en severidad según progresaba la infección (Figura 2).
Figura 2.- Identificación de estadios neurológicos en la MC. A, controles. B, ratones sin síntomas neurológicos. Estadio I. C, Ratón con síntomas neurológicos incipientes propios del Estadio II (Lateralización o hemi-parálisis), D, Síntomas anteriores remarcados en el Estadio III. E, Los síntomas neurológicos empeoran en el Estadio IV con inclusión de parálisis severa. F, Heterogeneidad en la progresión de la MC observada en 3 ratones (barras horizontales) dentro de un mismo grupo experimental. La barra vertical representa la heterogeneidad del estado general del ratón en el tiempo específicamente en el día 6 post-infección. G, % de parasitemia promedio durante cada estadio y el tiempo (días p.i.) promedio de expresión en el curso de la infección.
Por ello, en los animales con EMC definimos 4 estadios de gravedad atendiendo a su fenotipo neurológico (video 1). En el estadio I, que coincide con los primeros días de infección, los animales se comportaron como los del grupo control, no manifiestaron síntomas neurológicos, aunque con parasitemias entre el 1-2% (Figura 2B), por lo que se definió como asintomático. En el estadio II (Figura 2C) los ratones presentaron síntomas incipientes propios de MC como desviación de la cabeza o hemiparálisis. En este momento, algunos animales del grupo también expresaron erizamiento del pelo, temblor y giros sobre sí mismos. Los niveles de parasitemia aumentaron, alcanzando valores entre un 8-10% (Figura 2G), y la frecuencia motora disminuyó progresivamente (Figura 3B1). A partir del estadio II, los síntomas neurológicos se agravaron rápida y progresivamente dando lugar a la aparición de los estadios III y IV. En el estadio III las manifestaciones de daĖo neurológico (Figura 2D) son más evidentes (desviación de la cabeza, hemiparálisis/parálisis, elevación pélvica, temblor y disminución notable de la frecuencia motora) (Tabla 1) y la parasitemia alcanzó valores entre un 10 a un 15% (Figura 2G). Finalmente, en el estadio IV se observaron los síntomas más severos y evidentes de la MC (Figura 2E), incluyendo grave desviación de la cabeza, hemiparálisis/parálisis aguda, temblor intenso con total erizamiento del pelo, poca o nula respuesta a estímulos, frecuencia motora sin actividad y presencia de convulsiones que pueden conducir a un estado comatoso y la muerte del animal (Tabla 1). Durante los últimos instantes del estadio III y en el transcurso del IV se observaron en algunos animales signos comunes de retinopatía, otro de los parámetros de diagnóstico asociados a MC. En esta última etapa la parasitemia alcanzó valores máximos de hasta un 18% (Figura 2G).
Tabla 1.- Síntomas y signos clínicos observados durante
el progreso de la infección en ratones con EMC y sin MC. Se muestran los síntomas
no neurológicos expresados en los diferentes estadios de EMC y en ratones sin
MC como: ![]() presencia o
presencia o ![]() Ausencia, y los síntomas neurológicos
manifestados en MC por severidad (I: Incipiente, A: Apreciable y S: Severo),
junto a los porcentajes de los ratones que expresaron dichos síntomas. no: sin
manifestación.
Ausencia, y los síntomas neurológicos
manifestados en MC por severidad (I: Incipiente, A: Apreciable y S: Severo),
junto a los porcentajes de los ratones que expresaron dichos síntomas. no: sin
manifestación.
Ratones con ECM |
Ratones sin MC |
||||
Signos - Síntomas |
Estadio I |
Estadio II |
Estadio III |
Estadio IV |
PLAP/PRAP |
Parasitemia |
|
|
|
|
|
Erizamiento del pelo |
|
|
|
|
|
Disminución de la frecuencia motora |
|
|
|
|
|
Elevación pélvica |
|
|
|
|
|
Temblor |
|
|
|
|
|
Anemia |
|
|
|
|
|
Desviación de la cabeza |
no |
1/20% |
1/35% - A/65% |
A/77% - S/33% |
no |
Parálisis |
no |
1/45% |
A/83% |
S/100 |
no |
Convulsiones |
no |
0% |
34% |
63% |
no |
Coma |
no |
0% |
0% |
<50% |
no |
Cabe destacar que las manifestaciones clínicas individuales observadas durante el progreso de la malaria cerebral no se presentaron al mismo tiempo en todo los animales del grupo experimental (Figura 2F). Los síntomas de infección por Plasmodium suelen aparecer a los pocos días post-infección (2-5 d.p.i), mientras que los primeros síntomas asociados a MC (estadio II) suelen aparecer entre 12 y 24 h. después. Por ello, y considerando que la sintomatología neurológica del estadio II es leve, el diagnóstico de la MC puede establecerse, inequívocamente, cuando los animales han alcanzado el estadio III, el cual aparece transcurridas de 6 a 24 h. desde el estadio anterior. La progresión de la infección por MC condiciona una supervivencia que no supera los 12 días post-infección.
Durante el desarrollo de la infección también se observaron animales que presentaban niveles de parasitemia y tiempos de supervivencia muy diferentes a los expresados por los animales del grupo EMC, por lo que se clasificaron como animales que se infectan por Plasmodium pero no desarrollan malaria cerebral, mostrando un fenotipo clínico diferente (SMC). Un 55% de los ratones del grupo SMC mostraron una progresión de la infección lenta y valores altos de parasitemia (PLAP). Estos animales presentaron porcentajes de parasitemia inicialmente bajos (Ň 10% hasta el día 10 p.i.), similares a los que cursan con MC, pero que aumentan significativamente llegando a alcanzar niveles muy superiores (Ň 60%) a los descritos para MC estándar (Figura 3A2). En este grupo el desarrollo de la infección resultó mucho más lento por lo que el periodo total p.i. fue más amplio y los animales fallecen 15 días después de ser infectados. El resto de los ratones incluidos en el grupo SMC fueron definidos como grupo PRAP ( 45%) porque presentaban una progresión de la infección mucho más rápida que los anteriores, alcanzado valores de hiperparasitemia (>40%) antes de los 4 días p.i. (Figura 3A3), lo que produjo su muerte en la primera semana p.i.
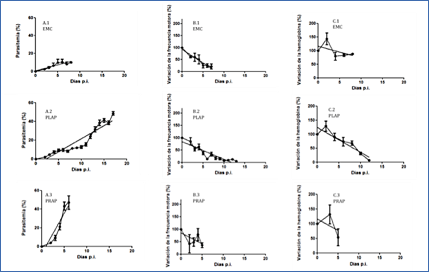
Figura 3.- Diferencias biológicas, motoras y hematológicas entre los distintos grupos experimentales (1. EMC, 2. PLAP y 3. PRAP) durante la caracterización del modelo experimental: (A) Parasitemia (%) (B) Frecuencia motora (%) y (C) Hemoglobina (%). El valor de parasitemia (%) está representado como el promedio de los valores diarios de cada ratón Ī SEM. La variación de la frecuencia motora del animal se expresa en % y representa el promedio de la diferencia que se obtiene para cada ratón con respecto al valor inicial (100%) Ī SEM. La concentración de hemoglobina se expresa en % y representa la media de los valores obtenidos para cada ratón en mg/ml y su diferencia con respecto al valor inicial (100%) Ī SEM.
3.2. Concentración de hemoglobina en sangre
La concentración de hemoglobina en sangre de los ratones infectados se determinó a lo largo del ensayo en días alternos. Los resultados obtenidos durante la infección (Figura 3C) mostraron que existe una relación entre los datos de hemoglobina y el tipo de progresión e infección que cursa el ratón. Así, los ratones del grupo con EMC presentaron valores de hemoglobina (Hb) prácticamente constantes durante el proceso infectivo (Figura 3C1), mientras que en aquellos que no desarrollaron la infección cerebral, PLAP y PRAP, (Figura 3C2 y C3) la concentración de Hb disminuyó al 50% en la primera semana p.i., debido, posiblemente, a la anemia que sufren como consecuencia de la hiperparasitemia que alcanzan estos dos grupos.
3.3. Permeabilidad de la barrera hematoencefálica (prueba del Evan’s Blue)
El cambio de la permeabilidad de la BHE secundario al secuestro de la microvasculatura (18, 36, 37) explica el edema cerebral que frecuentemente acompaĖa a la malaria cerebral. Con el fin de evaluar si las anormalidades en la BHE se asocian a la evolución clínica de la patología cerebral procedimos a valorar la integridad de la misma en el modelo murino clasificado por estadios, utilizando el test de coloración con la solución de “Evan’s Blue”. Como se muestra en la figura 4A, el tejido cerebral extraído de los ratones del grupo MC adquirió la coloración azul propia de la tinción utilizada indicativa del daĖo en la función de la barrera hematoencefálica. La alteración en la BHE aumentó a medida que progresaba la patología cerebral. En la figura 4 se observa que, en el primer estadio, asintomático, la BHE está aún funcional, siendo impermeable a la entrada de la solución de tinción, pero dicha permeabilidad cambia según progresa el cuadro clínico neurológico, detectándose ya en el estadio II entrada del colorante al tejido cerebral, lo que se relaciona con el inicio de los síntomas de la MC. La ruptura más severa en la BHE se detectó en el estadio IV, donde el cerebro adquirió una intensa coloración azul, siendo ese momento cuando los animales manifestaron los síntomas más graves de MC como convulsiones o el coma. En la misma figura se muestran cuatro cerebros que fueron extraídos de los animales pertenecientes a los otros dos grupos de infección caracterizados, dos del grupo PLAP (Figura 4C) y dos del grupo PRAP (Figura 4B), y tratados de la misma forma con la solución de Evan’s Blue. Como se puede observar en las imágenes, en ninguno de estos casos aparecen evidencias de ruptura de la BHE, ya que no hay acumulación de coloración azul en el parénquima cerebral, comportándose igual que la muestra del control sano. El cerebro de los animales del grupo PLAP, fue extraído entre el día 10 y 12 p.i., y en el grupo PLAP las muestras se tomaron en el día 6 p.i., cuando presentaban altos niveles de parasitemia, síntomas de decaimiento general y anemia severa.
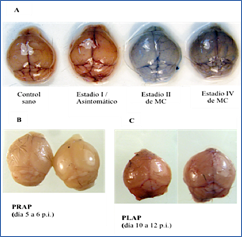
Figura 4.- Fotografías de cerebros murinos tratado con la solución Evan’s Blue. A. Cerebros tomados en los diferentes estadios observados en el transcurso estándar de la Malaria Cerebral. Estadio I o sin MC: ratón sin síntomas neurológicos evidentes. Estadio II: ratón con síntomas neurológicos incipientes. Estadio IV: Ratón con síntomas graves de MC (Coma). B. Cerebros del grupo PRAP, extraídos entre el día 10-12 p.i. C. Cerebros del grupo PLAP, extraídos entre el día 5-6 p.i.
3.4. Efecto del tratamiento con Artesunato sobre el curso de la malaria cerebral en el modelo de fases clínicas
Para comprobar la eficacia del modelo de malaria cerebral clasificado en estadios de afectación, en estudios de terapia antimalárica y adyuvante, se evalúo el efecto del artesunato, droga de elección en el tratamiento de la malaria severa, administrado en monoterapia según las pautas y dosis detalladas en el apartado 3.4 de materiales y métodos. El tratamiento de los ratones que sufren EMC se inició en el estadio III, cuando se establecía un diagnóstico inequívoco de MC mediante la evaluación de sus capacidades neurológicas utilizando distintos test y determinaciones biológicas-hematológicas previamente seleccionados durante la caracterización clínica del modelo. De esta forma, el tratamiento farmacológico se dirige específicamente a la infección cerebral. Una vez iniciada la administración del fármaco se ensayaron los mismos parámetros utilizados para definir los estados clínicos del modelo y valorar así la eficacia del tratamiento durante el curso de la infección.
Con el fin de evaluar también el efecto de la misma terapia con artesunato en aquellos animales del grupo experimental que no desarrollaban MC, se extendió este estudio antimalárico a aquellos ratones que desarrollaron la infección, pero sin manifestar signos asociados a MC. Estos animales se trataron siguiendo la misma pauta terapéutica que la descrita para el grupo anterior. En este caso, y dado que no podía elegirse el inicio del tratamiento según el estadio neurológico en que se encontraban los animales, este se comenzó en el momento en el que los ratones presentaron síntomas graves de decaimiento, similares a un estadio III en EMC, pero sin signos de afectación neurológica.
Un esquema del tratamiento aplicado y los resultados obtenidos se muestra en la figura 5. En el grupo de ratones que manifestó EMC la administración del fármaco consiguió detener el crecimiento del parásito y el proceso infectivo, como demuestran los resultados de parasitemia alcanzados (Figura 6A2), con la recuperación temporal de los valores en los parámetros ensayados (Figura 6B2 y C2), lo que se tradujo en un aumento del tiempo de supervivencia de los animales hasta alcanzar 15 días p.i. Sin embargo, el efecto antimalárico del artesunato no fue suficiente para conseguir eliminar completamente los parásitos circulantes, ya que a partir del cuarto día de tratamiento, la parasitemia vuelve a incrementarse detectándose una clara recrudescencia de la infección (Figura 6A2) que provoca la muerte de los ratones debido a la anemia severa que sufren como consecuencia de los altos niveles de parásitos en sangre alcanzados.
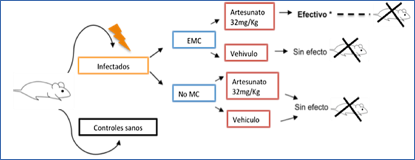
Figura 5.- DiseĖo del tratamiento antimalárico y sus efectos en el transcurso de la infección. Se indican los resultados del tratamiento con Artesunato sobre la supervivencia y rescate de ratones con MC y sin MC en el modelo descrito. Sin efecto: Muerte del animal. Efectivo*: inhibición parcial de la infección con posterior recrudescencia. ---- Aumento de la supervivencia.
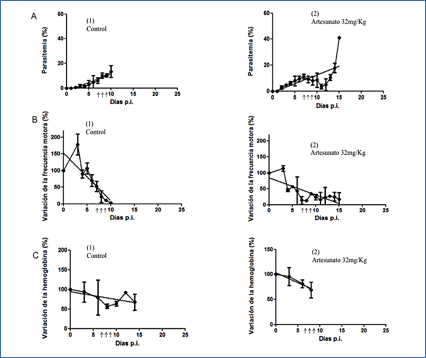
Figura 6.- Efecto del tratamiento con Artesunato sobre los parámetros biológicos, motores y hematológicos evaluados durante la infección con MC. El valor de la parasitemia (%) está representado como el promedio de los valores diarios por grupo Ī SEM. La variación de la frecuencia motora se expresa en %, representando el promedio de la diferencia en porcentaje que tiene cada ratón con respecto al valor inicial (100%) Ī SEM. Hemoglobina expresada en %, representada como el promedio de los valores de cada ratón en mg/ml y su diferencia en porcentaje con respecto al valor inicial (100%) Ī SEM. A. % Parasitemia para el grupo control y EMC. B. Variación de la frecuencia motora para el grupo control y EMC y C. Variación de hemoglobina para el grupo control y EMC. ↑↑↑ Días de inicio de tratamiento (7-9 p.i.).
![]() En
el caso de los ratones sin MC y tratados de la misma forma que los anteriores,
la infección no se vio afectada en ningún punto por el fármaco y el 100% de los
animales siguió la progresión de la misma, muriendo por anemia severa producto
de los altos niveles de parasitemia adquiridos (Figura 7). Los ratones con EMC
o sin MC tratados con bicarbonato al 5% no presentaron cambios durante el
progreso de la infección, y murieron a causa de la MC o de anemia severa,
respectivamente (Figura 6A1).
En
el caso de los ratones sin MC y tratados de la misma forma que los anteriores,
la infección no se vio afectada en ningún punto por el fármaco y el 100% de los
animales siguió la progresión de la misma, muriendo por anemia severa producto
de los altos niveles de parasitemia adquiridos (Figura 7). Los ratones con EMC
o sin MC tratados con bicarbonato al 5% no presentaron cambios durante el
progreso de la infección, y murieron a causa de la MC o de anemia severa,
respectivamente (Figura 6A1).
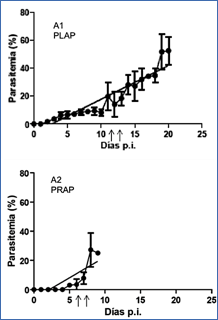
Figura 7.- Resultados del tratamiento con Artesunato en ratones infectados que no desarrollan MC (PLAP-PRAP). La parasitemia (%) representada como el promedio de los valores en % de cada ratón Ī SEM. A1. Parasitemia de ratones infectados con PLAP y tratados con Artesunato 32 mg/kg. Días del inicio de tratamiento (11-12 p.i.). A2. Parasitemia de ratones infectados con PRAP y tratados con Artesunato 32 mg/kg. Días del inicio de tratamiento (6-7 p.i.).
4. discusión
A pesar de la controversia que existe respecto a su validez, los modelos animales constituyen una herramienta imprescindible y extraordinariamente útil para el estudio del desarrollo de la malaria cerebral (26, 38), siendo los modelos murinos los de elección en la investigación experimental de la patología in vivo. Aunque existen diferencias entre la patología humana y murina, son muchos los estudios que destacan las numerosas similitudes que tiene la infección de ratones de la estirpe C57BL/6 con P. berghei ANKA con el desarrollo de la enfermedad en el hombre (25, 26). No obstante, este modelo, ampliamente utilizado para el estudio de la patología cerebral, ha sido poco explotado en ensayos de terapia antimalárica y de terapias adyuvantes que puedan ser neuroprotectoras y que contribuyan al rescate de las secuelas neurológicas. Ello es, posiblemente, debido a la complejidad que el modelo presenta en relación a la heterogeneidad de síntomas y el tiempo de expresión de los mismos, y a que aún no se conocen por completo las secuencias de eventos clínicos y moleculares que acontecen en el hospedador (26-28, 38). Al igual que sucede en pacientes que sufren MC (8, 16, 26, 36), esta heterogeneidad entre individuos durante el transcurso de la infección representa un problema para el diagnóstico de la enfermedad, dificultando enormemente la administración de una terapia específica y eficaz para la infección cerebral, que conduce en muchas ocasiones a un daĖo cerebral irreversible o la muerte del paciente (8, 9, 22).
La mayoría de los estudios sobre MC llevados a cabo con este modelo definen la severidad de la enfermedad y sus manifestaciones en términos de días post-infección (19, 26). Sin embargo, debido a la diferencia temporal que presentan los animales en la aparición de los primeros síntomas y en el propio progreso de la infección, unido a que no todos los ratones infectados desarrollan la infección cerebral, parece más indicado clasificar a los animales de acuerdo a las manifestaciones fenotípicas neurológicas que van adquiriendo. Utilizando este último criterio, esta investigación pone de manifiesto la ventaja de agrupar los eventos neurológicos que suceden en la MC en estadios (I-IV), cada uno de ellos con cambios y expresión de síntomas y signos regulares, mediante la evaluación constante de funciones neurocognitivas, biológicas y motoras del animal, estandarizando así un protocolo analítico que, además, permita la identificación precisa de los individuos que desarrollan la infección cerebral de aquellos que no lo hacen.
Varios de los síntomas asociados a MC descritos por otros autores (19, 26) fueron observados en los animales de nuestro ensayo con EMC; sin embargo, el momento de expresarlos fue distinto en cada individuo. Los signos incipientes aparecieron en el día 6-7 p.i., mientras que los síntomas más graves se observaron entre las 6-30 h posteriores.
Junto a estos animales se identificaron y caracterizaron ratones que desarrollaban una infección malárica pero sin las características de la patología cerebral, los cuales presentaban a su vez progresiones de infección distintas y con parasitemias que podían llegar al 70%. Esta heterogeneidad también es propia de la MC humana, donde solo entre el 2 y el 5% de los niĖos infectados desarrollan la forma cerebral (13, 15, 18). Esta nueva caracterización del modelo murino permite disminuir la variabilidad fenotípica, producto de la heterogeneidad en la experimentación, y pone de manifiesto la necesidad de establecer un buen diagnóstico de MC después de la infección que facilite la evaluación de tratamientos farmacológicos que puedan generar resultados más confiables y precisos.
El artesunato es actualmente la droga más potente, aprobada y establecida para ser la primera opción de tratamiento en adultos y niĖos con malaria severa producida P. falciparum. Se ha demostrado que el artesunato es capaz de inhibir tanto las formas maduras como las jóvenes del parásito y de ahí su versatilidad (22, 39). Su acción antiplasmódica sobre P. berghei ANKA también ha sido descrita (40) y recientemente se ha visto un posible efecto de rescate sobre secuelas neurológicas en ratones que se recuperan de la MC (27). Por todo ello, en este trabajo se evaluó la capacidad antimalárica del artesunato utilizando nuestro modelo de MC organizado en estadios de afectación para seleccionar el comienzo del tratamiento de forma que se dirigiera específicamente a los animales con malaria cerebral. Así, la administración del fármaco se inició exclusivamente en los ratones que estaban en el estadio III de EMC, manifestando claramente los síntomas y signos propios de infección cerebral. Los resultados demostraron la capacidad antimalárica del artesunato, logrando detener el progreso infección y sus síntomas desde la primera dosis del tratamiento. Sin embargo, este efecto fue solo temporal, apareciendo un cuadro grave de recrudescencia de la infección 4 días después de iniciado el tratamiento. Resultados similares fueron obtenidos previamente por otros autores (Gumede y col. 2003, Clemmer y col.) que demostraron que el artesunato administrado oral e intraperitonealmente en el mismo modelo experimental murino inhibe el crecimiento de P. berghei ANKA, pero induce una gran recrudescencia de la infección (27, 40). Cabe destacar que el inicio de la terapia en dicho estudio se realizó en todos los animales a la vez, seleccionado el día post infección y no de acuerdo a la manifestación clínica de la enfermedad. De esta forma su tratamiento se aplica en el día 6 p.i, cuando los ratones expresaban síntomas muy leves a nivel motor. En cualquier caso, una terapia con artesunato en dosis más altas y en tiempo más prolongado podría ser suficiente para inhibir completamente la infección y evaluar el efecto de rescate en las secuelas residuales. Por otro lado, el tratamiento con el fármaco en aquellos ratones de nuestro ensayo que progresaron en la infección sin desarrollar MC no tuvo efecto antimálarico alguno, provocando la inevitable muerte del animal por anemia en pocos días. Es por tanto que esta nueva clasificación del progreso de la malaria cerebral en estadios agrupados, en función de la gravedad del cuadro neurológico de los individuos infectados, resulta esencial para llevar a cabo estudios que ayuden a elucidar los procesos patológicos y clínicos claves de la enfermedad humana, reduciendo al mínimo la variabilidad producida por la heterogeneidad en el desarrollo de la malaria experimental murina.
5. conclusioneS
La nueva disección del modelo murino de malaria cerebral con P. berghei ANKA y ratones C57BL/6 mediante la evaluación combinada de parámetros biológicos, hematológicos y neurológicos permitirá abordar estudios farmacológicos de eficacia de terapias antimaláricas y de rescate de secuelas neurocognitivas y motoras de forma específica durante el transcurso de infección cerebral.
6. REFERENCIAS
1. Enayati, A. a. H., J., Malaria Management: Past, Present and Future, The Annual Review of Entomology, 55, 569 (2010).
2. WHO, World Malaria Report 2011. , Data, W. L. C.-i.-P., Ed., World Health Organization Switzerland (2011).
3. Miller, L., Baruch, D., Marsh, K. and Doumbo, O., The Pathogenic basis of malaria, Nature, 415, 673 (2002).
4. Hausmann, K., Hülsmann, N. and Radek, R. , Protistology (2003).
5. Schofield, L. a. G., G. , Immunological Processes in Malaria Pathogenesis, Nature, 5, 722 (2005).
6. Mackintosh, C., Beeson, J. and Marsh, K., Clinical Features and Pathogenesis of Severe Malaria, TRENDS in Parasitology, 20, 597 (2004).
7. Newton, C. a. K., S. , Severe Falciparum Malaria in Children: Current Understanding of Pathophysiology and Supportive Treatment., Pharmacology and Therapeutics, 79, 1 (1998).
8. Newton, C., Hien, T. and White, N., Cerebral Malaria, Journal Neurology Neurosurg Psychiatry, 69, 433 (2000).
9. Idro, R., Jenkins, N. and Newton C. , Pathogenesis, clinical features, and neurological outcome of cerebral malaria, The Lancet. Neurology, 4, 827 (2005).
10. Bentivoglio, M., Mariotti, R., Bertini, G. , Neuroinflammation and brain infections: Historical context and current perspectives. , Brain Research Review, 66, 152 (2010).
11. Bangirana, P., Idro, R., John, C., Boivin, M., Rehabilitation for cognitive impairments after cerebral malaria in African children: strategies and limitations, Tropical Medicine and International Health, 2, 1341 (2006).
12. Boivin, M., Bangirana, P., Byarugaba, J., Opoka, R., Idro, I., Jurek, A. and John, C. , Cognitive Impairment After Cerebral Malaria in Children: A prospective Study., Pediatrics 119, 360 (2006).
13. Idro, R., Kakooza, A., Balyejjussa, S., Mirembe, G., Mugasha, C., Tugumisirize, J. and Byarugaba, J., Severe neurological seguelae and behavior problems after cerebral malaria in Ugandan children BioMed Central Research notes, 3, 1 (2010).
14. Carter, J., Mung'ala, V., Neville, B., Murira, G., Mturi, N., Musumba, C. and Newton, C. , Persistent neurocognitive impairments associated with severe falciparum malaria in Kenyan children, Journal of Neurology, Neurosurgery and Psychiatry., 76, 476 (2005).
15. John, C., Bangirana, P., Byarugaba, J., Opoka, R., Idro, R., Jurek, A., Wu, B. and Boivin, M. , Cerebral Malaria in children is associated with Long-term cognitive impairment, Pediatrics, 122, 92 (2008).
16. Medana, I. a. T., G. , Human Cerebral Malaria and the Blood-brain Barrier, International Journal for Parasitology, 36, 555 (2006).
17. Mishra, S. a. W., L., Advances in the management of cerebral malaria in adults, Current Opinion in Neurology, 22, 302 (2009).
18. Idro, R., Marsh, K., John, C. and Newton, C., Cerebral Malaria; Mechanisms of Brain Injury and Strategies for Improved Neuro-Cognitive Outcome, Pediatrics, 56, 163 (2010).
19. Lackner, P., Beer, R., Heussler, V., Goebel, G., Rudzki, D., Helbok, R., Tannich, E. and Schmutzhard, E. , Behavioral and histopathological alterations in mice with cerebral malaria., Neuropathol Appl Neurobiol, 32, 177 (2006).
20. Zapata, C. T., S., Malaria Cerebral IATREIA, 16, 202 (2003).
21. Boivin, M., Effects of early cerebral malaria on cognitive ability in senegalese children Pediatrics, 23, 353 (2002).
22. WHO, Guidelines for the treatment of P. falciparum malaria in WHO Library cataloguing-in-Publication Data, Programme, G. M., Ed., World Health Organization Switzerland (2010).
23. Dondorp, A., Pathophysiology, clinical presentation and treatment of Cerebral Malaria, Neurology Asia, 10, 67 (2005).
24. Reis, P., Comim, C., Hermani, F., Silva, T., Barichello, T., Portella, A., Gomes, F., Sab, I., Frutuoso, V., Oliveira, M., Bozza, P., Pizzol, F., Zimmerman, G., Quevedo, J. and Neto, H., Cognitive Dysfunction is Sustained after Rescue Therapy in Experimental cerebral Malaria, and is Reduced by Additive Antioxidant Therapy., PLOS pathogens 6, 1 (2010).
25. Lou, J., Lucas, R. and Grau, G., Pathogenesis of Cerebral Malaria: Recent Experimental Data and Possible Applications for Humans, Clinical Microbiology Reviews, 14, 810 (2001).
26. De Souza, B., Hafalla, J., Riley, E., Couper, K., Cerebral Malaria: why experimental murine models are required to understand the pathogenesis of disease., Parasitology, 137, 755 (2009).
27. Clemmer L., M. Y., Zanini G., Frangos A., Carvalho L. , Artemether and artesunate show the highest efficacies in rescuing mice with late-stage cerebral malaria and rapidly decrease leukocyte accumulation in the brain., Antimicrobial Agents and Chemotherapy., 55, 1383 (2011).
28. Bienvenu A., F. J., Kaiser K., Latour C., Picot S., Artesunate - Erythropoietin combination for murine cerebral malaria treatment., Acta Tropica, 106, 104 (2008).
29. Carvalho, L., Murine cerebral malaria: how far from human cerebral malaria? , TRENDS in Parasitology, 26, 271 (2010).
30. White, N., Turner, G., Medana, I., Dondorp, and A Day, N. , The murine cerebral malaria phenomenon, TRENDS in Parasitology, 26 (2009).
31. Kicska, G. A., T. Li-Min, V. L. Shramm, and K. Kim., Effect of dietary p-aminobenzoic acid on murine Plamodium yoelii infection. , The Journal of Infectious Diseases, 188, 4680 (2003).
32. Calderon, J., BolaĖos, R., Carrillo, J., Escamilla, C., Salazar, S., Moreno, G. and Rivera, G., Behavioral analysis of the Reserpine induced motor changes in a Parkinsonian mouse model. , Neuropsicología, Neuropsiquiatría y Neurociencias., 11, 49 (2011).
33. Tadaiesky M., A. R., Vital M. , Different effects of 7-nitroindazole in reserpine- induced hypolocomotion in two strains of mice. , European Journal of Pharmacology, 535, 199 (2006).
34. Lambertsen, C. J. B., PL. Drabkin, DL, Schimidt, C., Relationship of oxygen tension to hemoglobin oxygen saturation in the arterial blood of normal men, Journal Applied Physiology, 1952, 873 (1952).
35. Kozler, P. a. P., J., Altered Blood-Brain Barried Permeability and Its Effect on the Distribution of Evans Blue and Sodium Fluoresce in the Rat Brain Applied by Intracarotid Injection Physiological Research 52, 607 (2003).
36. Van der Heyde, H. N., J. Combes, V. Gramaglia, I. Grau, GE., A unified hypothesis for the genesis of cerebral malaria: sequestration, inflammation and hemostasis leading to microcirculatory dysfunction. , TRENDS in Parasitology, 22, 503 (2006).
37. Pongponratin, E., Turner, G., Day, N., Phu, N., Simpson, J., Stepniewska, K., Mai, N., Vejakul, P., Looreesuwan, S., Hien, T., Ferguson, D. and White, N. , An Ultrastructural Study of the Brain in Fatal Plasmodium Falciparum Malaria, The American Society of Tropical Medicine and Hygiene, 69, 345 (2003).
38. Combes, V., De Souza, B., Rénia, L., Hunt, N. and Grau, G. , Cerebral Malaria: Which parasite? which model? , Progress in Neurobiology, 91, 140 (2006).
39. AQUAMAT, G., Artesunate versus Quinine in the treatment of severe falciparum malaria in African children (AQUAMAT): an open-label, randomized trial. , The Lancet, 376, 1647 (2010).
40. Gumede, B. F., P. Ryffel, B., Oral artesunate prevents Plasmodium berguei Anka infection in mice, Parasitology International 52, 53 (2003).